- 2021-08-23 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省自贡市田家炳中学2019-2020学年高二上学期期中考试化学试题
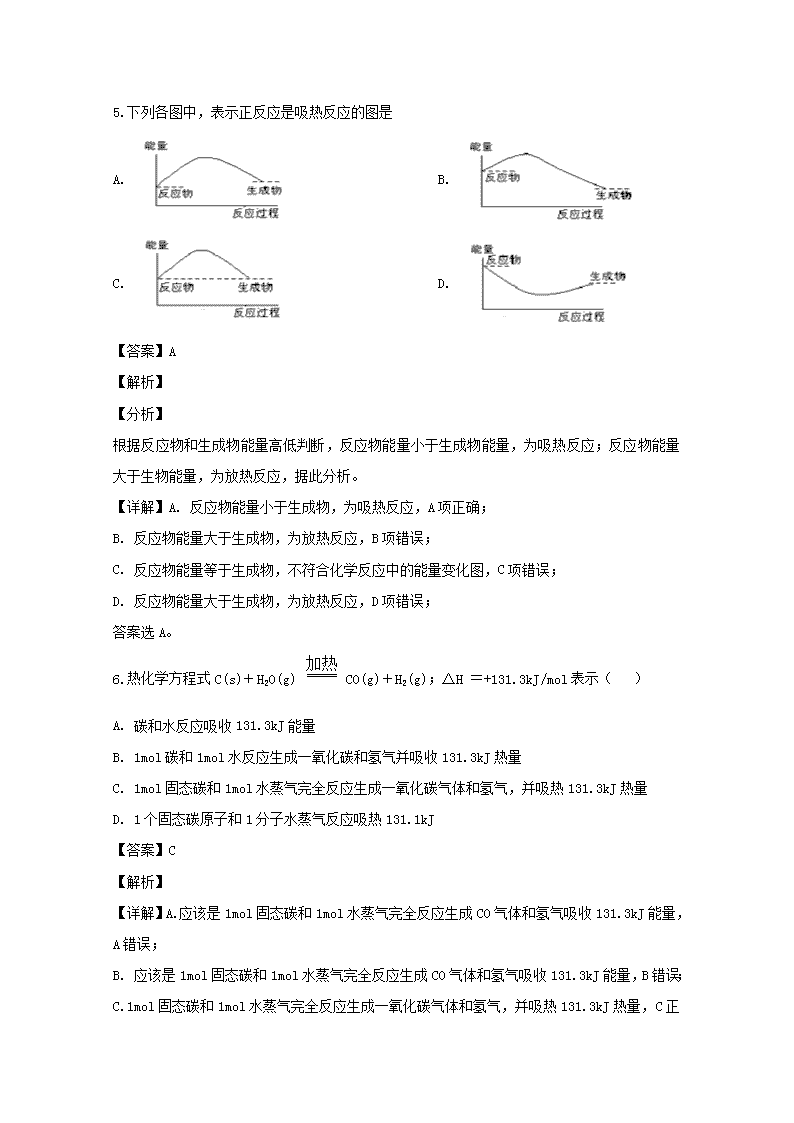
自贡市田家炳中学高2021级高二化学上学期期中考试试题 可能用到的相对原子质量:H-1,C-12,N-14,O-16,S-32, Cl-35.5,Na-23 ,K-39,Al-27,Fe-56,Zn-65,Cu-64 一、选择题 1.下列变化中属于吸热反应的是 ①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰 ⑥水煤气反应 ⑦二氧化碳与赤热的炭反应生成一氧化碳 A. ①④⑦ B. ②③⑥ C. ①④⑤ D. ②④⑥⑦ 【答案】D 【解析】 【详解】①液态水汽化,即水由液态到气态需要吸热,是物理变化过程,不是化学反应,故①错误; ②胆矾加热失去结晶水变成白色粉末,需要吸热,为吸热反应,故②正确; ③浓硫酸稀释放出大量的热,是放热过程,故③错误; ④氯酸钾分解需要吸热,为吸热反应,故④正确; ⑤生石灰跟水反应生成熟石灰会放出大量的热,为放热反应,故⑤错误; ⑥水煤气反应是碳与水的反应,是吸热反应,故⑥正确; ⑦二氧化碳与赤热的炭反应,是吸热反应,故⑦正确; 属于吸热反应的有②④⑥⑦,故选D。 【点睛】熟记常见的放热反应和吸热反应是解题的关键,注意归纳常见的吸热反应,绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱)。本题的易错点为①,液态水汽化,不属于化学变化。 2.已知:H2(g)+F2(g) === 2HF(g) △H=-270kJ/mol,下列说法正确的是( ) A. 1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ B. 1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ C. 在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 D. 2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量 【答案】C 【解析】 该反应是放热反应,则C正确D错;热化学方程式中化学式前的计量数为物质的量,所以A错;生成2mol液态氟化氢比生成2mol气态氟化氢放热多,B错。 3.已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量 下列叙述正确的是 A. 氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g) B. 氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/mol C. 氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183kJ/mol D. 氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol 【答案】C 【解析】 反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此生成2mol氯化氢的反应热是436 kJ/mol+243 kJ/mol-2×431 kJ/mol=-183 kJ/mol,所以选项C正确,其余都是错误的,答案选C。 4.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ。且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H—O键形成时放出热量463kJ,则氢气中1mol H—H键断裂时吸收热量为( ) A. 920kJ B. 557kJ C. 436kJ D. 188kJ 【答案】C 【解析】 【详解】已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,所以2molH2和1molO2生成2mol水蒸气,放出的热量为121kJ×4=484kJ,故氢气完全燃烧生成水蒸气的热化学方程式为2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol,设氢气中1molH﹣H键断裂时吸收热量为x,2molH2和1molO2生成2mol水蒸气,需要断裂2molH﹣H键和1molO=O键,消耗的热量为(2x+496kJ),生成2mol的水蒸气时形成4molH-O键,放出的热量为463kJ×4=1852kJ,即H—H键形成时放出热量=(4634-496-484)/2=436kJ,所以C选项正确。 故选C。 5.下列各图中,表示正反应是吸热反应的图是 A. B. C. D. 【答案】A 【解析】 【分析】 根据反应物和生成物能量高低判断,反应物能量小于生成物能量,为吸热反应;反应物能量大于生物能量,为放热反应,据此分析。 【详解】A. 反应物能量小于生成物,为吸热反应,A项正确; B. 反应物能量大于生成物,为放热反应,B项错误; C. 反应物能量等于生成物,不符合化学反应中的能量变化图,C项错误; D. 反应物能量大于生成物,为放热反应,D项错误; 答案选A。 6.热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示( ) A. 碳和水反应吸收131.3kJ能量 B. 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 C. 1mol固态碳和1mol水蒸气完全反应生成一氧化碳气体和氢气,并吸热131.3kJ热量 D. 1个固态碳原子和1分子水蒸气反应吸热131.1kJ 【答案】C 【解析】 【详解】A. 应该是1mol固态碳和1mol水蒸气完全反应生成CO气体和氢气吸收131.3kJ能量,A错误; B. 应该是1mol固态碳和1mol水蒸气完全反应生成CO气体和氢气吸收131.3kJ能量,B错误; C. 1mol固态碳和1mol水蒸气完全反应生成一氧化碳气体和氢气,并吸热131.3kJ热量,C正确; D. 根据以上分析可知D错误; 答案选C 【点睛】一定要注意热化学方程式中物质的化学计量数表示物质的物质的量,而不表示分子数,其次还要体现出来物质的状态,“+”表示反应吸热,“-”表示放热。 7.反应2A(g)2Y(g) + E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( ) A. 加压 B. 减压 C. 减小E的浓度 D. 降温 【答案】D 【解析】 【分析】 达平衡时,要使v正降低,可采取降低温度、减小压强或减小浓度的措施,使c(A)增大,应使平衡向逆反应方向移动,据此结合选项分析解答。 【详解】A、增大压强,平衡向逆反应方向移动,A的浓度增大,但正、逆反应速率都增大,故A错误; B、降低压强,正、逆速率都减小,平衡向正反应方向移动,A的浓度降低,故B错误; C、减小E的浓度,平衡向正向反应方向移动,A的浓度减小,正逆反应速率减小,故C错误; D、正反应为吸热反应,降低温度,平衡逆反应方向移动,正、逆反应速率都减小,A的浓度增大,故D正确。 故选D。 8.在2A+B3C+D反应中,表示该反应速率最快的是 ( )。 A. υ(A)= 0.5 mol/(L·s) B. υ(B)= 0.3 mol/(L·s) C υ(C)= 0.8 mol/(L·s) D. υ(D)= 1 mol/(L·s) 【答案】D 【解析】 试题分析:同一个化学反应,用不同物质表示其反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,应该根据速率之比是相应的化学计量数之比先换算成用同一种物质表示,然后才能直接比较速率数值。所以根据反应的方程式可知,如果都要物质C表示反应速率,则分别是0.75 mol/(L·s)、0.9 mol/(L·s)、0.8 mol/(L·s)、3 mol/(L·s),所以答案选D。 考点:考查反应速率快慢的判断 点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力。该题还需要注意的是在进行反应速率的转换时,还要注意单位的统一。 9.一定条件下反应2AB(g)A2(g)+B2(g)达到平衡状态的标志是 ( ) A. 单位时间内生成n mol A2,同时消耗2n mol AB B. 容器内,3种气体AB、A2、B2共存 C. AB的消耗速率等于A2的消耗速率 D. 容器中各组分的浓度不随时间变化 【答案】D 【解析】 【分析】 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。 【详解】A、单位时间内生成nmolA2的同时消耗2n molAB,都体现正向反应,不能说明反应达到平衡状态,故A错误; B、可逆反应只要反应发生,就是反应物和生成物共存的体系,不能说明反应达到平衡状态,故B错误; C、速率之比等于化学方程式计量数之比,AB的消耗速率等于A2的消耗速率的2倍说明反应达到平衡状态,但AB的消耗速率等于A2的消耗速率不能说明反应达到平衡状态,故C错误; D、容器中各组分的浓度不随时间变化,说明达平衡状态,故D正确; 故选D。 10.在可逆反应中,改变下列条件一定能加快反应速率的是( ) ①增大反应物浓度 ②升高温度 ③增大压强 ④使用催化剂 ⑤增大体积 A. 全部 B. ①② C. ①②③ D. ①②③④ 【答案】B 【解析】 【详解】①增大反应物浓度,单位体积内活化分子数增加,有效碰撞几率增加,化学反应速率一定加快; ②升高温度,单位体积内活化分子数增加,分子运动加快,有效碰撞几率增加,化学反应速率一定加快; ③增大压强,对于没有气体参加的反应,增大压强对化学反应速率几乎无影响; ④使用催化剂,正向催化剂一般能够加快化学反应速率,但若加入的是负催化剂,化学反应速率将减慢; ⑤增大体积,单位体积内活化分子数减少,有效碰撞几率降低,化学反应速率降低; 综上所述,答案为B。 11.一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( ) A. 保持温度和容器体积不变,充入2 mol SO3(g) B. 保持温度和容器内压强不变,充入2 mol SO2(g) C. 保持温度和容器内压强不变,充入1 mol O2(g) D. 保持温度和容器体积不变,充入1 mol N2 (g) 【答案】D 【解析】 【分析】 达到平衡后,改变条件,SO3的平衡浓度不改变,说明为等效平衡,恒温恒容按化学计量数转化到左边满足2molSO2,1molO2或恒温恒压按化学计量数转化到左边满足n(SO2):n(O2)=2:1,再结合平衡移动分析。 【详解】A、温度和容器的体积不变,充入2molSO3(g),按化学计量数转化到左边,得到n(SO2)=2mol,n(O2)=1mol,原平衡中还存在SO2、O2,故n(SO2)、n(O2)不满足2molSO2,1molO2,与原来的平衡不是等效平衡,所以SO3气体平衡浓度改变,故A不符合; B、温度和容器内压强不变,充入2 mol SO2(g),平衡将正向移动,所以SO3气体平衡浓度改变,故B不符合; C、保持温度和容器的压强不变,充入1molO2(g),增大反应物的浓度,平衡向正反应移动,SO3的平衡浓度改变,故C不符合; D、保持温度和容器体积不变,充入1mol N2 (g),各反应物浓度不变,化学平衡不移动,所以SO3的浓度不变,故D符合; 答案为D。 12.在一定温度下,1 mol CO和2 mol H2O通入一个密闭容器中:CO(g)+H2O (g)CO2(g)+H2 (g),一定时间后达到平衡,此时,CO的含量为p%,若维持温度不变,改变起始加入物质的物质的量,平衡时CO的含量仍为p%的是( ) A. 1 mol CO2、2 mol H2 B. 0.2 mol CO2、0.2 mol H2、0.8 mol CO、1.8 mol H2O C. 1 mol CO2、1 mol H2O D. 1 mol CO2、 1 mol H2、 2 mol H2O 【答案】B 【解析】 【详解】维持温度不变,改变起始加入物质的物质的量,平衡时CO的含量仍为p%,说明二者互为等效平衡,该反应为气体等体积反应,“一边倒”后,需满足n(CO):n(H2O)=1:2即可。 A、1 mol CO2、2 mol H2转化到左边,得到n(CO)=1mol、n(H2O)=1mol、n(H2)=1mol,与原平衡不等效,故A不符合; B、0.2 mol CO2、0.2 mol H2、0.8 mol CO、1.8 mol H2O转化到左边,得到n(CO)=1mol、n(H2O)=2mol,与原平衡完全等效,故B符合; C、CO2与H2O充入后不能发生CO(g)+H2O (g)CO2(g)+H2(g),故C不符合; D、1 mol CO2、 1 mol H2、 2 mol H2O转化到左边,得到n(CO)=1mol、n(H2O)=3mol,与原平衡不等效,故D不符合; 答案选B。 【点睛】等效平衡的判断方法 (1)恒温、恒容条件下反应前后体积改变的反应;判断方法:极值等量即等效; (2)恒温、恒压条件下反应前后体积改变的反应;判断方法:极值等比即等效; (3)恒温条件下反应前后体积不变的反应;判断方法:无论是恒温、恒容,还是恒温、恒压,只要极值等比即等效,因为压强改变对该类反应的化学平衡无影响。 13.在恒温恒容的密闭容器中,发生反应X(g)+2Y(g)D2Z(g),能说明反应一定达到化学平衡状态的是 ①X、Y、Z的物质的量之比为1: 2 : 2 ②X、Y、Z的浓度不再发生变化 ③容器中气体的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol X A. ①② B. ①④ C. ②③ D. ③④ 【答案】C 【解析】 【详解】①X、Y、Z的物质的量之比1:2:2时,该反应可能达到平衡状态,也可能没有达到平衡状态,这与反应产生物质的量和转化率有关,故错误; ②该反应达到平衡状态时,X、Y、Z的浓度不再发生变化,所以能说明该反应达到平衡状态,故正确; ③该反应是一个反应前后气体体积减小的可逆反应,当反应达到平衡状态时,各物质的浓度不再变化,则容器中的压强不再发生变化,故正确; ④单位时间内生成n mol Z,同时生成2n mol X,正逆反应速率不相等,该反应没有达到平衡状态,故错误; 故选C。 14.在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表: 物 质 X Y Z 初始浓度/ mol·L-1 0.1 0.2 0 平衡浓度/ mol·L-1 0.05 0.05 0.1 下列说法错误的是 A. 反应达到平衡时,X的转化率为50% B. 增大压强,使平衡向生成Z的方向移动,平衡常数增大 C. 反应可表示为X+3YD2Z,其平衡常数为1600 D. 改变温度可以改变此反应的平衡常数 【答案】B 【解析】 【详解】A.反应达到平衡时,X的转化率为:(0.1mol/L−0.05mol/L)/0.1mol/L×100%=50%,故A正确; B.增大压强平衡向生成Z的方向移动,但平衡常数不变,故B错误; C.K=c2(Z)/[c(X)⋅c3(Y)]=(0.1mol/L)2/[(0.05mol/L)×(0.05mol/L)3]=1600(mol/L)−2,故C正确; D.平衡常数只受温度的影响,温度改变时,化学平衡常数一定变化,故D正确; 故选B。 15.一定温度下,在一个容积固定的密闭容器中有可逆反应 A2(g) + B2(g)2AB(g),达到平衡的标志是 A. 容器内气体的总压强不随时间的变化而变化 B. 单位时间内生成n mol A2同时就有2 n mol AB生成 C. 容器内气体的密度不随时间的变化而变化 D. 单位时间内有n mol B2生成同时就有n mol AB分解 【答案】B 【解析】 【详解】A.可逆反应中等号两边气体计量数相等,则反应过程中容器的压强不变,压强不能作为是否平衡的标准,A错误; B. 单位时间内生成n mol A2,即消耗2nmol的AB,同时就有2 n mol AB生成,反应的方向相反,大小相等,可判断已到达平衡状态,B正确; C.反应体系中所有物质均为气体,则气体质量不变,而容器的容积不变,则密度自始至终不变,密度不能作为平衡的依据,C错误; D. 单位时间内有n mol B2生成同时就有n mol AB分解,方向相同,不能判断是否为反应过程中还是平衡状态,D错误; 答案为B 16.有一处于平衡状态的反应X(g)+3Y(g)2Z(g) △H<0,为了使平衡向生成Z的方向移动,应选择的条件是( ) ①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥ 【答案】C 【解析】 【详解】为了使平衡向生成Z的方向移动,应使平衡正向移动,可增大压强、降低温度,以及加入反应物,减小生成物等,以此解答该题。 【点睛】①升高温度,平衡逆向移动,故①错误; ②降低温度,平衡正向移动,故②正确; ③缩小容器的体积,压强增大,平衡向正反应移动,故③正确; ④降低压强,平衡逆向移动,故④错误; ⑤加催化剂,平衡不移动,故⑤错误; ⑥分离出Z,即减小生成物的浓度,平衡正向移动,故⑥正确; 综上所述,答案为C。 17.一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( ) A. 只有③④ B. ②③④ C. ①②③④ D. ①②③④⑤ 【答案】A 【解析】 【分析】 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。 【详解】①如果两边的化学计量数之和相等,体系的压强始终不变,所以不一定平衡,故不符合题意; ②容积恒定,所以容器内气体密度一直不变,则体系的密度不再发生变化,不一定是平衡状态,故不符合题意; ③各组分的物质的量浓度不再改变,说明各物质的量不变,反应达平衡状态,故符合题意; ④各组分的质量分数不再改变,说明各物质的质量不变,反应达平衡状态,故符合题意; ⑤只要反应发生就有反应速率v(A):v(B):v(C):v(D)=m:n:p:q,所以不一 定是平衡状态,故不符合题意; 综上所述,答案为A。 18.可逆反应mA(s)+nB(g)eC(g)+fD(气)反应过程中,当其他条件不变时,C的体积分数在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是( ) A. 达到平衡后,若使用催化剂,C的体积分数将增大 B 当平衡后,若温度升高,化学平衡向逆反应方向移动 C. 化学方程式中,n>e+f D. 达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 【答案】B 【解析】 【分析】 由图①可知,根据先拐先平衡,条件高,则温度升高C的百分含量降低,说明升高温度平衡向逆反应方向移动,则该反应的正反应为放热反应,同理据图②可以看出增大压强,C的百分含量降低,说明增大压强平衡向逆反应方向移动,则应有n查看更多