- 2021-08-23 发布 |
- 37.5 KB |
- 98页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习以速率、平衡为中心的原理综合题课件(98张)(全国通用)
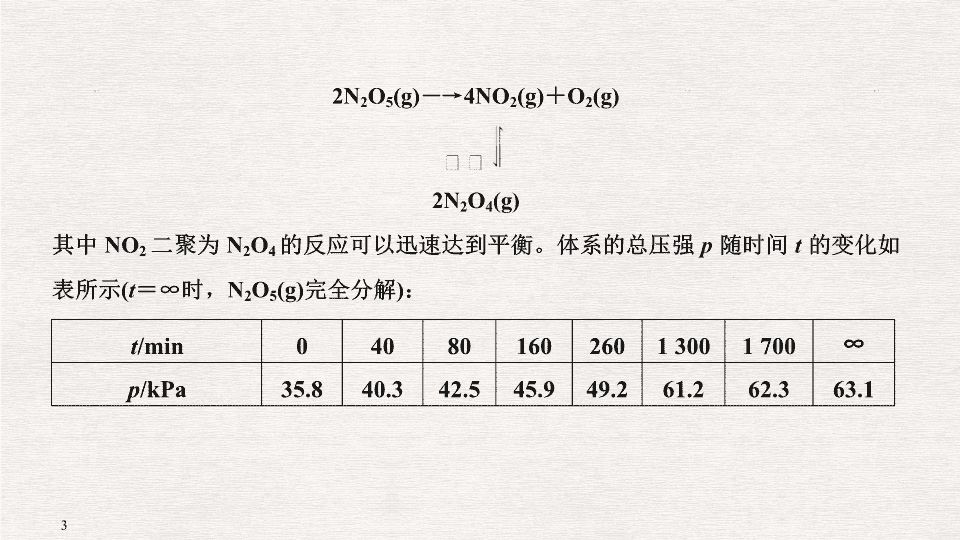
第 9 题 以速率、平衡为中心的原理综合题 复习建议: 4 课时 ( 题型突破 2 课时 习题 2 课时 ) 1 . (2018· 课标全国 Ⅰ , 28) 采用 N 2 O 5 为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题: (1)1840 年 Devil 用干燥的氯气通过干燥的硝酸银,得到 N 2 O 5 。该反应的氧化产物是一种气体,其分子式为 ________ 。 (2)F.Daniels 等曾利用测压法在刚性反应器中研究了 25 ℃ 时 N 2 O 5 (g) 分解反应: t /min 0 40 80 160 260 1 300 1 700 ∞ p /kPa 35.8 40.3 42.5 45.9 49.2 61.2 62.3 63.1 答案 (1)O 2 (2) ① 53.1 ② 30.0 6.0 × 10 - 2 ③ 大于 温度升高,体积不变,总压强增大; NO 2 二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强增大 ④ 13.4 (3)AC 2 . (2018· 课标全国Ⅱ, 27) CH 4 CO 2 催化重整不仅可以得到合成气 (CO 和 H 2 ) ,还对温室气体的减排具有重要意义。回答下列问题: 某温度下,在体积为 2 L 的容器中加入 2 mol CH 4 、 1 mol CO 2 以及催化剂进行重整反应,达到平衡时 CO 2 的转化率是 50% ,其平衡常数为 ________ mol 2 ·L - 2 。 (2) 反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表: 积碳反应 CH 4 (g)=== C(s) + 2H 2 (g) 消碳反应 CO 2 (g) + C(s) ===2CO(g) Δ H /(kJ·mol - 1 ) 75 172 活化能 (kJ·mol - 1 ) 催化剂 X 33 91 催化剂 Y 43 72 ① 由上表判断,催化剂 X________Y( 填 “ 优于 ” 或 “ 劣于 ” ) ,理由是 ____________________________________________________________ 。 在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图 1 所示,升高温度时,下列关于积碳反应、消碳反应的平衡常数 ( K ) 和速率 ( v ) 的叙述正确的是 ________( 填标号 ) 。 A . K 积 、 K 消 均增加 B . v 积 减小、 v 消 增加 C . K 积 减小、 K 消 增加 D . v 消 增加的倍数比 v 积 增加的倍数大 ② 在一定温度下,测得某催化剂上沉积碳的生成速率方程为 v = k · p (CH 4 )·[ p (CO 2 )] - 0.5 ( k 为速率常数 ) 。在 p (CH 4 ) 一定时,不同 p (CO 2 ) 下积碳量随时间的变化趋势如图 2 所示,则 p a (CO 2 ) 、 p b (CO 2 ) 、 p c (CO 2 ) 从大到小的顺序为 _________________________________________________ 。 3 . (2018· 课标全国 Ⅲ , 28) 三氯氢硅 (SiHCl 3 ) 是制备硅烷、多晶硅的重要原料。回答下列问题: (1)SiHCl 3 在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成 (HSiO) 2 O 等,写出该反应的化学方程式 ________________________________________ 。 (2)SiHCl 3 在催化剂作用下发生反应: 2SiHCl 3 (g)===SiH 2 Cl 2 (g) + SiCl 4 (g) Δ H = 48 kJ·mol - 1 3SiH 2 Cl 2 (g)===SiH 4 (g) + 2SiHCl 3 (g) Δ H =- 30 kJ·mol - 1 则反应 4SiHCl 3 (g)===SiH 4 (g) + 3SiCl 4 (g) 的 Δ H 为 ________kJ·mol - 1 。 (3) 对于反应 2SiHCl 3 (g)===SiH 2 Cl 2 (g) + SiCl 4 (g) ,采用大孔弱碱性阴离子交换树脂催化剂,在 323 K 和 343 K 时 SiHCl 3 的转化率随时间变化的结果如图所示。 化学 答案 (1)2SiHCl 3 + 3H 2 O===(HSiO) 2 O + 6HCl (2)114 (3) ① 22 0.02 ② 及时移去产物 改良催化剂;提高反应物压强 ( 浓度 ) ③ 大于 1.3 4 . (2017· 课标全国 Ⅰ , 28) 近期发现, H 2 S 是继 NO 、 CO 之后第三个生命体系气体信号分子,它具有参与调解神经信号传递、舒张血管减轻高血压的功能。回答下列问题: (1) 下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是 ________( 填标号 ) 。 A .氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B .氢硫酸的导电能力低于相同浓度的亚硫酸 C . 0.10 mol·L - 1 的氢硫酸和亚硫酸的 pH 分别为 4.5 和 2.1 D .氢硫酸的还原性强于亚硫酸 (2) 下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。 通过计算,可知系统 ( Ⅰ ) 和系统 ( Ⅱ ) 制氢的热化学方程式分别为 _____________________________________________________________ 、 _________________________________________________________ , 制得等量 H 2 所需能量较少的是 ________ 。 命题调研 (2014 ~ 2018 五年大数据 ) 命题角度 设空方向 频数 难度 1. 化学反应与能量变化 反应热与热化学方程式的书写 12 0.42 化学反应与键能 3 0.40 电化学 ( 以书写电极反应式为主 ) 1 0.38 2. 化学反应速率 化学反应速率的计算 4 0.44 化学反应速率的影响因素 8 0.46 化学反应速率变化图像分析 10 0.42 3. 化学平衡 平衡状态判断及化学平衡图像分析 12 0.41 化学平衡影响因素分析 8 0.48 反应物转化率的计算 7 0.46 化学平衡常数表达式及其计算 13 0.40 4. 电解质溶液 电离平衡、水解平衡、溶解平衡的理解 1 0.45 K a ( K b ) 及 K sp 的理解与计算 2 0.39 化学反应原理综合题,是高考的固定题型,通常以速率、平衡知识为中心,还常涉及到化学反应与能量变化及电解质溶液等内容。对于化学反应与能量变化的考查,一方面涉及到氧化还原反应分析及电化学电极书写,但最为常见的题型还是盖斯定律的应用,根据已知热化学方程式书写待求热化学方程式或直接计算其反应热,难度不大,是高考热点;对于化学反应速率与化学平衡的考查主要有以下方面:化学反应速率的定量计算、外界条件对速率、平衡的影响、新情境下平衡状态的判定、平衡常数的表达式及平衡常数与转化率的计算、以及其速率平衡图像、数据表格分析等。预计在 2019 年的高考中,化学反应原理的综合仍会以创新考查为主,特别是在情境、取材上创新,在图像上创新,同时联系生产生活实际考查学生选择温度、压强、酸碱性环境等适宜的反应条件,体现学生知识运用能力,另外化学平衡常数的多种表达形式,通过图像信息获取解题数据,完成平衡常数与转化率的计算,也是高考考查的重点内容之一,应给予关注! 1 .计算反应热 解题模板 [ 示例 1] 甲醇既是重要的化工原料,又可作为燃料,利用合成气 ( 主要成分为 CO 、 CO 2 和 H 2 ) 在催化剂作用下合成甲醇。发生的主要反应如下: 化学键 H—H C—O C ≡ O H—O C—H E /(kJ·mol - 1 ) 436 343 1 076 465 413 由此计算 Δ H 1 = ________ kJ·mol - 1 ; 已知 Δ H 2 =- 58 kJ·mol - 1 ,则 Δ H 3 = ________ kJ·mol - 1 。 [ 模型应用 ] 答案 - 99 + 41 [ 示例 2] 工业生产中可用苯乙烷生产苯乙烯 答案 + 158.8 kJ·mol - 1 ( 将已知的两个热化学方程式依次编号为 ① 、 ② ,根据盖斯定律,由 ① + ② 可得 ) 2 . 利用盖斯定律书写热化学方程式 [ 解题模板 ] [ 示例 3] [2017· 江苏化学, 26(1)] TiO 2 与 Cl 2 难以直接反应,加碳生成 CO 和 CO 2 可使反应得以进行。 已知: TiO 2 (s) + 2Cl 2 (g)=== TiCl 4 (g) + O 2 (g) Δ H 1 =+ 175.4 kJ·mol - 1 2C(s) + O 2 (g)===2CO(g) Δ H 2 =- 220.9 kJ·mol - 1 沸腾炉中加碳氯化生成 TiCl 4 (g) 和 CO(g) 的热化学方程式: __________________ ___________________________________________________________ 。 答案 TiO 2 (s) + 2Cl 2 (g) + 2C(s)===TiCl 4 (g) + 2CO(g) Δ H =- 45.5 kJ/mol 说明:对于平衡状态的判断,不断出现新的判断形式,如绝热过程中的热量变化,化学平衡常数,有关图像等,判断时紧紧抓住反应过程中对应物理量是否变化,如果在反应过程中在变,达到平衡时不变,则能说明。 [ 示例 4] 汽车尾气净化的主要原理为 2NO(g) + 2CO(g)2CO 2 (g) + N 2 (g) Δ H < 0 。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到 t 1 时刻达到平衡状态的是 ________( 填编号 ) 。 答案 ②④⑤ 2 . (2018· 课标全国 Ⅲ , 7) 化学与生活密切相关。下列说法错误的是 ( ) 判断: 2 c 1 ________ c 3 2 p 2 ________ p 3 α 1 + α 3 ________1( 填 “>” “ < ” “ = ” ) 答案 < > < 1 . 根据图像选择合适条件 [ 图像分析 ] 控制变量,作垂直于横轴的一条直线交三条曲线于三点,转化率越高越好,所以选择 A 。选择最佳氨碳比,可看最上面曲线的走势,整体增加,曲线先陡后平 ( 略上升 ) ,依然选择拐点,当氨碳比大于 4.0 时,增大氨气的量 CO 2 转化率增加不大,但生产成本提高了;氨碳比太小, CO 2 转化率低。 答案 A 氨碳比等于 4 , CO 2 转化率较高 当氨碳比大于 4.0 时,增大 NH 3 的量 CO 2 的转化率增加不大,但生产成本提高了;氨碳比小于 4.0 时, CO 2 的转化率低。 2. 根据图像解释产生某种现象的原因 [ 示例 7] 以二氧化钛表面覆盖 Cu 2 Al 2 O 4 为催化剂,可以将 CO 2 和 CH 4 直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。 250 ~ 300 ℃ 时,温度升高而乙酸的生成速率降低的原因是: ___________ ________________________________________________ 。 [ 图像分析 ] 两根曲线注意看清每个曲线对应的条件,分析两个量之间内在的联系。这里涉及影响反应速率的两个因素:催化剂和温度,弄清影响因素即可。所以, 250 ~ 300 ℃ 时,温度升高而乙酸的生成速率降低的原因是温度超过 250 ℃ 时,催化剂的催化效率降低。 答案 温度超过 250 ℃ 时,催化剂的催化效率降低 3 . 根据图像推断 Δ H 变化 [ 示例 8] 为了减少空气中的 CO 2 ,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用 (NH 4 ) 2 CO 3 ,反应为 (NH 4 ) 2 CO 3 (aq) + H 2 O(l) + CO 2 (g)===2NH 4 HCO 3 (aq) Δ H 。为研究温度对 (NH 4 ) 2 CO 3 捕获 CO 2 效率的影响,在某温度 T 1 下,将一定量的 (NH 4 ) 2 CO 3 溶液置于密闭容器中,并充入一定量的 CO 2 气体 ( 用氮气作为稀释剂 ) ,在 t 时刻,测得容器中 CO 2 气体的浓度。然后分别在温度为 T 2 、 T 3 、 T 4 、 T 5 下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得 CO 2 气体浓度,其关系如图,则 Δ H ________( 填 “>” 、 “ = ” 或 “<”)0 。 [ 图像分析 ] 根据可逆反应的特征,准确确定平衡点。温度越高反应速率越快,达到平衡所需的时间越短,在相等时间内, CO 2 浓度最低的点应该是平衡点。 T 3 往后,温度升高, CO 2 浓度增大,平衡逆向移动,逆反应吸热,正反应放热。 答案 < 1 . 化学平衡常数表达式 2 . 悟透化学平衡常数及转化率计算题解题模式 [ 示例 9] 顺 1 , 2 二甲基环丙烷和反 1 , 2 二甲基环丙烷可发生如下转化: 该反应的速率方程可表示为: v ( 正 ) = k ( 正 ) c ( 顺 ) 和 v ( 逆 ) = k ( 逆 ) c ( 反 ) , k ( 正 ) 和 k ( 逆 ) 在一定温度时为常数,分别称作正、逆反应速率常数。回答下列问题: (1) 已知: t 1 温度下, k ( 正 ) = 0.006 s - 1 , k ( 逆 ) = 0.002 s - 1 ,该温度下反应的平衡常数值 K 1 = ________ ;该反应的活化能 E a ( 正 ) 小于 E a ( 逆 ) ,则 Δ H ________0( 填 “ 小于 ”“ 等于 ” 或 “ 大于 ” ) 。 答案 3 小于 1 . 题型特点 此类试题以元素及化合物、化学平衡知识为主题,借助图像、图表的手段考查相关联的知识。主要考查点: (1) 反应现象的描述。 (2) 氧化还原反应、原电池与电解池、陌生离子方程式的书写。 (3) 化学键与反应的热效应计算、信息条件下速率计算、平衡常数的计算、 K sp 的计算。 (4) 平衡的影响因素、平衡移动与图像及相关原因的分析。 2 .解题思路:四步突破物质性质与化学平衡综合题 [ 典例演示 1] (2017· 课标全国 Ⅱ , 27) 丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题: (2) 丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器 ( 氢气的作用是活化催化剂 ) ,出口气中含有丁烯、丁烷、氢气等。图 (b) 为丁烯产率与进料气中 n ( 氢气 )/ n ( 丁烷 ) 的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是 ______________________________________________________________ 。 (3) 图 (c) 为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在 590 ℃ 之前随温度升高而增大的原因可能是 ______________________________________________________________ 、 ______________________________________________________________ ; 590 ℃ 之后,丁烯产率快速降低的主要原因可能是 ___________________________ ________________________________________ 。 解析 (1) 根据盖斯定律,用 ② 式- ③ 式可得 ① 式,因此 Δ H 1 = Δ H 2 - Δ H 3 = - 119 kJ/mol + 242 kJ/mol =+ 123 kJ/mol 。由 a 图可以看出,温度相同时,由 0.1 MPa 变化到 x MPa ,丁烷的转化率增大,即平衡正向移动,所以 x 的压强更小, x <0.1 。由于反应 ① 为吸热反应,所以温度升高时,平衡正向移动,丁烯的平衡产率增大,因此 A 正确、 B 错误。反应 ① 正向进行时体积增大,加压时平衡逆向移动,丁烯的平衡产率减小,因此 C 错误, D 正确。 (2) 反应初期, H 2 可以活化催化剂,进料气中 n ( 氢气 )/ n ( 丁烷 ) 较小,丁烷浓度大,反应向正反应方向进行的程度大,丁烯转化率升高;然后进料气中 n ( 氢气 )/ n ( 丁烷 ) 增大,原料中过量的 H 2 会使反应 ① 平衡逆向移动,所以丁烯转化率下降。 (3)590 ℃ 之前,温度升高时反应速率加快,生成的丁烯会更多,同时由于反应 ① 是吸热反应,升高温度平衡正向移动,平衡体系中会含有更多的丁烯。而温度超过 590 ℃ 时,由于丁烷高温会裂解生成短链烃类,所以参加反应 ① 的丁烷也就相应减少。 答案 (1) + 123 小于 AD (2) 原料中过量 H 2 会使反应 ① 平衡逆向移动,所以丁烯转化率下降 (3)590 ℃ 前升高温度,反应 ① 平衡正向移动 升高温度时,反应速率加快,单位时间产生丁烯更多 高于 590 ℃ 时则有更多的 C 4 H 10 裂解导致产率降低 [ 题型训练 1] (2018· 天津理综, 10) CO 2 是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题: ① 已知上述反应中相关的化学键键能数据如下: 则该反应的 Δ H = ________ 。分别在 V L 恒温密闭容器 A( 恒容 ) 、 B( 恒压,容积可变 ) 中,加入 CH 4 和 CO 2 各 1 mol 的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是 ________( 填 “A” 或 “B”) 。 ② 按一定体积比加入 CH 4 和 CO 2 ,在恒压下发生反应,温度对 CO 和 H 2 产率的影响如图 1 所示。此反应优选温度为 900 ℃ 的原因是 _________________________ 。 化学键 C—H C===O H—H C O(CO) 键能 /kJ·mol - 1 413 745 436 1 075 (1) 硝酸厂向大气中排放 NO 2 造成的环境问题是 ____________________________ _________________________________________________ 。 (2) 为了减少 SO 2 的排放,将含 SO 2 的烟气通过洗涤剂 X ,充分吸收后再向吸收后的溶液中加入稀硫酸,既可以回收 SO 2 ,同时又可得到化肥。上述洗涤剂 X 可以是 ________( 填序号 ) 。 a . Ca(OH) 2 b . K 2 CO 3 c . Na 2 SO 3 d . NH 3 ·H 2 O (5) 在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验 ( 各次实验的温度可能相同,也可能不同 ) ,测定 NO 2 的平衡转化率。部分实验结果如图所示: ① 如果要将图中 C 点的平衡状态改变为 B 点的平衡状态,应采取的措施是 _________________________________________________________________ ____________________________________________________________ ; ② 若 A 点对应实验中, SO 2 (g) 的起始浓度为 c 0 mol·L - 1 ,经过 t min 达到平衡状态,该时段化学反应速率 v (NO 2 ) = ________ mol·L - 1 ·min - 1 ; ③ 图中 C 、 D 两点对应的实验温度分别为 T C 和 T D ,通过计算判断 T C ________ T D ( 填 “>” “ = ” 或 “<”) 。 [ 典例演示 2] 氮及其化合物对生产、生活有重要的意义。 (1) 合成氨的原理如图 1 所示,该反应的热化学方程式为 ___________________ ______________________________________________________________ 。 实验测得的不同温度下的平衡数据如表所示: 温度 / ℃ 15.0 20.0 25.0 30.0 35.0 平衡状态下气体总浓度 /(10 - 3 mol·L - 1 ) 2.4 3.4 4.8 6.8 9.4 [ 题型训练 3] 氢能是理想的清洁能源,资源丰富。以太阳能为热源分解 Fe 3 O 4 ,经由热化学铁氧化合物循环分解水制 H 2 的过程如图 1 : ③ 在压强 p 1 下, Fe 3 O 4 的平衡转化率随温度变化的曲线如图 2 所示。若将压强由 p 1 增大到 p 2 ,在图 2 中画出 p 2 下的 α(Fe 3 O 4 )— T 曲线示意图。 (2) 已知 H 2 的燃烧热是 285.8 kJ·mol - 1 ,则液态水通过过程 Ⅱ 转化的热化学方程式为 _____________________________________________________ 。 (3) 其他条件不变时,过程 Ⅱ 在不同温度下, H 2 O 的转化率随时间的变化 [α(H 2 O)— t ] 曲线如图 3 所示,温度 T 1 、 T 2 、 T 3 由大到小的关系是 ________________ , 判断依据是 __________________________________________________ ________________________________________________________ 。 (4) 科研人员研制出透氧膜 (OTM) ,它允许电子和 O 2 - 同时透过,可实现水连续分解制 H 2 ,工作时 CO 、 H 2 O 分别在透氧膜的两侧反应。工作原理如图所示: CO 在 ________( 填 “a” 或 “b”) 侧反应,另一侧的电极反应式为 ___________________ _______________________________________________________ 。 答案 (1) ① 提高 Fe 3 O 4 的转化率 ② a ③ 如图所示 (2)3FeO(s) + H 2 O(l)===H 2 (g) + Fe 3 O 4 (s) Δ H =+ 129.2 kJ·mol - 1 (3) T 1 > T 2 > T 3 其他条件相同时,因为该反应是吸热反应,升高温度平衡右移,所以 T 1 > T 2 > T 3 (4)b H 2 O + 2e - ===H 2 ↑ + O 2 -查看更多