甘肃省武威市第十八中学2019-2020学年高二上学期期末考试化学试题
高二化学试题
命题人:
一、选择题(每题3分,共48分)
1.下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生
C.吸热反应只能在加热的条件下才能进行
D.反应物和生成物所具有的总能量决定了放热还是吸热
2.在密闭容器中进行的反应:N2+O22NO,不能加快该反应的反应速率的是( )
A.缩小体积 B.充入少量NO气体
C.体积增大到原来的2倍 D.升高温度
3.下列物质溶于水后,抑制了水的电离的是( )
A.NaCl B.NH4Cl C.CH3COONa D.H2SO4
4.下列热化学方程式书写和表示正确的是(ΔH的绝对值均正确)( )
A.2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ·mol-1(反应热)
B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1(燃烧热)
C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热)
D.2NO2===O2+2NO ΔH=-116.2 kJ·mol-1(反应热)
5.反应4A(s)+3B(g)2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.8 mol·L-1·s-1
B.分别用B、C、D表示的反应速率,其比值是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是相同的
6.已知几种化学键的键能和热化学方程式如下:
化学键
H—N
N—N
Cl—Cl
N≡N
H—Cl
键能/(kJ·mol-1)
391
193
243
946
432
N2H4(g)+2Cl2(g)===N2(g)+4HCl(g) ΔH。下列推断正确的是( )
A.H(g)+Cl(g)===HCl(g) ΔH=+432 kJ·mol-1
B.断裂1 mol Cl—Cl键吸收能量比断裂1 mol N≡N键多703 kJ
C.上述反应中,ΔH=-431 kJ·mol-1
D.上述反应中,断裂极性键和非极性键,只形成极性键
7.下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3
C.工业制取金属钾Na(l)+KCl(l)NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
D.加入催化剂有利于氨的合成
8.下列说法正确的是( )
A.所有能自发进行的化学反应都是放热反应
B.同一物质固、液、气三种状态的熵值相同
C.ΔH<0、ΔS>0的反应可自发进行
D.在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向
9.在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/(mol·L-1)
0.1
0.2
0
平衡浓度/(mol·L-1)
0.05
0.05
0.1
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y2Z,其平衡常数为1600
C.反应达平衡时,X的转化率为50%
D.改变温度可以改变此反应的平衡常数
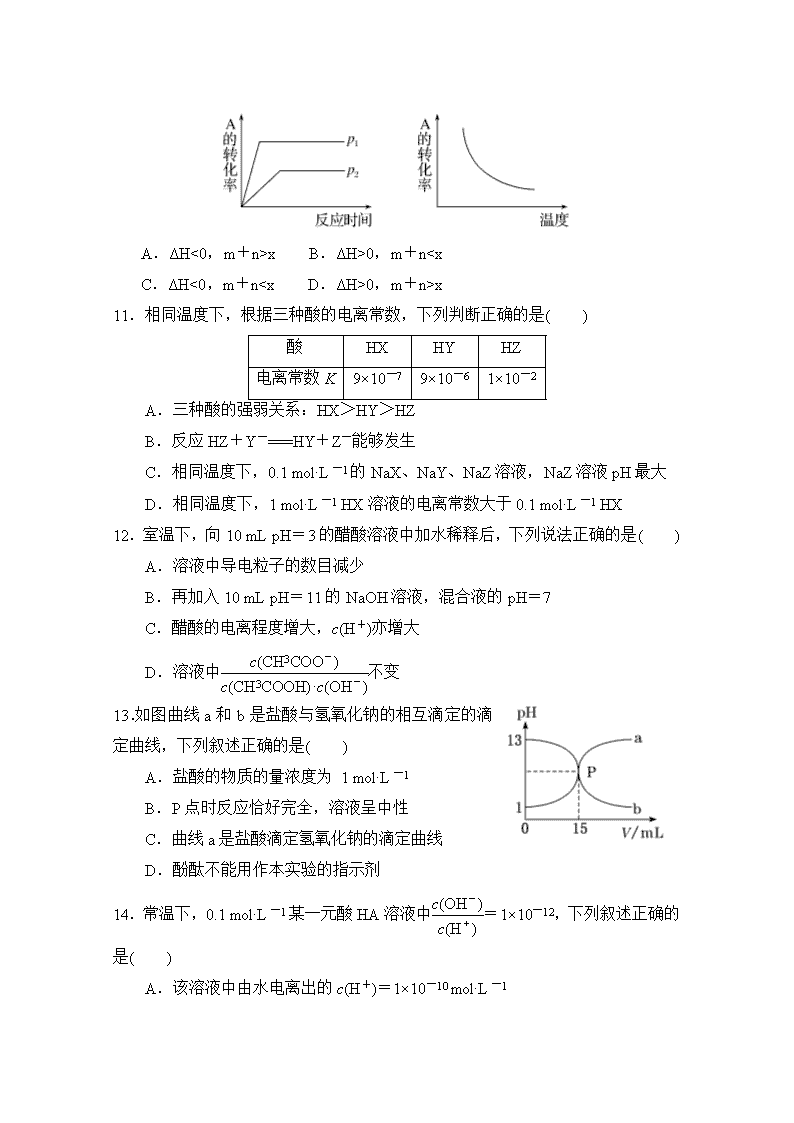
10.对于可逆反应:mA(g)+nB(g) xC(g) ΔH=?,在不同温度及压强(P1、P2)条件下,反应物A的转化率如图所示,下列判断正确的是( )
A.ΔH<0,m+n>x B.ΔH>0,m+n
0,m+n>x
11.相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸
HX
HY
HZ
电离常数K
9×10-7
9×10-6
1×10-2
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-===HY+Z-能够发生
C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX
12.室温下,向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.再加入10 mL pH=11的NaOH溶液,混合液的pH=7
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中不变
13.如图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为 1 mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
14.常温下,0.1 mol·L-1某一元酸HA溶液中=1×10-12,下列叙述正确的是( )
A.该溶液中由水电离出的c(H+)=1×10-10 mol·L-1
B.溶液中存在HAH++A-
C.与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性
D.原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
15.已知:
C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+2ΔH5
16.常温下,0.1 mol·L-1 CH3COONa溶液中粒子浓度的关系错误的是( )
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(CH3COOH)=c(OH-)
C.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D.c(Na+)=c(CH3COO-)+c(CH3COOH)
二、填空题(共52分)
17.(12分)能源危机当前是一个全球性问题,“开源节流”是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是______(填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
①在通常状况下,金刚石和石墨相比较,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为________。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为________kJ。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ·mol-1。
NO分子中化学键的键能为________kJ·mol-1。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:
。
18. (14分)现有反应:mA(g) + nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为 热反应,且m+n p(填>、=、<)。
(2) 若加入B(体积不变),则A的转化率_________,B的转化率_________。(填增大、减小或不变)
(3)若升高温度,则平衡时B、C的浓度之比将_________。(填增大、减小或不变)
(4) 若加入催化剂,平衡时气体混合物的总物质的量_________。(填增大、减小或不变)
(5) 若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填变深、变浅或不变)。
19.(14分)现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液。试回答下列问题:
(1)甲溶液的pH=________。
(2)乙溶液中由水电离出的H+浓度为 mol·L-1。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③ ④c(OH-)
(4)某同学用甲溶液做标准溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
①甲溶液滴定丙溶液的曲线是 (填“图1”或“图2”)曲线。
②用甲溶液滴定乙溶液实验中,指示剂应选用 ,滴定达到终点的现象为: ,滴定前未用标准液润洗滴定管,则会造成滴定结果 (填偏高、偏低或无影响)。
20.已知常温下部分弱电解质的电离常数如下表:
化学式
HF
HClO
H2CO3
NH3·H2O
电离常数
Ka=6.8×10-4
Ka=4.7×10-8
Ka1=4.2×10-7
Ka2=5.6×10-11
Kb=1.7×10-5
(1)常温下,物质的量浓度相同的四种溶液:①HF溶液;②HClO溶液;③NaHCO3溶液;④NH3·H2O溶液,其pH由大到小的顺序是____________(填字母)。
(2)25 ℃时,pH=4的NH4Cl溶液与pH=4的HF溶液中由水电离出的c(H+)之比为________。
(3)0.1 mol·L-1NaClO溶液和0.1 mol·L-1NaHCO3溶液中,c(ClO-) ______ c(HCO)(填>、<或=);可使上述两种溶液pH相等的方法是________(填字母)。
A.向NaClO溶液中加适量水
B.向NaClO溶液中加入适量NaOH固体
C.向NaHCO3溶液中加适量水
D.向NaHCO3溶液中加适量NaOH固体
(4)向NaClO溶液中通入少量CO2,所发生反应的离子方程式为:______________________________________________________________。
(5)常温下,计算NH4Cl溶液中,NH的水解常数Kh=_________________。
高二化学答案
一、选择题(每题3分,共48分)
1
2
3
4
5
6
7
8
D
C
D
A
B
C
D
C
9
10
11
12
13
14
15
16
A
A
B
D
B
C
C
B
二、填空题(共52分)
17.(12分,每空2分)
(1)acd (2)①石墨 -393.5 kJ·mol-1 ②252.0 (3)631.5
(4)2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.0 kJ·mol-1
18、(14分,每空2分)
(1)放(1分) >(1分) (2)增大 减小
(3)减小 (4)不变 (5)变深 变浅
19(14分,每空2分)
(1)13 (2)1×10-13 (3)①④ (4)① 图2
②酚酞试液 溶液由无色变为淡红色,且半分钟内不褪色 偏高
20.(12分,每空2分)
(1) ④>③>②>① (2)106∶1 (3) < AD
(4)ClO-+CO2+H2O===HClO+HCO
(5) Kh===5.9×10-10(填结果)