江苏省泰州市2019-2020学年高一下学期期末考试化学试题 Word版含答案
2019~ 2020学年度第二学期期末考试
高一化学试题
(考试时间: 90分钟; 总分: 100分)
命题人: . 审题人:
注意事项:
1.本试卷共分两部分,第I卷为选择题,第1I卷 为非选择题。
2.所有试题的答案均填写在答题纸上,答案写在试卷上的无效。
可能用到的相对原子质量: H-1 C-12 0-16 Al-27 Br-80 Cu-64
第I卷(选择题共40分)
单项选择题(本题包括10小题,每题2分,共20分。每小题只有一个选项符合题意)
1.下列物质的主要成分属于有机高分子化合物的是
2.反应2CH3CH2OH+O22CH3CHO +2H2O,下列化学用语表示正确的是
A.中子数为10的氧原子: B. CH3CH2OH 的球棍模型:
C. H2O的电子式: D. CH3CHO中官能团的结构式:一COH
3.2A1+MoO3Mo+Al2O3用于制备金属钼(Mo)。下列说法正确的是
A. Al得电子 B. Al2O3 是氧化剂
C. MoO3 发生还原反应 D.每生成1molMo有3mol电子转移
4.常温下,下列各组离子在指定溶液中能大量共存的是
A.含有大量AI3+的溶液: Na+、 SO42-、 CI-、NO3-
B.使酚酞变红色的溶液: Na+、 Ca2+、 CO32-、K+
C.0.1mol·L-1FeCl3溶液: K+、 Na+、Br-、SCN-
D.0.1mol·L-1NaHCO3溶液: Na+、 H+、NO3-、SO42-
5.下列有关物质性质与用途具有对应关系的是
A.硅是半导体材料,可用作光导纤维 B.乙烯具有还原性,可用作水果的催熟剂
C.浓硫酸具有强氧化性,可用作酯化反应的催化剂
D.锌具有还原性和导电性,可用作锌锰干电池的负极材料
6.下列反应属于 加成反应的是
A. C3H8 +5023CO2 +4H2O B. CH2=CH2+HBrCH3CH2Br
C. CH3COOH+NaOH CH3COONa+ H2O D.
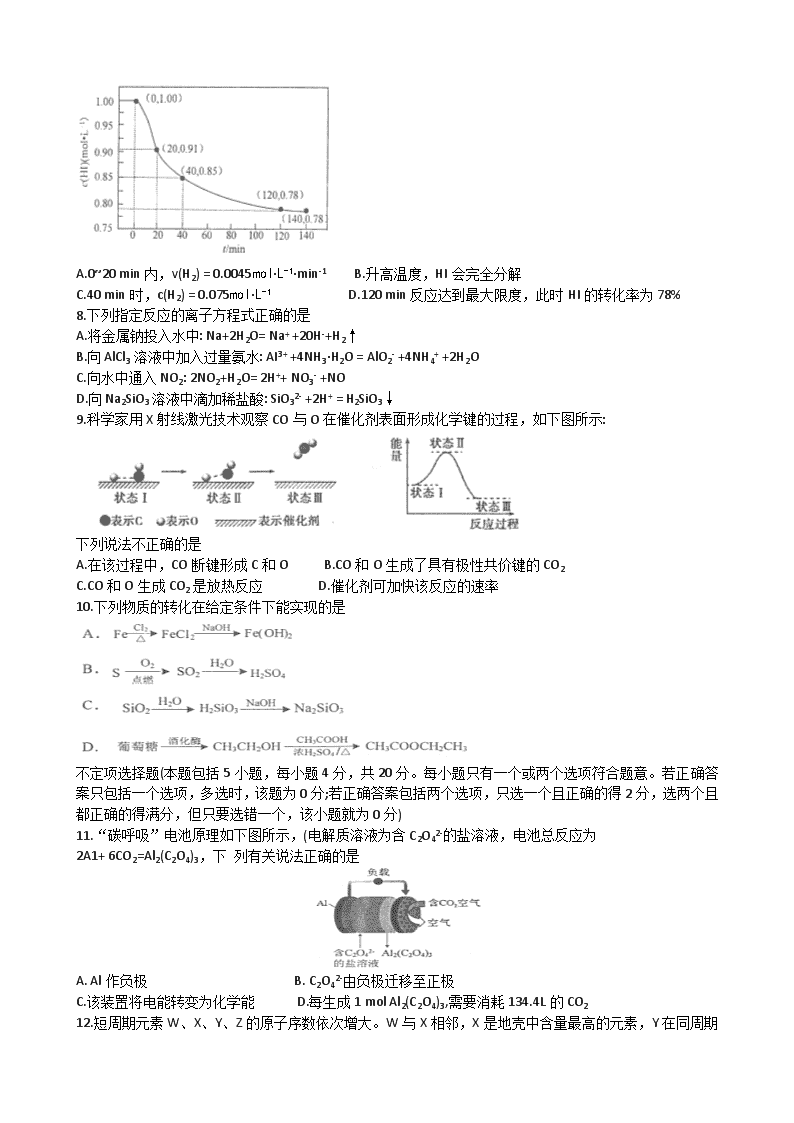
7.已知2Hl(g)H2(g) +l2(g), 443℃时IL密闭容器中充入1 mol HI, 体系中c(HI)与反应时间t的关系如下图所示。下列说法正确的是
A.0~20 min内,v(H2) = 0.0045mol·L-1·min-1 B.升高温度,HI会完全分解
C.40 min时,c(H2) = 0.075mol·L-1 D.120 min反应达到最大限度,此时HI的转化率为78%
8.下列指定反应的离子方程式正确的是
A.将金属钠投入水中: Na+2H2O= Na+ +20H-+H2↑
B.向AlCl3溶液中加入过量氨水: AI3+ +4NH3·H2O = AlO2- +4NH4+ +2H2O
C.向水中通入NO2: 2NO2+H2O= 2H++ NO3- +NO
D.向Na2SiO3溶液中滴加稀盐酸: SiO32- +2H+ = H2SiO3↓
9.科学家用X射线激光技术观察CO与O在催化剂表面形成化学键的过程,如下图所示:
下列说法不正确的是
A.在该过程中,CO断键形成C和O B.CO和O生成了具有极性共价键的CO2
C.CO和O生成CO2是放热反应 D.催化剂可加快该反应的速率
10.下列物质的转化在给定条件下能实现的是
不定项选择题(本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
11.“碳呼吸”电池原理如下图所示,(电解质溶液为含C2O42-的盐溶液,电池总反应为
2A1+ 6CO2=Al2(C2O4)3,下 列有关说法正确的是
A. Al作负极 B. C2O42-由负极迁移至正极
C.该装置将电能转变为化学能 D.每生成1 mol Al2(C2O4)3,需要消耗134.4L的CO2
12.短周期元素W、X、Y、Z的原子序数依次增大。W与X相邻,X是地壳中含量最高的元素,Y在同周期元素中原子半径最大,Z与Y形成化合物YZ。下列说法正确的是
A.原子半径: r(W)
100nm c.1nm~100nm
(2)丙烯在催化剂条件下制备聚丙烯,化学反应方程式为
(3) 75%酒精的有效成分是乙醇,乙醇的一种同分异构体的结构简式为 。
(4)食饮具可通过煮沸消毒,病毒蛋白质在加热条件下发生了 。
(5)环氧乙烷是一种低温灭菌剂, 经典的生产方法是氯代乙醇法,包括两步反应:
i. CH2=CH2+Cl2+H2O →CICH2CH2OH+HCl
ii. CICH2CH2OH+ HCI+Ca(OH)2 → + CaCl2 +2H2O
现代石油化工采用低温催化法: 2CH2=CH2+O2
与氯代乙醇法相比,低温催化法的优点有 、 . ( 答两点)
17. (12分)下表为元素周期表的一部分, 回答下列问题。
(1)我国科学家采用“铝铍测年法”测量“北京人”年龄。10Be 和9Be
a.是同一种核素 b.具有相同的中子数 c.互为同素异形体 d.互为同位素
(2)元素①和②可形成多种化合物。下列模型表示的分子中,不可能由①和②形成的是 (填序号)。
(3)元素①~⑥中,金属性最强的是 (填元素符号)。②的单质和⑤的最高价氧化物对应水化物的浓溶液反应的化学方程式为 。
(4)碘(53I) 是人体必需的微量元素之一。
①碘(53I) 在周期表中的位置是
②CI-、Br-、I-的还原性由大到小的顺序为 。
③资料显示: Ag+和I-会发生氧化还原反应生成两种单质,反应的离子方程式为 。某同学用图实验验证上述反应,观察到两溶液混合后立即出现黄色浑浊,再加入淀粉溶液,不变蓝。分析产生上述现象的可能原因:
18. (12分)可燃冰主要含有甲烷水合物(CH4·nH2O),还含少量CO2等物质。
(1)可燃冰中,CH4分子的空间构型为 ,CO2的电子式为
(2)工业利用甲烷制氢气,化学方程式为CH4(g) + H2O(g) CO(g) + 3H2(g)
①下列措施能加快反应速率的是
a.降低温度 b.增加CH4浓度 c.使用催化剂
②若上述反应在恒容的密闭容器中进行,下列叙述中能说明该反应已达平衡状态的是
a. c(H2) = 3c(H2O) b.混合气体的质量不再变化
c.单位时间内生成1 mol CO,同时消耗3 mol H2
(3)某种甲烷燃料电池工作原理如下图所示:
①电子移动方向为 , (填“a→b"或“b→a")
②b电极的电极反应式为 。
(4)甲烷可催化还原NO,反应历程如下图所示:
①该历程中,反应i为CH4+ 12Fe2O3=8Fe3O4+CO2+2H2O,
则反应ii的化学方程式为
②工业上催化还原2molNO,理论上需要 LCH4 (标准状况下)。
19. (14分)碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以纯铜屑为原料制取的流程如下:
(1)“溶解”步骤反应的离子方程式为 . 温度宜控制在50℃左右,若高于50℃,
溶液中O2溶解量减少、Cu的转化率降低,若低于50℃ ,
(2)“反应”步骤生成Cu2(OH)2CO3的化学方程式为 。反应后溶液中铜元素残留量受pH和反应时间的影响如下图所示:
判断反应的最佳条件: pH为 、反应时间为 h。
(3)检验Cu2(OH)2CO3洗涤是否完全的方法是
(4) Cu2(OH)2CO3也可以表示为CuCO3·Cu(OH)2。 查阅文献,上述反应条件下还可能生成少量CuCO3·Cu(OH)2。为测定产品的纯度[产品中Cu2(OH)2CO3的质量分数],取10.97g干燥样品,400℃左右加热,测得固体质量随时间变化关系如下图所示。
已知: 8.00g固体为黑色纯净物。
有关物质的摩尔质量如下表:
请计算产品的纯度(写出计算过程,结果保留3位有效数字)。
20. (12分)某化学小组欲探究NO3-的氧化性及其还原产物。
(1)提出问题
甲同学认为只有溶液中同时存在H+时,NO3-才有氧化性;
乙同学不赞成甲同学观点,他认为NO3-自身就具有氧化性,依据是
(2)实验探究:小组同学为解决上述争论,设计并进行了以下实验
①实验I中反应的离子方程式为 。
②实验II滴加两滴蒸馏水的目的是 ,
产生的无色气泡为
③实验III反应后静置,取上层清液,滴加稀盐酸,先产生白色浑浊,后又消失。
则实验III中反应的离子方程式为 。
(3) 实验结论:由实验I、II、III可得出的结论是 。
2019~2020学年度第二学期调研测试
高一化学参考答案与评分细则
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
1. B 2. B 3. C 4. A 5. D 6.B 7.C 8.D 9.A 10. D
不定项选择题:
11. A 12. BD 13. B 14. BD 15. C
16. (10分,每空2分)
(1) c (2) nCH3CH=CH2 (物质错误0分,不配平和漏写条件扣I分)
(3) CH3OCH3 (写结构式暂不扣分,分子式不得分) (4)变性
(5)原子利用率100% (或原子经济性高);不产生CaCl2等工业废渣;对设备腐蚀性小:低温催化能耗低。(任两点,每点1分,其他合理答案也可)
17. (12分)
(1) d(1分) (2) b(1分)
(3) Na(1分)
C+2H2SO4(浓) CO2↑+ 2SO2↑+2H2O (2分,物质有错误0分,配平错误、“浓”或“△”不写扣1分,气体符号不写暂不扣分。)
(4)①第五周期VIIA (或第5周期VIIA)(1分)
②I->Br->CI- (2分, 没有“>”不扣分,写成CI-
查看更多