- 2021-08-23 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习考前回顾八注重规范十类答题模板学案(全国通用)
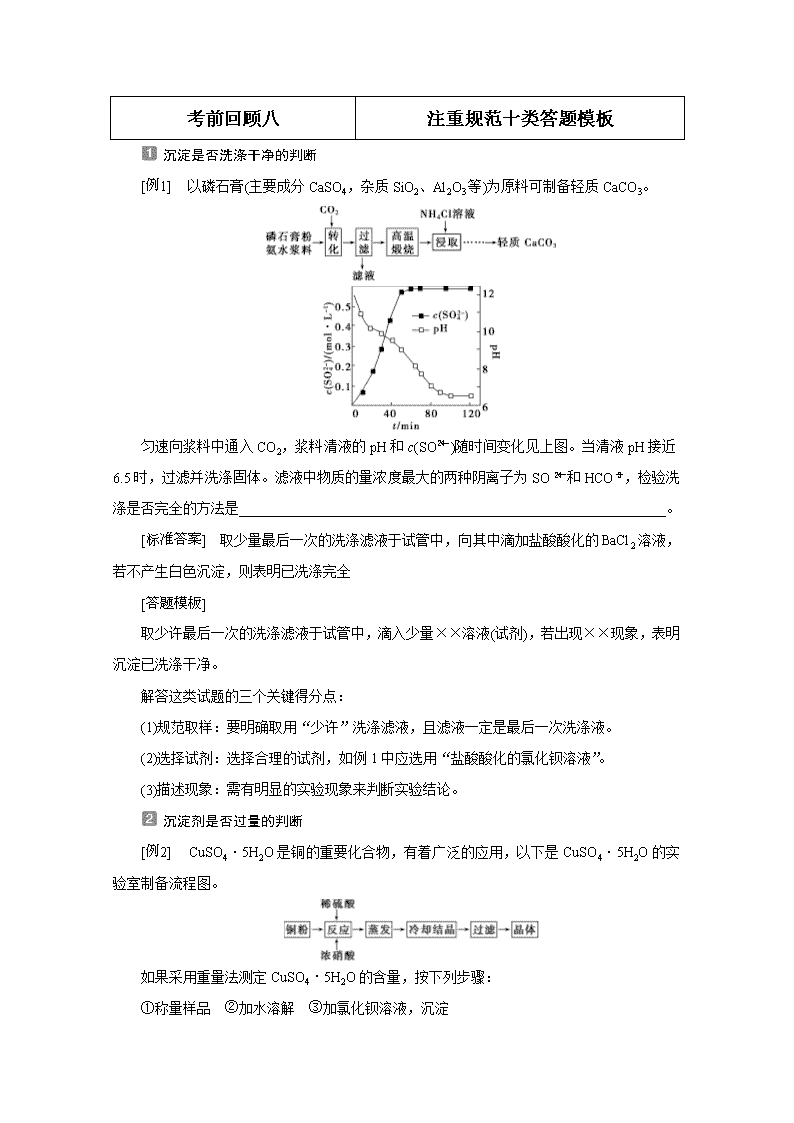
考前回顾八 注重规范十类答题模板 沉淀是否洗涤干净的判断 以磷石膏(主要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。 匀速向浆料中通入CO2,浆料清液的pH和c(SO)随时间变化见上图。当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为SO和HCO,检验洗涤是否完全的方法是_____________________________________________________________。 取少量最后一次的洗涤滤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全 取少许最后一次的洗涤滤液于试管中,滴入少量××溶液(试剂),若出现××现象,表明沉淀已洗涤干净。 解答这类试题的三个关键得分点: (1)规范取样:要明确取用“少许”洗涤滤液,且滤液一定是最后一次洗涤液。 (2)选择试剂:选择合理的试剂,如例1中应选用“盐酸酸化的氯化钡溶液”。 (3)描述现象:需有明显的实验现象来判断实验结论。 沉淀剂是否过量的判断 CuSO4·5H2O是铜的重要化合物,有着广泛的应用,以下是CuSO4·5H2O的实验室制备流程图。 如果采用重量法测定CuSO4·5H2O的含量,按下列步骤: ①称量样品 ②加水溶解 ③加氯化钡溶液,沉淀 ④过滤(其余步骤省略) 在过滤前,需要检验是否沉淀完全,其操作是___________________________________。 静置,在上层清液中继续滴加BaCl2溶液,观察有无沉淀生成 以“BaCl2溶液沉淀Na2SO4溶液”为例 方法Ⅰ 适用于沉淀的质量需要称量并进行有关的定量计算 方法Ⅱ 适用于不需要称量沉淀的质量,只是定性说明相关的问题 离子检验的实验操作 (NH4)2SO4是常用的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。 [查阅资料] (NH4)2SO4在260 ℃和400 ℃时分解产物不同。 [实验探究] 该小组拟选用下图所示装置进行实验(夹持和加热装置略)。 实验:连接装置A—D—B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400 ℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO,无SO。进一步研究发现,气体产物中无氮氧化物。 检验装置D内溶液中有SO,无SO的实验操作和现象是________________________。 取少量装置D内溶液于试管中,滴加BaCl2溶液,生成白色沉淀,加入足量盐酸后,沉淀完全溶解,放出无色有刺激性气味的气体 以“Cl-检验”为例 气体检验的操作步骤 用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。 经小组讨论并验证该无色气体为O2,其验证方法是____________________________ ________________________________________________________________________。 用带火星的木条靠近瓶口,如果木条复燃,则证明该气体是氧气,否则不是氧气 (1)以“用澄清石灰水检验CO2气体”为例 (2)气体检验时需注意的问题 ①根据需要检验的气体成分确定检验气体的特征试剂。检验气体时一般选用的试剂如下: a.检验CO2用澄清石灰水; b.检验SO2用品红溶液; c.检验水蒸气用无水CuSO4。 ②根据被检验气体性质和所选试剂特点选定检验顺序。 如果水蒸气和其他气体同时需要检验时,且其他气体的检验需要用液体试剂,应首先检验水蒸气再检验其他气体。 ③对后续检验有影响的气体,要先检验然后再除去,并且必须验证是否除尽。 如果CO2和SO2同时需要检验时,应先“用品红溶液检验SO2”的存在,然后“用酸性KMnO4溶液除去SO2”,再“用品红溶液检验SO2是否被除尽”,最后才能检验CO2存在,若漏掉“用品红溶液检验SO2是否被除尽”则要扣分。 滴定终点的准确判断 用右图装置可以测定混合气中ClO2的含量: Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL 稀硫酸; Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口; Ⅲ.将一定量的混合气体通入锥形瓶中吸收; Ⅳ.将玻璃液封装置中的水倒入锥形瓶中; Ⅴ.用0.100 0 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O===2I-+S4O),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。 步骤Ⅴ中加入的指示剂通常为________,滴定至终点的现象是_____________________。 淀粉溶液 当滴入最后一滴Na2S2O3标准溶液后,溶液由蓝色变为无色,且半分钟内颜色不再改变 (1)答题模板 当滴入最后一滴××标准溶液后,溶液由××色变成××色,或溶液××色褪去,且半分钟内不恢复原来的颜色 (2)注意问题 试纸的选择与使用 聚合硫酸铁又称聚铁,化学式为 [Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O)过程如下: 溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为________________________________________________________________________。 将一小片pH试纸放到干燥、洁净的表面皿(或玻璃片)上,用玻璃棒蘸取少量溶液,点到试纸的中央,等试纸变色后,再跟标准比色卡对比读数 (1)定量试纸(如pH试纸) 取一小片××试纸放在干燥、洁净的表面皿(或玻璃片)上,用玻璃棒蘸取少量待测液,点在××试纸上,待试纸变色后再与标准比色卡对照,得出测量数据。 (2)定性试纸(如红色石蕊试纸、蓝色石蕊试纸、淀粉KI试纸等) ①检验溶液 将××试纸放在干燥、洁净的表面皿(或玻璃片)上,用洁净的玻璃棒蘸取少量待测液点在试纸的中部,试纸由××色变为××色,即证明××溶液具有××性质。 ②检验气体 取一小片××试纸用蒸馏水润湿,粘在玻璃棒的一端,靠近盛有待测气体的容器口(如试管的管口)附近,试纸由××色变为××色,即证明该气体是××。 装置气密性的检查 制备氮化镁的装置示意图如下: 检查装置气密性的方法是__________________________________________________。 关闭a的活塞,在G中先加少量蒸馏水,用酒精灯微热b,这时G中有气泡冒出,停止加热,冷却后,G中插在水中的玻璃管形成一段稳定的水柱,则装置气密性良好 气密性检查的两种常用方法 (1)微热法检查 封闭(关闭活塞、导管末端插入盛水的烧杯中等)、微热(双手捂热或用酒精灯稍微加热)、气泡(观察到导管口有气泡逸出)、水柱(移开双手或停止加热,观察到导管中液面上升形成一段稳定的水柱)。 (2)液差法检查 封闭(关闭活塞或用止水夹夹住橡皮管等)、液差(向××容器中加水,使××和××形成液面差,停止加水,放置一段时间,液面差保持不变)。 (3)该类试题的四个得分点 ①选择方法:微热法或液差法; ②叙述操作:如何形成密闭体系、如何加热; ③描述现象:观察气泡、液柱或液面变化; ④得出结论:通过什么现象说明气密性良好。 实验现象的规范描述 某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空的注射器。请回答有关问题: (1)设计装置A的目的是____________________________________________________ ________________________________________________________________________。 (2)在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸并微热,观察到装置B中的现象是________________________________________________________________________ ________________________________________________________________________。 (1)利用碳酸钙与稀硝酸反应产生的CO2排尽装置中的空气,防止因NO与O2反应生成NO2而产生干扰 (2)Cu丝表面产生气泡,稀硝酸液面上方仍为无色,溶液变蓝 (1)实验现象描述的三大类型 ①有关溶液的现象描述(五大类) a.颜色由……变成…… b.液面上升或下降(形成液面差); c.溶液变浑浊或生成(产生)……(颜色)沉淀; d.溶液发生倒吸; e.产生大量气泡(或有气体从溶液中逸出)等。 ②有关固体物质的现象描述(四大类) a.……(固体)表面产生大量气泡; b.……(固体)逐渐溶解; c.……(固体)体积逐渐变小(变细); d.……(固体)颜色由……变成…… ③有关气体的现象描述(三大类) a.生成……色(味)气体; b.气体由……色变成……色; c.气体先变……后……(加深、变浅、褪色等)。 (2)现象描述时的注意事项 ①现象描述要全面:看到的、听到的、摸到的、闻到的。 ②要注重对本质现象的观察:本质现象就是揭示事物本质特征的现象。如镁带在空气中燃烧时“生成白色固体”是本质现象,因为由此现象可正确理解化学变化这个概念,而发出“耀眼的白光”则是非本质现象。因此,观察实验现象要有明确的观察目的和主要的观察对象。 ③现象描述要准确 a.不能以结论代替现象。如铁丝在氧气中燃烧的实验现象是“火星四射,放出大量的热,生成黑色固体”,而不能用结论“生成四氧化三铁”代替“生成黑色固体”。 b.要明确“光”和“火焰”“烟”和“雾”等概念的区别,不能相互代替。 原因类规范语言表述 向硫酸铜、氯化钠混合溶液中滴加亚硫酸钠溶液生成CuCl沉淀,实验测得溶液的pH与亚硫酸钠溶液体积的关系曲线如图所示。 请回答下列问题: (1)解释亚硫酸钠溶液呈碱性的原因:________________________________________ ________________________________________________________________________。 (2)解释图像中V查看更多