- 2021-08-23 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版高中化学选修3知识点总结
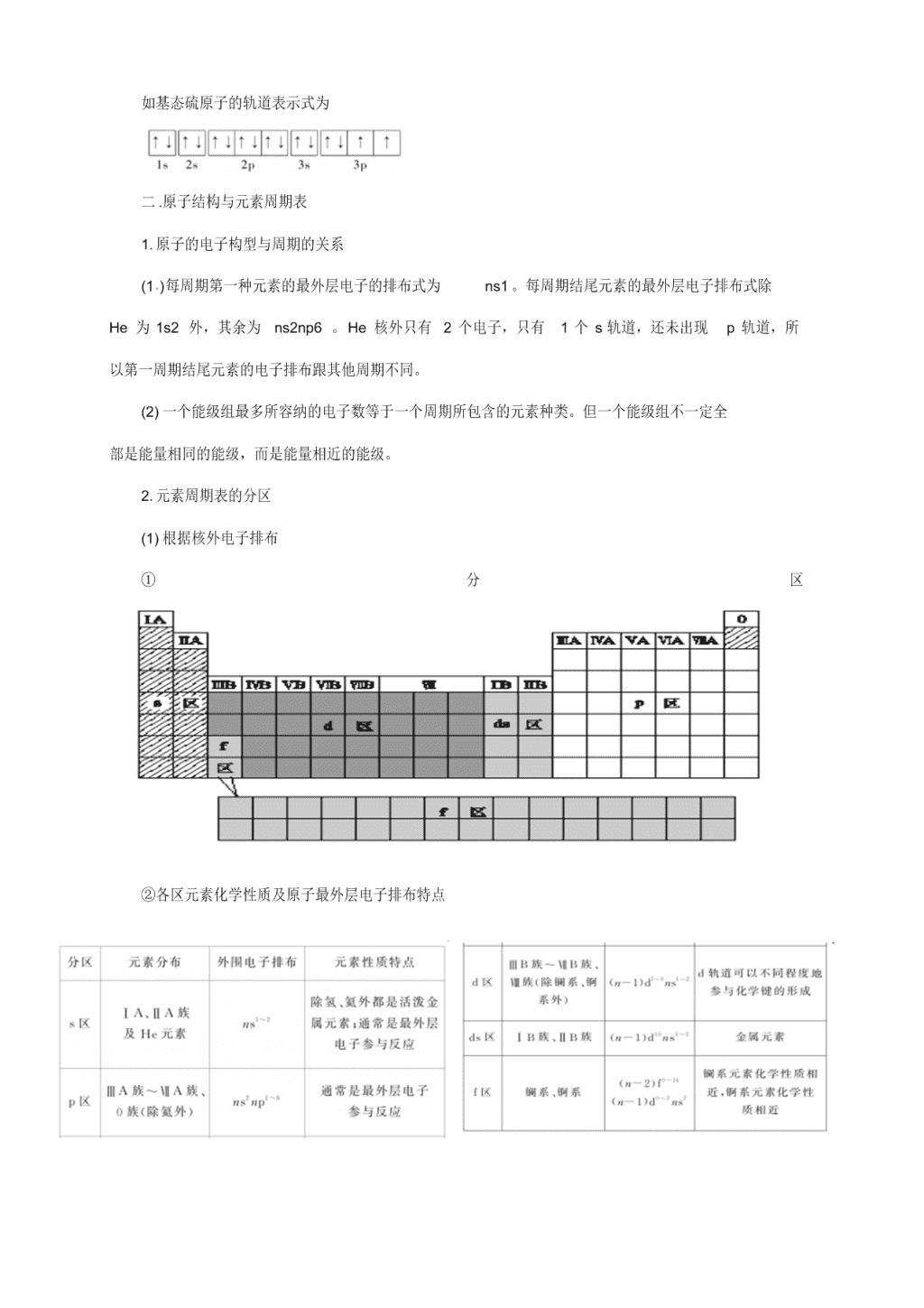
人教版高中化学选修 3 知识点总结 第一章 原子结构与性质 一.原子结构 1. 能级与能层 2. 原子轨道 3. 原子核外电子排布规律 ⑴构造原理: 随着核电荷数递增, 大多数元素的电中性基 态原子的电子按右图顺序填入核外电 子运动轨道(能级) ,叫做构造原理。 能级交错:由构造原理可知,电子先进入 4s 轨道,后进入 3d 轨道,这种现象叫能级交错。 说明: 构造原理并不是说 4s 能级比 3d 能级能量低 (实际上 4s 能级比 3d 能级能量高) ,而是 指这样顺序填充电子可以使整个原子的能量最低。 也就是说,整个原子的能量不能机械地看做是 各电子所处轨道的能量之和。 ( 2)能量最低原理 现代物质结构理论证实, 原子的电子排布遵循构造原理能使整个原子的能量处于最低状态, 简 称能量最 低原理。 构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。 ( 3)泡利 (不相容) 原理:基态多电子原子中, 不可能同时存在 4 个量子数完全相同的电子。 换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示) ,这个原理称为泡 利( Pauli )原理。 ( 4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个 轨道, 而且自旋方向相同, 这个规则叫洪特 (Hund )规则。 比如,p3 的轨道式为 或 ,而不是 。 洪特规则特例:当 p 、d、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的 状态。即 p0 、 d0 、f0 、p3 、d5 、 f7 、p6 、d10 、f14 时,是较稳定状态。 前 36 号元素中,全空状态的有 4Be 2s22p0 、12Mg 3s23p0 、20Ca 4s23d0 ;半充满状态的 有: 7N 2s22p3 、15P 3s23p3 、24Cr 3d54s1 、25Mn 3d54s2 、33As 4s24p3 ;全充满状态的 有 10Ne 2s22p6 、18Ar 3s23p6 、29Cu 3d104s1 、30Zn 3d104s2 、36Kr 4s24p6 。 4. 基态原子核外电子排布的表示方法 (1) 电子排布式 ①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如 K: 1s22s22p63s23p64s1 。 ②为了避免电子排布式书写过于繁琐, 把内层电子达到稀有气体元素原子结构的部分以相应稀 有气体的元素符号外加方括号表示,例如 K:[Ar]4s1 。 (2) 电子排布图 (轨道表示式 ) 每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。 ↑↓ ↑↓ ↓ ↓ ↑ ↑ ↑ 如基态硫原子的轨道表示式为 二 .原子结构与元素周期表 1. 原子的电子构型与周期的关系 (1 )每周期第一种元素的最外层电子的排布式为 ns1 。每周期结尾元素的最外层电子排布式除 He 为 1s2 外,其余为 ns2np6 。He 核外只有 2 个电子,只有 1 个 s 轨道,还未出现 p 轨道,所 以第一周期结尾元素的电子排布跟其他周期不同。 (2) 一个能级组最多所容纳的电子数等于一个周期所包含的元素种类。但一个能级组不一定全 部是能量相同的能级,而是能量相近的能级。 2. 元素周期表的分区 (1) 根据核外电子排布 ① 分 区 ②各区元素化学性质及原子最外层电子排布特点 ③若已知元素的外围电子排布,可直接判断该元素在周期表中的位置。如: 某元素的外围电子 排布为 4s24p4 ,由此可知,该元素位于 p 区,为第四周期Ⅵ A 族元素。即最大能层为其周期数, 最外层电子数为其族序数,但应注意过渡元素 (副族与第Ⅷ族 )的最大能层为其周期数,外围电子数 应为其纵列数而不是其族序数 (镧系、锕系除外 )。 三 .元素周期律 1. 电离能、电负性 (1)电离能是指气态原子或离子失去 1 个电子时所需要的最低能量,第一电离能是指电中性基 态原子失去 1 个电子转化为气态基态正离子所需要的最低能量。 第一电离能数值越小, 原子越容易 失去 1 个电子。在同一周期的元素中,碱金属 (或第Ⅰ A 族)第一电离能最小,稀有气体 (或 0 族 )第 一电离能最大,从左到右总体呈现增大趋势。同主族元素,从上到下 ,第一电离能逐渐减小。同一 原子的第二电离能比第一电离能要大 ( 2)元素的电负性用来描述不同元素的原子对键合电子吸引力的大小。 以氟的电负性为 4.0 , 锂的电负性为 1.0 作为相对标准 ,得出了各元素的电负性。电负性的大小也可以作为判断金属性和 非金属性强弱的尺度,金属的电负性一般小于 1.8,非金属的电负性一般大于 1.8 ,而位于非金属 三角区边界的“类金属”的电负性在 1.8 左右。它们既有金属性,又有非金属性。 ( 3)电负性的应用 ①判断元素的金属性和非金属性及其强弱 ②金属的电负性一般小于 1.8 ,非金属的电负性一般大于 1.8 ,而位于非金属三角区边界的 “类 金属” (如锗、锑等 )的电负性则在 1.8 左右,它们既有金属性,又有非金属性。 ③金属元素的电负性越小,金属元素越活泼;非金属元素的电负性越大,非金属元素越活泼。 ④同周期自左到右,电负性逐渐增大,同主族自上而下,电负性逐渐减小。 2. 原子结构与元素性质的递变规律 3.对角线规则 在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,如 第二章 分子结构与性质 课标要求 1.了解共价键的主要类型 键和 键,能用键长、键能和键角等说明简单分子的某些性质 2.了解杂化轨道理论及常见的杂化轨道类型( sp、sp2 、sp3 ),能用价层电子对互斥理论或者杂化 轨道理论推测常见的简单分子或离子的空间结构。 3.了解简单配合物的成键情况。 4.了解化学键合分子间作用力的区别。 5.了解氢键的存在对物质性质的影响,能列举含氢键的物质。 要点精讲 一.共价键 1.共价键的本质及特征 共价键的本质是在原子之间形成共用电子对,其特征是具有饱和性和方向性。 2.共价键的类型 ①按成键原子间共用电子对的数目分为单键、双键、三键。 ②按共用电子对是否偏移分为极性键、非极性键。 ③按原子轨道的重叠方式分为 σ键和 π键,前者的电子云具有轴对称性,后者的电子云具有镜 像对称性。 3.键参数 ①键能:气态基态原子形成 1 mol 化学键释放的最低能量,键能越大,化学键越稳定。 ②键长:形成共价键的两个原子之间的核间距,键长越短,共价键越稳定。 ③键角:在原子数超过 2 的分子中,两个共价键之间的夹角。 ④键参数对分子性质的影响 键长越短,键能越大,分子越稳定. 4.等电子原理 [来源 :学§科§网 ] 原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质相近。 二.分子的立体构型 1.分子构型与杂化轨道理论 杂化轨道的要点 当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨 道数不同,轨道间的夹角不同,形成分子的空间形状不同。 2 分子构型与价层电子对互斥模型 价层电子对互斥模型说明的是价层电子对的空间构型, 而分子的空间构型指的是成键电子对空间构 型,不包括孤对电子。 (1) 当中心原子无孤对电子时,两者的构型一致; (2) 当中心原子有孤对电子时,两者的构型不一致。 3.配位化合物 (1)配位键与极性键、非极性键的比较 (2)配位化合物 ①定义:金属离子 (或原子 )与某些分子或离子 (称为配体 )以配位键结合形成的化合物。 ②组成:如 [Ag(NH3)2]OH ,中心离子为 Ag +,配体为 NH3 ,配位数为 2。 三 .分子的性质 1.分子间作用力的比较 2.分子的极性 (1) 极性分子:正电中心和负电中心不重合的分子。 (2) 非极性分子:正电中心和负电中心重合的分子。 3.溶解性 (1) “相似相溶”规律:非极性溶质一般能溶于非极性溶剂, 极性溶质一般能溶于极性溶剂.若存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。 (2) “相似相溶”还适用于分子结构的相似性,如乙醇和水互 溶,而戊醇在水中的溶解度明显减小. 4.手性 具有完全相同的组成和原子排列的一对分子, 如左手和右手一样互为镜像, 在三维空间里不能重叠 的现象。 5.无机含氧酸分子的酸性 无机含氧酸可写成 (HO)mROn ,如果成酸 元素 R 相同,则 n 值越大, R 的正电性越高,使 R— O — H 中 O 的电子向 R 偏移,在水分子的作用下越易电离出 H+,酸性越强,如 HClO <HClO 2< HClO 3< HClO 4 第三章 晶体结构与性质 一 .晶体常识 1. 晶体与非晶体比较 2. 获得晶体的三条途径 ①熔融态物质凝固。 ②气态物质冷却不经液态直接凝固(凝华) 。③溶质从溶液中析出。 3. 晶胞 晶胞是描述晶体结构的基本单元。晶胞在晶体中的排列呈“无隙并置” 。 4. 晶胞中微粒数的计算方法——均摊法 如某个粒子为 n 个晶胞所共有,则该粒子有 1/n 属于这个晶胞。中学中常见的晶胞为立方晶 胞 立方晶胞中微粒数的计算方法如下: 注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状 二 .四种晶体的比较 2 .晶体熔、沸点高低的比较方法 ( 1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子 晶体>分子晶体。 金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。 ( 2)原子晶体 由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高.如熔点:金 刚石>碳化硅>硅 ( 3)离子晶体 一般地说,阴阳离子的电荷数越多, 离子半径越小, 则离子间的作用力就越强, 相应的晶格能 大,其晶体的熔、沸点就越高。 ( 4)分子晶体 ①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。 ②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。 ③组成和结构不相似的物质(相对分子质量接近) ,分子的极性越大,其熔、沸点越高。 ④同分异构体,支链越多,熔、沸点越低。 ( 5)金属晶体 金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。 三 .几种典型的晶体模型 比较离子晶体、分子晶体、原子晶体、金属晶体的异同: 晶体类型 离子晶体 分子晶体 原子晶体 金属晶体 结 构成晶体的 粒子 阴阳离子 分子 原子 金属离子、自 由电子 构 微粒间 作用力 离子键 范德华力 共价键 金属键 性 质 熔沸点 熔沸点高 熔沸点低 熔沸点很高 熔沸点高或低 硬度 硬而脆 硬度小 质地硬 硬度大或小 溶解性 易溶于极性溶 剂 水溶液能够导 电 不溶于大多数 溶剂 导 电 性 晶体 不导电 不导电 不导电 导电 熔融液 导电 不导电 不导电 导电 溶液 导电 可能导电 不溶于水 不溶于水 熔化时克服 的作用力 离子键 共价键 范德华力 金属键 实例 食盐晶体 氨、氯化氢 金刚石 镁、铝 练习:试比较下列物质的熔沸点高低: Mg 、 Na 、 NaCl 、干冰、汞 、碳化硅、冰、硫磺、晶体硅、 CsCl 、HCl 、金刚石、 HBr 、HI 、 N 2 、 H 2 思考方法: 首先比较常温下的状态 其次,同状态比较晶体类型 再,同晶型比较中(ⅰ)分子晶体比较式量, (ⅱ)其他一般比较半径即可查看更多