- 2021-08-23 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省泸县第五中学2020届高三下学期高考适应性考试理综-化学试题
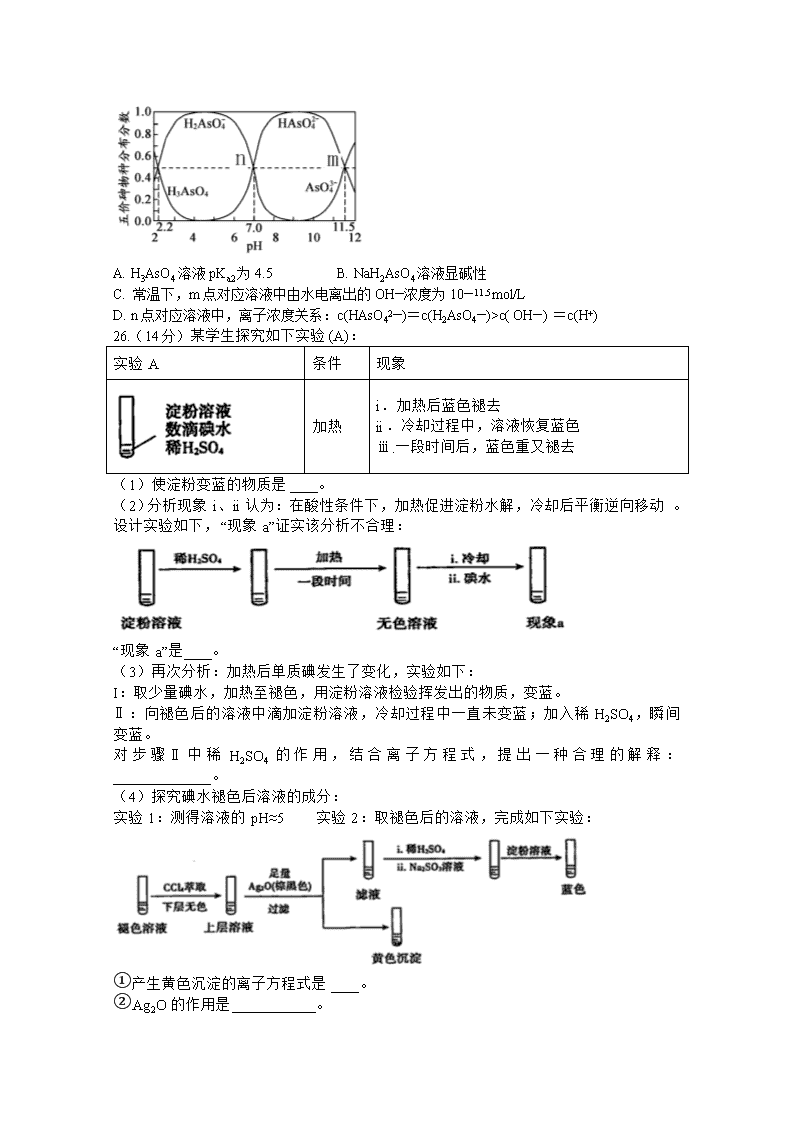
7.化学,就在身旁。下列说法错误的是 A.常见医用口罩的过滤层主要材质是聚丙烯,其结构简式为 B.气溶胶是固态或液态颗粒分散在气体介质中所形成的分散系 C.为了防止蛋白质变性,疫苗等生物制剂要冷冻保藏 D.中医经典方剂“清肺排毒汤”,其处方组成中的生石膏化学式为CaSO4·2H2O 8.医用酒精和84消毒液混合使用可能发生反应:4NaClO+CH3CH2OHHCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是 A.含NA个ClO-的NaClO溶液中,Na+数目为NA B.上述反应中,每生成1molNaCl,转移的电子数为8NA C.100 g质量分数为46%的乙醇溶液中所含的氢原子数为6NA D.标准状况下,2.24 L HCCl3含有的共用电子对的数目为0.4NA 9.现在正是全球抗击新冠病毒的关键时期,专家指出磷酸氯喹对治疗新冠病毒感染有明显效果,磷酸氯喹的分子结构如图所示,下列关于该有机物的说法正确的是 A.该有机物的分子式为:C18H30N3O8P2Cl B.该有机物能够发生加成反应、取代反应、不能发生氧化反应 C.该有机物苯环上的1-溴代物只有2种 D.1mol该有机物最多能和8molNaOH发生反应 10.短周期主族元素X、Y、Z、W的原子序数依次增大,其中只有一种金属元素,它们对应的单质和它们之间形成的常见二元化合物中,有三种有色物质能与水发生氧化还原反应且水没有电子的得失,下列说法正确的是 A.简单离子半径:r(W)>r(Z)>r(Y)>r(X) B.最简单气态氢化物的稳定性:X>Y C.W形成的含氧酸是强酸 D.Z、Y形成的某种化合物中含有共价键且在熔融状态下能导电 11.常温下,下列各组离子在溶液中一定能大量共存的是 A.无色溶液中:H+、Fe2+、Cl-、SO42—、K+ B.K+、Na+、NO3—、Cl- C.Na+、Al3+、OH-、NO3— D.pH=13的溶液:Na+、K+、Cl-、HCO3— 12.Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。如图用该水激活电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是 A. II为正极,其反应式为Ag+ + e– =Ag B. 水激活电池内Cl–由正极向负极迁移 C. 每转移1 mole-,U型管中消耗0. 5mol H2O D. 开始时U型管中Y极附近pH逐渐增大 13.H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度 占各物种浓度之和的分数)与pH的关系如下图所示(已知pKa=-lgKa),下列说法正确的是 A. H3AsO4溶液pKa2为4.5 B. NaH2AsO4溶液显碱性 C. 常温下,m点对应溶液中由水电离出的OH—浓度为10—11.5 mol/L D. n点对应溶液中,离子浓度关系:c(HAsO42—)=c(H2AsO4—)>c( OH—) =c(H+) 26.(14分)某学生探究如下实验(A): 实验A 条件 现象 加热 i.加热后蓝色褪去 ii.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 (1)使淀粉变蓝的物质是____。 (2)分析现象i、ii认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动。 设计实验如下,“现象a”证实该分析不合理: “现象a”是____。 (3)再次分析:加热后单质碘发生了变化,实验如下: I:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝。 Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝。 对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释:______________。 (4)探究碘水褪色后溶液的成分: 实验1:测得溶液的pH≈5 实验2:取褪色后的溶液,完成如下实验: ①产生黄色沉淀的离子方程式是____。 ②Ag2O的作用是____________。 ③依据上述实验,推测滤液中含有的物质(或离子)可能是_________。 (5)结合化学反应速率解释实验A中现象i、现象iii蓝色褪去的原因:_______________。 27.(14分)钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。 已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表: 离子 开始沉淀时的pH 完全沉淀时的pH Fe3+ 2.1 3.1 Y3+ 6.0 8.2 ②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。 (1)写出Na2SiO3的一种用途________________________。 (2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。 ① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。 A.NaOH溶液 B.氨水 C.CO2 D.HNO3 ② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。 (3)常温下,反应Fe3++3H2O(g) Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。 (4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。 28.(15分).二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。 (1)科学家提出由CO2制取C的太阳能工艺如图所示。 ①若“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为____________。 ②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为________。 (2)工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,则2CO2(g)+ 6H2(g)CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。 ①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。 a.逆反应速率先增大后减小 b.H2的转化率增大 c.反应物的体积百分含量减小 d.容器中的nCO2/nH2值变小 ②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3) =___;KA、KB、KC三者之间的大小关系为_____。 (3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c (NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2ONH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1) 35(15分).铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题: (1)画出基态Cu原子的价电子排布图__________________; (2)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因_________________________________________________________________________。 (3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是____________,配体中提供孤对电子的原子是____________。C、N、O三元素的第一电离能由大到小的顺序是__________(用元素符号表示)。 (4)铜晶体中铜原子的堆积方式如图1所示,则晶体铜原子的堆积方式为________________。 (5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(白球代表铜原子)。 ①该晶体的化学式为_________________。 ②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于_________化合物(填“离子”、“共价”) ③已知该晶体的密度为g/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________pm(写出计算式)。 36(15分).屈昔多巴( )是一种抗帕金森氏病药物。以下是屈昔多巴的一种合成路线( 简写为BnCl, 简写为CbzCl ): 回答下列问题: (1)反应①的反应类型为_________,其作用为_____________。 (2)屈昔多巴中所含的非含氧官能团名称为_______________,屈昔多巴分子中有_____个手性碳原子。 (3)反应②为加成反应,则有机物X的名称为________________。 (4)显________性(填“酸”、“中”或“碱”)。 (5)的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_____种,其中核磁共振氢谱为四组峰的结构简式为___________________________。 (6)参照上述合成路线,以对羟基苯甲醛为原料(无机试剂任选),设计制备对羟基苯甲酸的合成路线: __________________________________。 化学答案 7-13:ABDDBBD 26. I2 加入碘水后,溶液中无明显现象(不变蓝) 溶液中存在平衡H++I-+ HIOI2+H2O,加入硫酸,c(I-)升高,平衡右移,生成的碘与淀粉作用变蓝 Ag2O+2I- +2H+=2AgI↓+H2O 同时除去I和H+ HIO 淀粉水解速率较慢,而碘在水中受热歧化较快,因而实验A中i步骤加热后碘歧化,蓝色褪去;而在ⅲ中经过较长时间,淀粉水解完全,蓝色最终再次褪去。 27.工业粘合剂、制备硅胶、木材防火剂等 B BeO22-+4H+===Be2++2H2O 10-4.3 3.1~6.0 Y3++3NH3·H2O=Y(OH)3↓+3NH4+ Y2(C2O4)3·nH2OY2O3+3CO↑+3CO2↑+nH2O 28.Fe3O4 2mol -130.8 b 0.18mol·L-1·min-1 KA=KC>KB > 1.25×10-3 35.亚铜离子核外电子处于稳定的全充满状态sp2、sp3NN > O > C面心立方最密堆积CuCl共价 36. 取代反应 保护羟基 氨基 2 氨基乙酸 或 甘氨酸 碱 6 查看更多