- 2021-08-23 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020学年高一化学5月月考试题(无答案)人教 新版
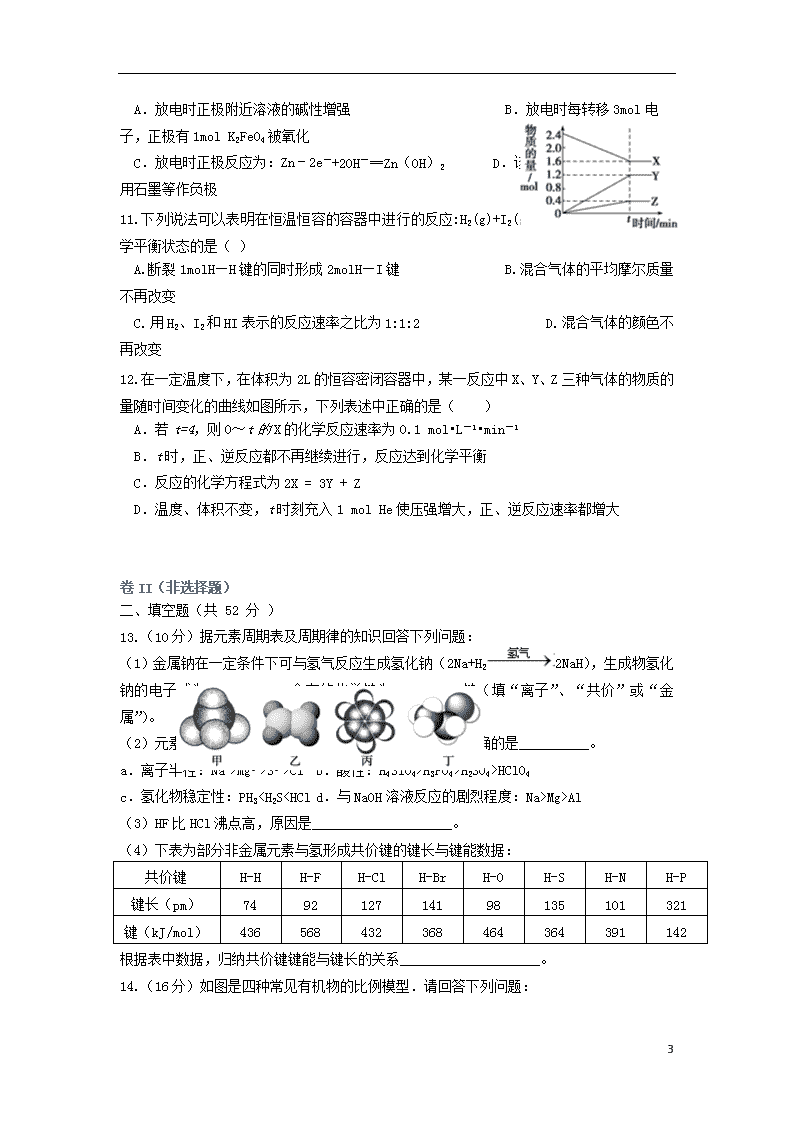
2019学年高一化学5月月考试题(无答案) 考试总分: 100 分 考试时间: 50 分钟 注意事项: 1.答题前填写好自己的姓名、班级、考号等信息; 2.请将答案正确填写在答题卡上; 3. 可能用到的相对原子质量:H 1; C 12; O 16; 卷I(选择题) 一、 选择题(本题共12道小题,每小题4分,共48分) 1.“群众利益无小事,食品安全是大事”。下列作法不会导致食品对人体健康有害的是( ) A. 调味剂和营养剂加得越多越好 B. 用硫磺熏制白木耳、粉丝等食品 C. 用干冰保藏易变质的食品 D. 饮用水越纯净越好 2.为了除去括号内的杂质,其试剂选择和分离方法都正确的是( ) 序号 物质(杂质) 所用试剂 分离方法 A 甲烷(乙烯) 溴水 洗气 B 氢氧化钠溶液(氢氧化钙溶液) 二氧化碳 过滤 C 乙烯(SO2) 酸性KMnO4 洗气 D CO2(HCl) 饱和Na2CO3溶液 洗气 3.下列说法中正确的一组是( ) A.H2和D2互为同位素 B. 和 互为同分异构体; C.正丁烷和异丁烷是同系物 D. 和 是同一种物质 4. 下列有关说法正确的是( ) A. 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 B. H2、SO2、CO2三种气体都可用浓硫酸干燥 C. SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 D. Fe(OH)3胶体无色、透明,能发生丁达尔现象 5.下列各组离子在指定溶液中能大量共存的是( ) A. 无色溶液中:K+、Na+、MnO4—、SO42— B. 酸性溶液中:Ba2+、Na+、SO32—、Cl— C. 在碱性溶液中:Cl—、HCO3—、SO42—、NH4+ 5 D. 在含Fe2+的溶液中:K+、Cl—、SO42-、Na+ 6.设阿伏加德罗常数的值为NA,下列说法中正确的是( ) A.15g甲基所含电子数为7NA B.标况下,分子数为NA的CO和C2H4混合气体的体积约为22.4 L C.0.1 mol C5H12分子中含有的C-C键数为0.5 NA D.标准状况下,2.24 L辛烷在氧气中完全燃烧生成CO2分子数为0.8 NA 7. 下列装置图对应的实验方案能达到实验目的是( ) A. B. 利用排空气法收集CO2 从含碘CCl4溶液中提取碘和回收CCl4溶剂 C. D. 探究Cu作负极的原电池原理 比较盐酸、碳酸、硅酸的酸性 8. X、Y、Z、W、Q均为短周期主族元素,它们的原子序数依次增大。X的单质是空气中体积分数最大的气体;Y与X形成的一种化合物是汽车尾气的要成分之一;常温下。金属Z能溶于W的最高价氧化物对应的水化物的稀溶液,却不溶于其冷的浓溶液。下列说法正确的是( ) A. 元素Y的最高正化合价为+6 B. 最简单氢化物的稳定性:Y>W C. 简单离子半径的大小顺序为Q>Z>Y D. 常温下,X 的氢化物分子与Q的简单离子具有相同的电子数 9.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。常温下,S2Cl2遇水易水解,并产生能使品红褪色的气体。下列说法错误的是 ( ) A.S2Cl2同时含有极性键和非极性键 B. S2Cl2的电子式为 C. S2Br2与S2Cl2结构相似,熔沸点:S2Br2 > S2Cl2 D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O = SO2↑+3S↓+4HCl 10.高铁电池是一种新型电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( ) 5 A.放电时正极附近溶液的碱性增强 B.放电时每转移3mol电子,正极有1mol K2FeO4被氧化 C.放电时正极反应为:Zn﹣2e-+2OH-═Zn(OH)2 D.该原电池,Zn作正极,可用石墨等作负极 11.下列说法可以表明在恒温恒容的容器中进行的反应:H2(g)+I2(g)2HI(g)已经达到化学平衡状态的是( ) A. 断裂1molH—H键的同时形成2molH—I键 B. 混合气体的平均摩尔质量不再改变 C. 用H2、I2和HI表示的反应速率之比为1:1:2 D. 混合气体的颜色不再改变 12.在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( ) A.若t=4,则0~t的X的化学反应速率为0.1 mol•L-1•min-1 B.t时,正、逆反应都不再继续进行,反应达到化学平衡 C.反应的化学方程式为2X = 3Y + Z D.温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大 卷II(非选择题) 二、填空题(共 52 分 ) 13.(10分)据元素周期表及周期律的知识回答下列问题: (1)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H22NaH),生成物氢化钠的电子式为__________,含有的化学键为__________键(填“离子”、“共价”或“金属”)。 (2)元素周期表中元素的性质存在递变规律,下列比较正确的是__________。 a.离子半径:Na+>Mg2+>S2->Cl- b.酸性:H4SiO4>H3PO4>H2SO4>HClO4 c.氢化物稳定性:PH3查看更多