- 2021-08-23 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
福建省宁德市2019-2020学年高二上学期期末考试化学试题
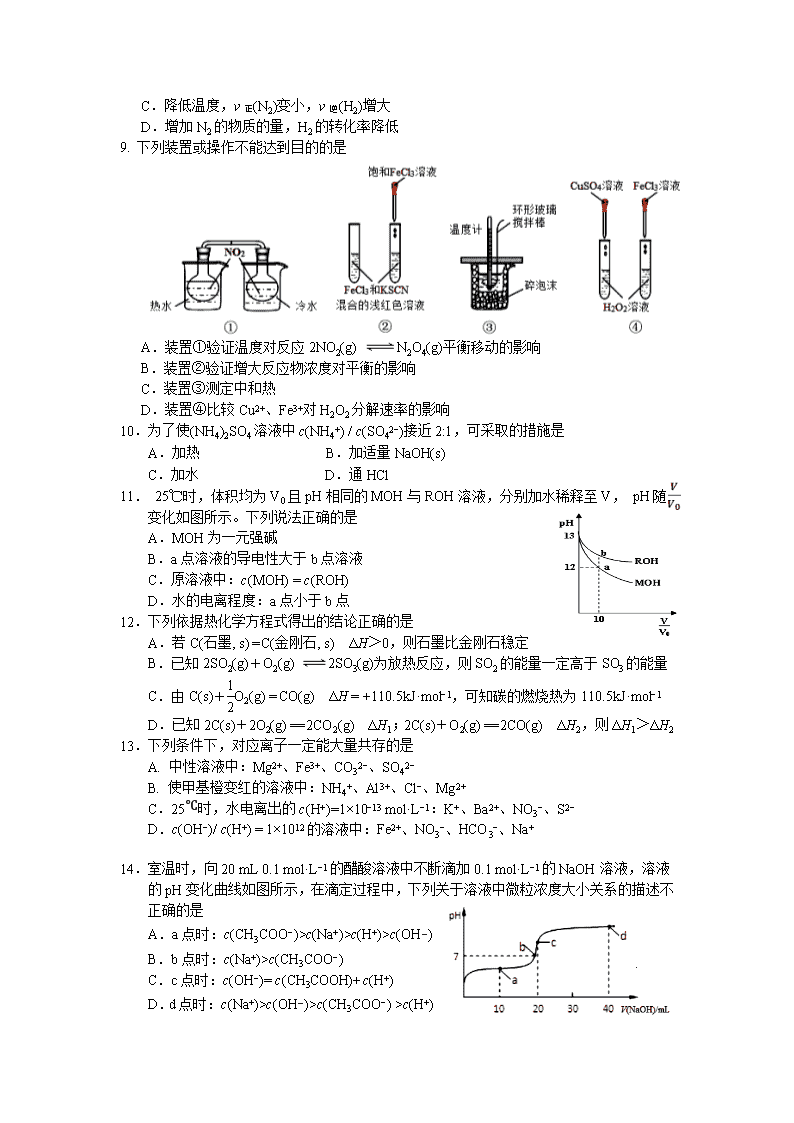
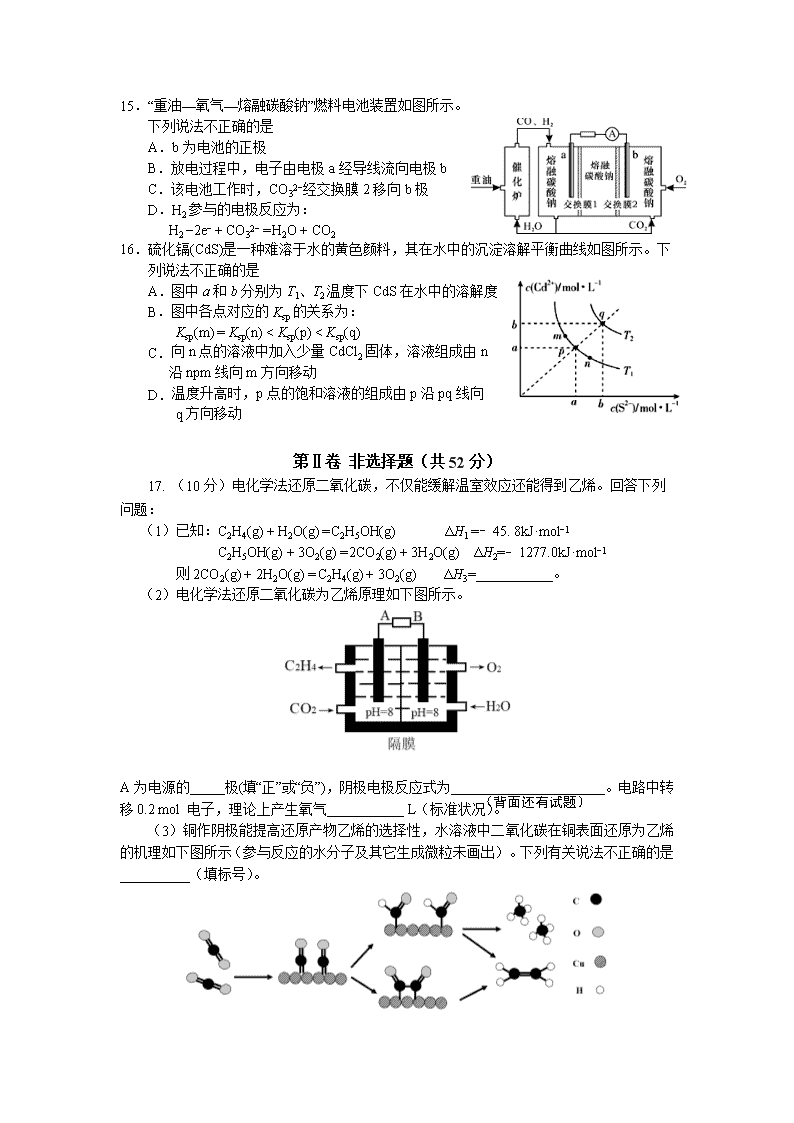
宁德市2019−2020学年度第一学期期末高二质量检测 化 学 试 题 (考试时间:90分钟 试卷总分:100分) 注意: 1.在本试卷上作答无效,应在答题卡各题指定的答题区域内作答。 2.相对原子质量:H-l C-12 N-14 O-16 S-32 Fe-56 Ba-137 第Ⅰ卷 选择题(共48分) 本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意。 1.下列物质不属于毒品的是 A.吗啡 B.青霉素 C.海洛因 D.冰毒 2.下列物质属于弱电解质的是 A.O2 B.AgCl C.C2H5OH D.NH3•H2O 3.下列说法正确的是 A.钢铁的腐蚀都是析氢腐蚀 B.电解精炼铜时,阳极泥中含有Zn、Fe、Au、Ag等金属 C.电镀铜时用待镀的金属制品作阳极,铜作阴极 D.氯化铝溶液蒸干灼烧产物为氧化铝 4.下列化学用语不正确的是 A. 醋酸的电离:CH3COOHCH3COO−+H+ B. 碳酸氢钠在水溶液中的电离:NaHCO3 === Na++HCO3− C. 氯化铵的水解离子方程式:NH4++H2ONH4OH+H+ D. 碳酸钙的溶解平衡:CaCO3(s)Ca2+(aq)+CO32−(aq) 5.对于反应A(g)+3B(g)2C(g)+2D(g),其中反应速率最快的是 A. v(D) = 0.30 mol·L−1·s−1 B. v(A) = 0.50 mol·L−1·s−1 C. v(B) = 0.60 mol·L−1·s−1 D. v(C) = 0.50 mol·L−1·s−1 6.如右图所示的双液原电池,下列叙述正确的是 A.Cu为电池负极 B.Ag电极上发生氧化反应 C.盐桥中的阳离子向左池移动 D.外电路中,电流从Cu电极流向Ag电极 7.某温度下,在一固定容积的密闭容器中进行反应:2NO2(g)2NO(g)+O2(g)。该条件下,一定能说明该反应已达到化学平衡状态的是 A.单位时间内生成n mol O2的同时生成2n mol NO B.用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态 C.混合气体的颜色不再改变的状态 D.混合气体密度不再改变的状态 8.已知反应N2(g) + 3H2(g) 2NH3(g),ΔH <0,在恒容密闭容器中反应达到平衡时,下列说法正确的是 A.通入稀有气体使压强增大,v正(N2)增大 B.3 v正(N2) ═ v逆(H2) C.降低温度,v正(N2)变小,v逆(H2)增大 D.增加N2的物质的量,H2的转化率降低 9. 下列装置或操作不能达到目的的是 A.装置①验证温度对反应2NO2(g) N2O4(g)平衡移动的影响 B.装置②验证增大反应物浓度对平衡的影响 C.装置③测定中和热 D.装置④比较Cu2+、Fe3+对H2O2分解速率的影响 10.为了使(NH4)2SO4溶液中c(NH4+) / c(SO42−)接近2:1,可采取的措施是 A.加热 B.加适量NaOH(s) C.加水 D.通HCl 11. 25℃时,体积均为V0且pH相同的MOH与ROH溶液,分别加水稀释至V, pH随 变化如图所示。下列说法正确的是 A.MOH为一元强碱 B.a点溶液的导电性大于b点溶液 C.原溶液中:c(MOH) = c(ROH) D.水的电离程度:a点小于b点 12.下列依据热化学方程式得出的结论正确的是 A.若C(石墨, s) = C(金刚石, s) ΔH>0,则石墨比金刚石稳定 B.已知2SO2(g)+O2(g) 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 C.由C(s)+O2(g) = CO(g) ΔH = +110.5kJ·mol−1,可知碳的燃烧热为110.5kJ·mol−1 D.已知2C(s)+2O2(g) == 2CO2(g) ΔH1;2C(s)+O2(g) == 2CO(g) ΔH2,则ΔH1>ΔH2 13.下列条件下,对应离子一定能大量共存的是 A. 中性溶液中:Mg2+、Fe3+、CO32−、SO42− B. 使甲基橙变红的溶液中:NH4+、Al3+、Cl−、Mg2+ C.25℃时,水电离出的c(H+)=1×10−13 mol·L−1:K+、Ba2+、NO3−、S2− D.c(OH−)/ c(H+) = 1×1012的溶液中:Fe2+、NO3−、HCO3−、Na+ 14.室温时,向20 mL 0.1 mol·L−1的醋酸溶液中不断滴加0.1 mol·L−1的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中微粒浓度大小关系的描述不正确的是 A.a点时:c(CH3COO−)>c(Na+)>c(H+)>c(OH−) B.b点时:c(Na+)>c(CH3COO−) C.c点时:c(OH−)= c(CH3COOH)+c(H+) D.d点时:c(Na+)>c(OH−)>c(CH3COO−) >c(H+) 15.“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。 下列说法不正确的是 A.b为电池的正极 B.放电过程中,电子由电极a经导线流向电极b C.该电池工作时,CO32−经交换膜2移向b极 D.H2参与的电极反应为: H2 −2e− + CO32− = H2O + CO2 16.硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是 A.图中a和b分别为T1、T2温度下CdS在水中的溶解度 B.图中各点对应的Ksp的关系为: Ksp(m) = Ksp(n) < Ksp(p) < Ksp(q) C. 向n点的溶液中加入少量CdCl2固体,溶液组成由n 沿npm线向m方向移动 D. 温度升高时,p点的饱和溶液的组成由p沿pq线向 q方向移动 第Ⅱ卷 非选择题(共52分) 17. (10分)电化学法还原二氧化碳,不仅能缓解温室效应还能得到乙烯。回答下列 问题: (1)已知:C2H4(g) + H2O(g) = C2H5OH(g) ΔH1 =﹣45. 8kJ·mol−1 C2H5OH(g) + 3O2(g) = 2CO2(g) + 3H2O(g) ΔH2=﹣1277.0kJ·mol−1 则2CO2(g) + 2H2O(g) = C2H4(g) + 3O2(g) ΔH3=___________。 (2)电化学法还原二氧化碳为乙烯原理如下图所示。 (背面还有试题) A为电源的_____极(填“正”或“负”),阴极电极反应式为______________________。电路中转移0.2 mol 电子,理论上产生氧气___________ L(标准状况)。 (3)铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如下图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是__________(填标号)。 A. 铜是二氧化碳转化为乙烯的催化剂 B. 二氧化碳还原产物有甲烷和乙烯 C. 两个反应历程都是先加氢再除氧 D. 两个反应历程都出现碳氧键的断裂与碳碳键的形成 18.(14分)Ⅰ.碳酸钠作固硫剂并用氢还原辉钼矿的原理为 MoS2(s) + 4H2(g) + 2Na2CO3(s) Mo(s) + 2CO(g) + 4H2O(g) + 2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示。 (1)该反应的平衡常数表达式为K=_______________。 (2)由图1可知,该反应ΔH____0 (填“>”或“<”), p1、p2、p3由大到小的顺序为___。 (3)由图2可知,A点时H2的平衡转化率为____________。 Ⅱ.电解质在水溶液中存在各种行为,如电离、水解等,依据所学知识回答下列问题: (4)t℃时,纯水中c(H+)=1×10−6 mol·L−1,该温度下,pH=10的NaOH溶液的物质的量浓度为___________________。 (5)25℃时,相同物质的量浓度的下列溶液中:①NaCl ②NH3·H2O ③H2SO4 ④(NH4)2SO4,其中水的电离程度由大到小顺序为___________(填标号)。 (6)25℃时,将 a mol·L−1 的醋酸和 b mol·L−1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则a_______ b(填“>” “<”或“=”)。 19.(14分)从某矿渣【成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等】中回收NiSO4的工艺流程如下: 已知:(NH4)2SO4在350℃分解生成NH3和H2SO4;NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。 回答下列问题: (1)“研磨”的目的是___________。 (2) 矿渣中部分FeO在空气焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_________________________________________。 (3)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。 “浸渣”的成分除Fe2O3、FeO(OH)、CaSO4外还含有________(填化学式)。 (4)向“浸取液”中加入NaF以除去溶液中Ca2+,溶液中c(F−)至少为___mol·L−1时,可 使钙离子沉淀完全。[已知Ca2+浓度小于1.0×10−5mol·L−1时沉淀完全;Ksp(CaF2)=4.0×10−11] (5)萃取可用于对溶液中的金属离子进行富集与分离: Fe2+(水相)+2RH(有机相)FeR2(有机相)+ 2H+(水相) 萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳值为__________。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。 (6)若将流程图中浸泡步骤改为下图步骤(前后步骤不变)。依据下表数据判断,调pH范围为 ________。 20.(14分)莫尔盐[硫酸亚铁铵,(NH4)2Fe(SO4)2・6H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定,易溶于水,难溶于乙醇。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。 回答下列问题: Ⅰ. 制取莫尔盐 i.连接装置,检査装置气密性。将13.2 g (NH4)2SO4晶体置于三颈烧瓶B中,将6.0g洁净铁屑加入锥形瓶中。 ii.打开仪器a瓶塞,关闭活塞K3,打开K2、K1,加完55.0 mL 2mol·L−1稀硫酸后关闭K1。 iii.待大部分铁粉溶解后,打开K3、关闭K2,A中浅绿色溶液流入B。 iv.关闭活塞K2、K3,采用100℃水浴蒸发三颈烧瓶中水分,液面产生晶膜时,停止加热,冷却结晶、过滤、洗涤晶体。 (1)仪器a的名称是 。 (2)操作iii中浅绿色溶液会流入B的原因是 。 (3)操作iv中洗涤晶体所用试剂是 (填标号)。 A.水 B.无水乙醇 C.硫酸溶液 Ⅱ.为测定所得莫尔盐晶体纯度,取m g该样品配制成1L溶液,分别设计如下两个 实验方案,请回答: 方案一:取20.00mL所配硫酸亚铁铵溶液用0.1000 mol·L−1 的酸性K2Cr2O7 溶液进行滴定。重复三次。(已知:Cr2O72−还原产物为Cr3+) (4)写出此反应的离子方程式 。 (5)滴定时必须选用的仪器是 。(填标号) 方案二:取20.00mL所配硫酸亚铁铵溶液进行如下实验。 待测液 w g固体 足量的BaCl2溶液 过滤 洗涤 干燥 称量 (6)莫尔盐晶体纯度为_________。(用含m、w的式子表示) (7)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为_______________________________。 宁德市2019-2020学年第一学期高二期末检测 化 学 试 题 参考答案: 1.B 2.D 3.D 4.C 5.B 6.A 7.C 8.B 9.D 10.D 11.A 12.A 13.B 14.B 15.C 16.B 17. (10分) (1)+1322.8 kJ·mol−1(2分) (2)负(2分) 2CO2+8H2O+12e−=C2H4+12OH−(2分) 1.12(2分) (3)C(2分) 18.(14分) (1) K= (2分) (2)> (2分) p3>p2>p1 (2分) (3)50% (2分) (4)0.01 mol·L−1 (2分) (5)④①②③ (2分) (6)> (2分) 19.(14分) 焙烧 (1)增大接触面积,加快反应速率 (2分) (2)4FeO+6H2SO4+O22Fe2(SO4)3+6H2O(2分) (3)Fe3++2H2OFeO(OH)+3H+ (2分) SiO2(2分) (4)2.0×10−3 (2分) (5)0.25 (1分) 强酸性 (1分) (6) 3.7≤ pH <7.1(2分) 20.(14分) (1)分液漏斗 (2分) (2)A中产生H2使其压强大于B(2分) (3)B (2分) (4)6Fe2++Cr2O72−+14H+ === 6Fe3++2Cr3++7H2O(2分) (5)①④⑥ (2分) (6)×100%(2分) (7)部分Fe2+被空气氧化(2分)查看更多