- 2021-08-23 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高中化学 专题1课题一 海带中碘元素的分离及检验教学案 苏教版选修6
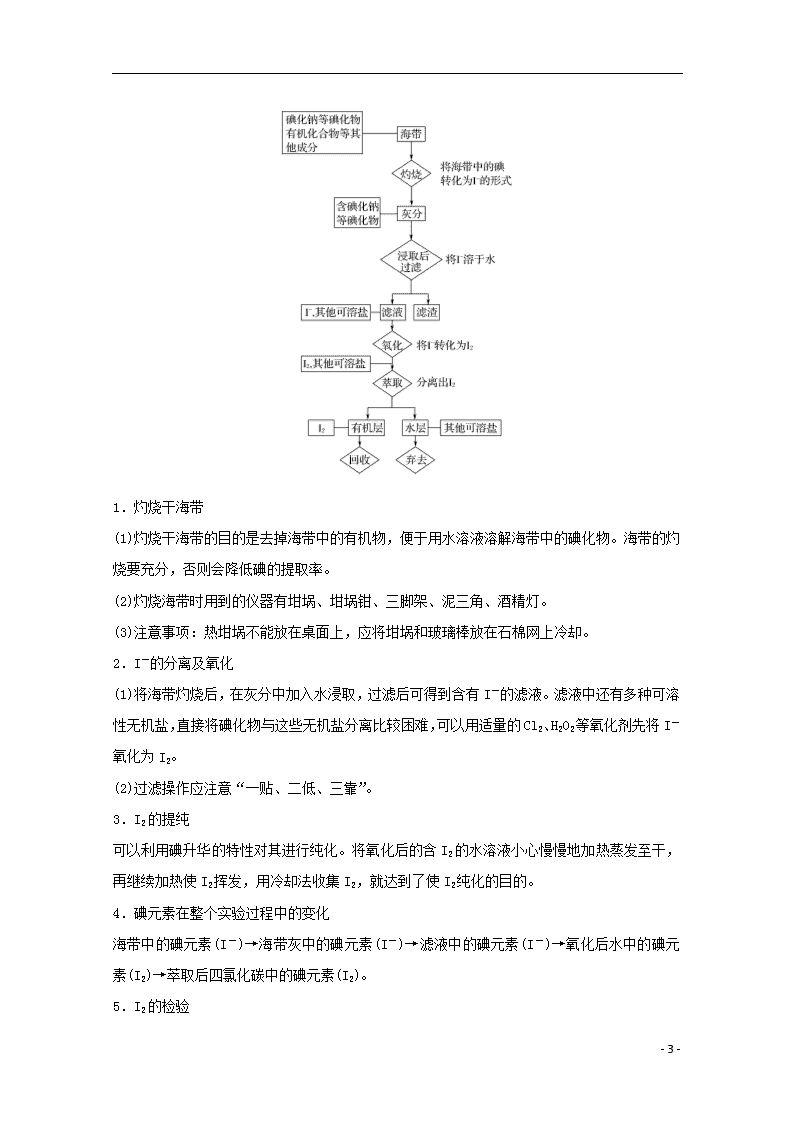
课题一 海带中碘元素的分离及检验 【学考报告】 知识条目 加试要求 ①从海带中分离和检验碘元素的原理及操作流程 ②萃取的原理及萃取方法的适用范围 ③溶解、过滤、萃取、分液等基本操作的要点 ④物质分离、提纯的基本原则及应用 b b b c 1.萃取原理 (1)萃取:是利用物质在互不相溶(或微溶)的溶剂中溶解能力不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液里提取出来的方法。 (2)分液:萃取后往往需要用分液漏斗将这两种不相溶的液体分开,这一操作称为分液。 (3)碘的萃取:碘单质易溶于CCl4、苯等有机溶剂。用与水不相溶的有机溶剂可以把碘单质从水溶液中萃取出来。例如,将四氯化碳与含有碘单质的水溶液混合振荡,碘单质就会从水中富集到四氯化碳中。静置分层后,上面水层的颜色变浅,下面四氯化碳层呈紫红色。 思考:碘在酒精中的溶解度大于在水中的溶解度,萃取碘能否使用酒精?请说明原因。选取萃取剂应该考虑哪些条件? 提示 不能使用酒精萃取水中的碘,因为酒精与水互溶。选择萃取剂应考虑三个条件:①不与溶质及原溶剂发生化学反应;②与原溶剂互不相溶;③溶质在萃取剂中溶解度远大于它在原溶剂中的溶解度。 2.海带中碘的提取原理 用化学方法提取、检验植物样品中的某些元素时,通常将待检验的植物样品高温灼烧,使其中的有机物分解。将海带样品灼烧,在灰烬中加入水浸取,过滤后可得到含有I-的滤液。滤液中还有多种可溶性无机盐,可以用适量的双氧水或氯气等氧化剂将I-氧化为I2,再用萃取 - 6 - 法将其提取出来。有关反应的化学方程式为2I-+H2O2+2H+===I2+2H2O、2I-+Cl2===I2+2Cl-。 3.从海带中提取碘的实验步骤 (1)灼烧 取3 g干燥的海带,剪成小块,放入坩埚或蒸发皿中,把坩埚放在三脚架上的泥三角上。在通风处加热灼烧,待海带灰化完全后,自然冷却,再将灰分转移至小烧杯中。 (2)浸取和过滤 向小烧杯中加入30 mL蒸馏水,煮沸2~3 min(加快碘化物在水中的溶解,以使灰分中的I-尽可能多地进入溶液),过滤,得无色滤液。 (3)氧化 在滤液中加入1~2 mL 2 mol·L-1 H2SO4溶液(海带灰的浸出液中含有碳酸钠、碳酸钾等使溶液显碱性的物质,酸化的目的是使溶液呈弱酸性,有利于氧化剂把I-氧化为I2),再加入3~5 mL 6% H2O2溶液或1 mL新制氯水,溶液由无色变为棕黄色。 (4)检验和萃取 取出少许混合液,用淀粉溶液检验碘,溶液应变为蓝色。再向余液中加入2 mL CCl4,萃取其中的碘。 4.茶叶中某些元素的鉴定 茶叶中某些元素的鉴定流程图 有关反应为①Fe3++SCN-[Fe(SCN)]2+,②Ca2++C2O===CaC2O4↓。 点拨一、海带中碘元素的提取流程 - 6 - 1.灼烧干海带 (1)灼烧干海带的目的是去掉海带中的有机物,便于用水溶液溶解海带中的碘化物。海带的灼烧要充分,否则会降低碘的提取率。 (2)灼烧海带时用到的仪器有坩埚、坩埚钳、三脚架、泥三角、酒精灯。 (3)注意事项:热坩埚不能放在桌面上,应将坩埚和玻璃棒放在石棉网上冷却。 2.I-的分离及氧化 (1)将海带灼烧后,在灰分中加入水浸取,过滤后可得到含有I-的滤液。滤液中还有多种可溶性无机盐,直接将碘化物与这些无机盐分离比较困难,可以用适量的Cl2、H2O2等氧化剂先将I-氧化为I2。 (2)过滤操作应注意“一贴、二低、三靠”。 3.I2的提纯 可以利用碘升华的特性对其进行纯化。将氧化后的含I2的水溶液小心慢慢地加热蒸发至干,再继续加热使I2挥发,用冷却法收集I2,就达到了使I2纯化的目的。 4.碘元素在整个实验过程中的变化 海带中的碘元素(I-)→海带灰中的碘元素(I-)→滤液中的碘元素(I-)→氧化后水中的碘元素(I2)→萃取后四氯化碳中的碘元素(I2)。 5.I2的检验 - 6 - 用淀粉溶液检验单质碘的存在。 注意:检验碘元素应取少量样品,不要向所有滤液中直接加淀粉溶液,否则后续实验将无法操作。 点拨二、萃取和分液 1.适用范围 (1)萃取:分离液态物质。 (2)分液:将互不相溶的两种液体分开。 2.萃取 (1)原理:利用溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液里提取出来的方法。 (2)萃取剂选择的三个原则: ①不与溶质及原溶剂发生化学反应; ②与原溶剂互不相溶; ③溶质在萃取剂中溶解度远大于它在原溶剂中的溶解度。 3.分液 (1)概念:将两种不相溶的液体分开的操作。 (2)主要仪器:分液漏斗。 ①检查: a.检查玻璃塞和旋塞芯是否与分液漏斗配套。 b.检查玻璃塞和旋塞芯是否漏水。 ②使用: a.盛放液体不得超过分液漏斗的容量的。 b.盛有液体的分液漏斗竖直放在支架上。 ③操作方法:下层液体从下口流出,上层液体从上口倒出。 4.萃取与分液的操作方法 (1)向溶液中加入萃取剂并转移到分液漏斗中,塞上玻璃塞。 (2)用右手压住分液漏斗的玻璃塞,左手握住旋塞,将分液漏斗倒转过来用力振摇。 (3)几次振摇并放气后,将分液漏斗置于铁架台铁圈上,静置片刻。 (4)打开分液漏斗的玻璃塞或使塞上的凹槽或小孔对准漏斗口上的小孔,使漏斗内外空气相通。 - 6 - (5)打开旋塞,使下层液体慢慢流出,而上层液体从漏斗上口倒出。 [典例剖析] 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的流程如下: (1)指出提取碘的过程中有关的实验操作名称: ①________,③________。 写出过程②中有关反应的离子方程式________________________。 (2)提取碘的过程中,可供选择的有机试剂是( ) A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油 (3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯,玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是________________________。 (4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:①_________________;②_______________________;③________________________。 (5)进行上述蒸馏操作时,使用水浴的原因是________________________,最后晶体碘在________里聚集。 解析 (2)选择萃取剂的要求为:不溶于水,碘在萃取剂中的溶解度较大。 (2)缺少过滤用的漏斗和萃取分液时必需的分液漏斗。 答案 (1)①过滤 ③萃取 Cl2+2I-===I2+2Cl- - 6 - (2)B (3)分液漏斗、漏斗 (4)①缺石棉网 ②温度计插到了液体中 ③冷凝管进出水的方向颠倒 (5)使蒸馏烧瓶受热均匀,控制加热温度不过高 蒸馏烧瓶 [跟踪训练] 1.海带中含碘元素。从海带中提取碘有如下步骤:①通入适量Cl2 ②将海带灼烧成灰后加蒸馏水搅拌 ③加CCl4振荡 ④过滤。合理的操作顺序是( ) A.①②③④ B.②①③④ C.①③②④ D.②④①③ 解析 从海带中提取碘的步骤为灼烧、浸取和过滤、氧化、萃取。根据每个步骤的需要选择试剂。 答案 D 2.用四氯化碳萃取碘的饱和水溶液中的碘,下列说法中不正确的是( ) A.实验使用的主要仪器是分液漏斗 B.碘在四氯化碳中的溶解度比在水中的溶解度大 C.碘的四氯化碳溶液呈紫红色 D.分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出 解析 因四氯化碳的密度比水的密度大,所以萃取后分层时上层为水层,下层为四氯化碳层,分液时,碘的四氯化碳溶液从下口流出,水从分液漏斗上口倒出。 答案 D 知识拓展 碘单质的反萃取法 将实验中萃取后的四氯化碳溶液收集起来后,向其中慢慢滴加40% NaOH溶液,边滴加边振荡,直到四氯化碳层不显红色为止。 将混合液转入分液漏斗中,静置分液。向得到的水溶液中滴加45%硫酸溶液使其酸化,可重新生成碘单质。由于碘单质在水中的溶解度很小,可沉淀析出。 分离后,可以得到固态碘单质。有关的化学反应为: 3I2+6OH-===IO+5I-+3H2O IO+5I-+6H+===3I2+3H2O - 6 -查看更多