2017-2018学年河北省定州中学高二(承智班)上学期期末考试化学试题 Word版
河北定州中学(承智班)2017—2018学年度第一学期期末考试
高二年级 化学试卷
一、单选题
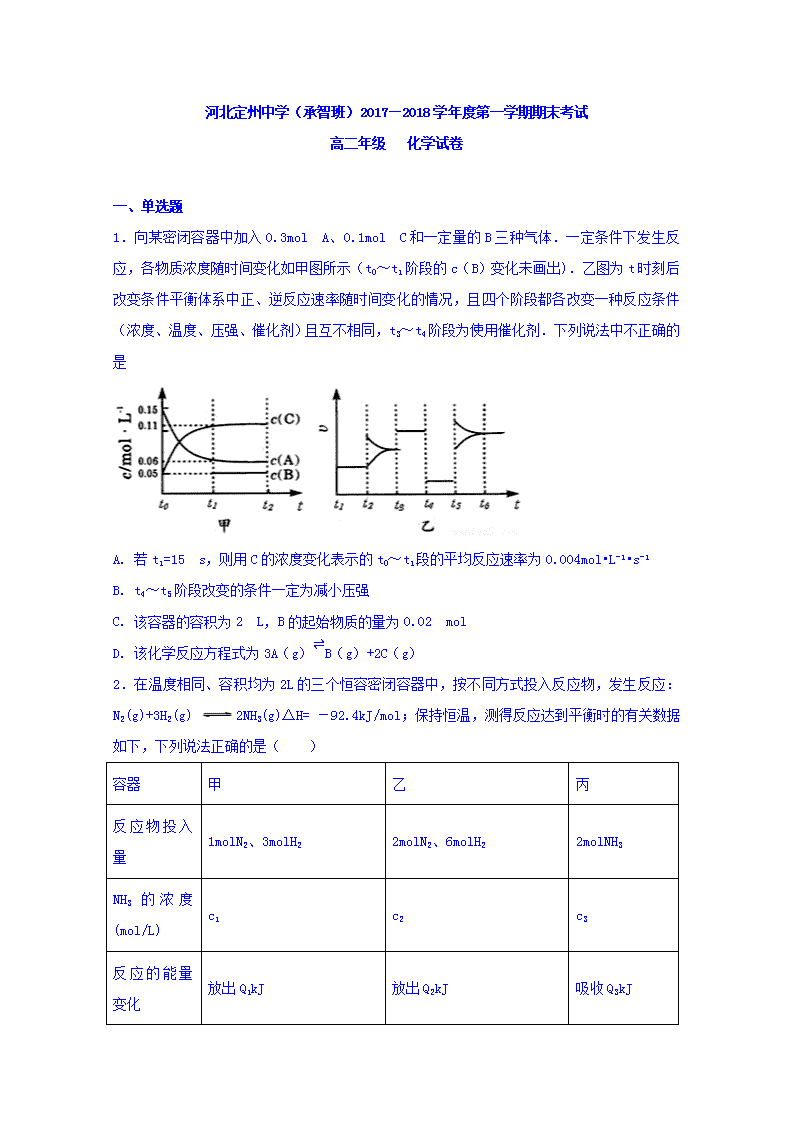
1.向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如甲图所示(t0~t1阶段的c(B)变化未画出).乙图为t时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件(浓度、温度、压强、催化剂)且互不相同,t3~t4阶段为使用催化剂.下列说法中不正确的是
A. 若t1=15 s,则用C的浓度变化表示的t0~t1段的平均反应速率为0.004mol•L-1•s-1
B. t4~t5阶段改变的条件一定为减小压强
C. 该容器的容积为2 L,B的起始物质的量为0.02 mol
D. 该化学反应方程式为3A(g)⇌B(g)+2C(g)
2.在温度相同、容积均为2L的三个恒容密闭容器中,按不同方式投入反应物,发生反应:N2(g)+3H2(g) 2NH3(g)△H= -92.4kJ/mol;保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是( )
容器
甲
乙
丙
反应物投入量
1molN2、3molH2
2molN2、6molH2
2molNH3
NH3 的浓度(mol/L)
c1
c2
c3
反应的能量变化
放出Q1kJ
放出Q2kJ
吸收Q3kJ
体系压强
p1
p2
p3
反应物转化率
A. 2p1=2p3
c(K+)>c(Al3+ )>c(H+)>c(OH-)
15.下图甲是一种利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成对环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是
A. 铁电极应与Y 相连接
B. H+透过质子交换膜由右向左移动
C. 当N 电极消耗0.25mol 气体时,则铁电极增重16g
D. M 电极反应式:H2NCONH2+H2O-6e-=CO2↑+N2+6H+
16.控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
A. 反应时,电子从乙中石墨电极沿导线流向甲中石墨电极
B. 反应时,甲中石墨电极发生还原反应
C.电流表读数为零时,反应达到化学平衡状态
D. 电流表读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
17.现有室温下四种溶液,有关叙述不正确的是
序号
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH ①>②>④>③
D. V1 L ④与V2 L ①混合,若混合后溶液pH=7,则V1<V2
18.一定条件下,Na2CO3溶液中存在如下平衡:CO+H2OHCO+OH-,下列说法正确的是( )
A. 稀释溶液,平衡正向移动,增大
B. 通入CO2,平衡逆向移动,溶液pH减小
C. 加入NaOH固体,平衡逆向移动,pH减小
D. 升高温度,增大
19.某烃对氢气的相对密度为15,该烃的氯代物最多有
A. 5种 B. 7种 C. 9种 D. 11种
20.在373 K时,把0.5 mol N2O4通入体积为5 L的恒容真空密闭容器中,立即出现红棕色气体。反应进行到2 s时,NO2的浓度为0.02 mol·L-1。在60 s时,体系达到平衡状态,此时容器内的压强为开始时的1.6倍。下列说法错误的是( )
A. 前2 s以N2O4的浓度变化表示的平均反应速率为0.005 mol·L-1·s-1
B. 在2 s时体系内的压强为开始时的1.1倍
C. 平衡时体系内含N2O4 0.2 mol
D. 平衡时,N2O4的转化率为40%
二、综合题
21.化学学科中的平衡理论主要包括: 化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)在体积为3L 的密闭容器中,CO 与H2 在一定条件下反应生成甲醇(图2):CO(g)+2H2(g)CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
(2) 常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH 变化如图1所示。则表示醋酸溶液pH 变化的曲线是_______ (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1____m2 (选填“<”、“=”、“>”)。
(3)生活中明矾常作净水剂,其净水的原理是_______ (用离子方程式表示)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L 的Cr2O72-。为了使废水的排放达标,进行如下处理:
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=_______。{Ksp[Cr(OH) 3] =6.0×10-31}
22.Cu3N具有良好的电学和光学性能,在电子工业领城、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用。
(1)Cu+的核外电子排布式为__________;N元素与O元素的第一电离能比较:N____O(填“>”、“<”或“=”)。
(2)与N3-含有相同电子数的四原子分子的空间构型为____________________。
(3)在Cu催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中醛其()碳原子的杂化方式为_________。
(4)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被C1-取代可生成Cu(H2O)2Cl2,试画出其具有极性的分子的结构式________________。
(5)Cu3N的晶胞结构如图所示,N3-的配位数为________;若晶胞棱长为anm,NA表示阿伏加德罗常数的值,则Cu3N的密度p=______g/cm3 [用含a 和NA 的式子表示,Mr(Cu3N)=206]
参考答案
CCACD DBACC DCDBD DDDCD
21. 减小 B < Al3++3H2OAl(OH)3(胶体)+3H+ pH=6
22. [Ar]3d10或1s22s22p63s23p63d10 > 三角锥形 sp2 6