- 2021-08-23 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习氧化还原反应课件(19张)(全国通用)
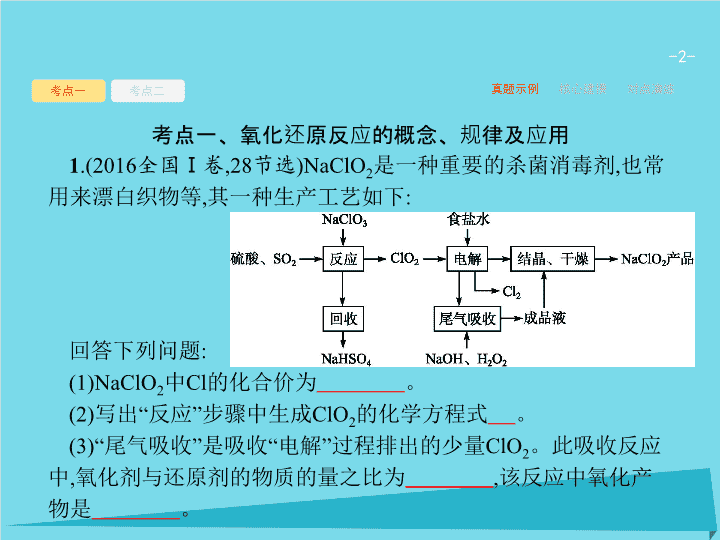
第 3 讲 氧化还原反应 - 2 - 考点一 考点二 真题示例 核心建模 对点演练 考点一、氧化还原反应的概念、规律及应用 1 .(2016 全国 Ⅰ 卷 ,28 节选 )NaClO 2 是一种重要的杀菌消毒剂 , 也常用来漂白织物等 , 其一种生产工艺如下 : 回答下列问题 : (1)NaClO 2 中 Cl 的化合价为 。 (2) 写出 “ 反应 ” 步骤中生成 ClO 2 的化学方程式 。 (3)“ 尾气吸收 ” 是吸收 “ 电解 ” 过程排出的少量 ClO 2 。此吸收反应中 , 氧化剂与还原剂的物质的量之比为 , 该反应中氧化产物是 。 - 3 - 考点一 考点二 真题示例 核心建模 对点演练 答案 : (1)+3 价 (2)2NaClO 3 +SO 2 +H 2 SO 4 ==2ClO 2 +2NaHSO 4 (3)2 ∶ 1 O 2 解析 : (2) 由流程图可知反应物为 H 2 SO 4 、 SO 2 和 NaClO 3 , 产物为 ClO 2 和 NaHSO 4 , 根据氧化还原反应中化合价升降守恒进行配平 , 可得化学方程式为 2NaClO 3 +SO 2 +H 2 SO 4 ==2ClO 2 +2NaHSO 4 。 (3) 根据尾气吸收过程中加入的反应物和生成物 , 写出氧化还原反应方程式并配平 , 可得 :2ClO 2 +2NaOH+H 2 O 2 ==2NaClO 2 +O 2 +2H 2 O 。其中氧化剂为 ClO 2 , 还原剂为 H 2 O 2 , 氧化剂与还原剂的物质的量比值为 2 ∶ 1, 该反应的氧化产物为 O 2 。 - 4 - 考点一 考点二 真题示例 核心建模 对点演练 2 .(1)(2015 全国 Ⅰ 卷 ,28 节选 ) 大量的碘富集在海藻中 , 用水浸取后浓缩 , 再向浓缩液中加 MnO 2 和 H 2 SO 4 , 即可得到 I 2 , 该反应的还原产物为 。 (2)(2015 全国 Ⅱ 卷 ,28 节选 ) 用 ClO 2 处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐 , 下列物质最适宜的是 _______( 填标号 ) 。 A. 明矾 B. 碘化钾 C. 盐酸 D. 硫酸亚铁 MnSO 4 ( 或 Mn 2+ ) D - 5 - 考点一 考点二 真题示例 核心建模 对点演练 1 . 氧化还原反应概念间的关系 - 6 - 考点一 考点二 真题示例 核心建模 对点演练 - 7 - 考点一 考点二 真题示例 核心建模 对点演练 思维模板 利用 “ 规律 ” 解答氧化还原反应问题的模板 (1) 准确判断氧化剂、还原剂 , 氧化产物、还原产物 , 并根据化学方程式确定氧化剂氧化性 ( 或还原剂还原性 ) 的强弱 ; (2) 氧化还原反应遵循 “ 先强后弱 ” 的反应顺序 ; (3) 灵活应用 “ 化合价升降总数相等 ” 、 “ 电荷守恒 ” 进行简单计算。 - 8 - 考点一 考点二 真题示例 核心建模 对点演练 1 .(2017 湖南长沙模拟 ) 实验室常用 NaNO 2 和 NH 4 Cl 反应制取 N 2 。下列有关说法正确的是 ( ) A.NaNO 2 是还原剂 B.NH 4 Cl 中 N 元素被还原 C. 生成 1 mol N 2 时转移 6 mol 电子 D. 氧化剂和还原剂的物质的量之比是 1 ∶ 1 答案 解析 解析 关闭 实验室常用 NaNO 2 和 NH 4 Cl 反应制取 N 2 , 根据氧化还原反应中电子守恒、原子守恒可得化学方程式 :NaNO 2 +NH 4 Cl==N 2 ↑+NaCl+2H 2 O 。在该反应中 NaNO 2 中的 N 元素化合价是 +3 价 , 反应后变为 N 2 中的 0 价 , 化合价降低 , 得到电子 ,NaNO 2 作氧化剂 ,A 错误。在 NH 4 Cl 中 N 元素化合价是 -3 价 , 反应后变为 N 2 中的 0 价 , 化合价升高 , 失去电子 ,NH 4 Cl 中的 N 元素被氧化 ,B 错误。根据化学方程式 NaNO 2 +NH 4 Cl==N 2 ↑+NaCl+2H 2 O 可知 , 每产生 1 mol N 2 转移 3 mol 电子 ,C 错误。根据化学方程式可知 , 在该反应中氧化剂 NaNO 2 和还原剂 NH 4 Cl 的物质的量之比是 1 ∶ 1,D 正确。 答案 解析 关闭 D - 9 - 考点一 考点二 真题示例 核心建模 对点演练 A. 浮选法富集方铅矿的过程发生化学变化 B. 将 1 mol PbS 冶炼成 Pb 理论上至少需要 6 g C C. 整个冶炼过程中 , 制取 1 mol Pb 共转移 2 mol 电子 D. 方铅矿焙烧的反应中 , PbS 是还原剂 , 还原产物只有 PbO 答案 解析 解析 关闭 答案 解析 关闭 - 10 - 考点一 考点二 真题示例 核心建模 对点演练 A. 反应的还原产物是 N 2 B. 消耗 1 mol 氧化剂 , 转移电子 3 mol C. 氧化剂与还原剂的物质的量之比为 2 ∶ 3 D. 反应后溶液的酸性明显增强 D - 11 - 真题示例 核心建模 对点演练 考点一 考点二 - 12 - 真题示例 核心建模 对点演练 考点一 考点二 D 解析 : 根据氧化还原反应得失电子守恒 ( 化合价升降相等 ), 反应中氯元素化合价由 +1 价 →-1 价 ( 化学计量数为 3), 因此 R 元素的化合价由 +3 价升高到 +6 价 ( 化学计量数为 2), 由此判断 D 正确。 ( 另解可以根据电荷守恒快速判断 n =2, 进而确定 R 的化合价为 +6 价 ) 。 - 13 - 1 . 陌生情景下氧化还原反应方程式的书写 第一步 : 根据题干信息或流程图 , 确定反应物和部分生成物。 第二步 : 判断反应中变价元素的化合价并利用元素化合价的升降判断出氧化产物或还原产物。 真题示例 核心建模 对点演练 考点一 考点二 - 14 - 真题示例 核心建模 对点演练 考点一 考点二 2 . 电子守恒的计算流程 分析反应过程 — 找出反应中的氧化剂、还原剂及相应的还原产物和氧化产物 , 并标出变价元素的化合价 ↓ 分析反应过程 — 找准一个原子 ( 或离子 ) 得失电子数目 ( 注意化学式中粒子的个数 ) ↓ 分析反应过程 — 根据题中物质的物质的量和得失电子守恒列出等式关系 : n ( 氧化剂 )× 变价原子个数 × 化合价变化值 = n ( 还原剂 )× 变价原子个数 × 化合价变化值 - 15 - 真题示例 核心建模 对点演练 考点一 考点二 方法技巧 巧解多步连续氧化还原反应的相关计算题 多步连续进行的氧化还原反应 , 只要中间各反应过程中电子没有损耗 , 可直接找出起始物和最终产物 , 删去中间产物 , 建立二者之间的电子守恒关系 , 快速求解。 - 16 - 考点一 考点二 真题示例 核心建模 对点演练 C - 17 - 考点一 考点二 真题示例 核心建模 对点演练 2 .(2017 湖北黄冈模拟 ) 反应 NO+O 2 +NO 2 +H 2 O → HNO 3 ( 未配平 ), 当氧化剂与还原剂的物质的量之比为 1 ∶ 3 时 , 此反应各物质化学计量数之比为 ( ) A.4 ∶ 9 ∶ 24 ∶ 14 ∶ 28 B.1 ∶ 2 ∶ 5 ∶ 3 ∶ 6 C.8 ∶ 9 ∶ 12 ∶ 10 ∶ 20 D.1 ∶ 1 ∶ 1 ∶ 1 ∶ 2 B - 18 - 考点一 考点二 真题示例 核心建模 对点演练 D - 19 - 考点一 考点二 真题示例 核心建模 对点演练 4 .(2017 山东省实验中学模拟 ) 多硫化钠 Na 2 S x (x>2) 在碱性溶液中可被 NaClO 氧化为 , 而 NaClO 被还原为 NaCl , 反应中 Na 2 S x 与 NaClO 的物质的量之比为 1 ∶ 10, 则 x 值为 ( ) A.6 B.5 C.4 D.3 D查看更多