- 2021-08-23 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年福建省漳平市第一中学高一上学期第二次月考试题 化学
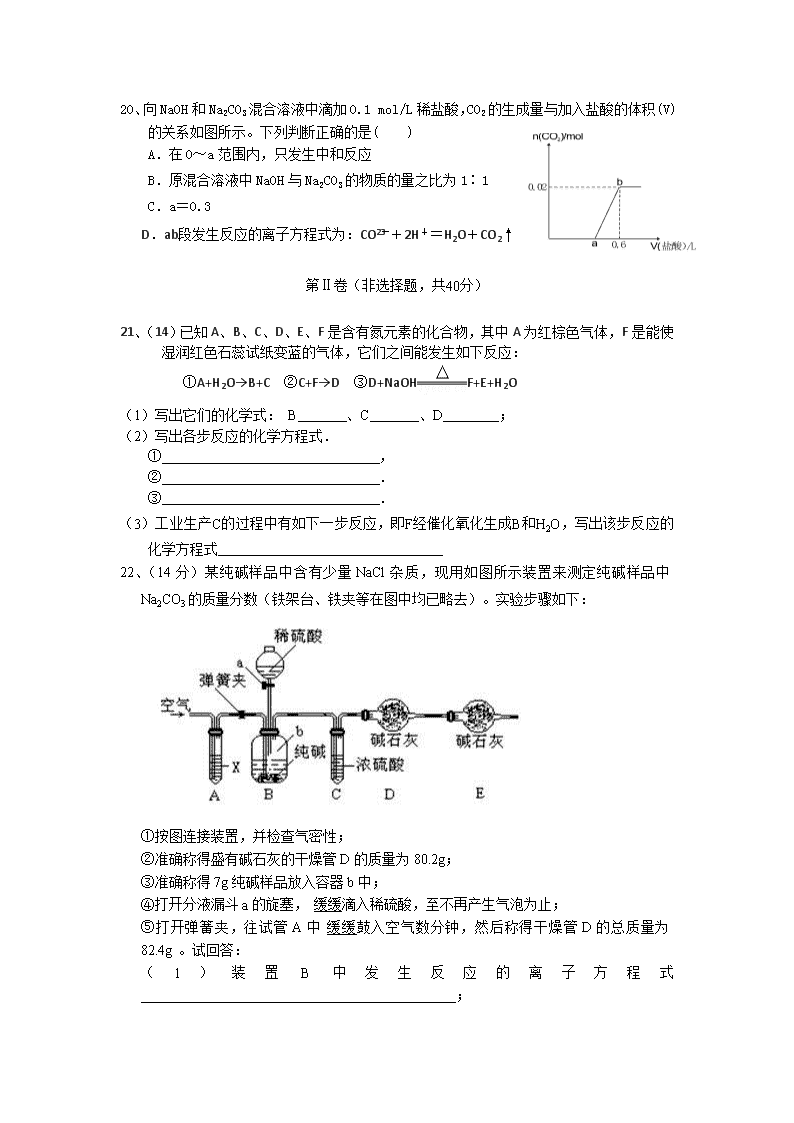
2018-2019学年福建省漳平市第一中学高一上学期第二次月考试题 化学 (考试时间:90分钟 总分:100分) 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分 第Ⅰ卷(选择题,共60分) 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Cu-64 一、选择题(每小题3分,共60分。每小题只有一个选项符合题意) 1、下列各种碳单质的用途中,利用化学性质的是( ) A.石墨用作电极 B.金刚石制作首饰 C.焦碳用于金属的冶炼 D.活性炭用于冰箱除异味 2、下列气体中,既有颜色又有毒性的是( ) A. N2 B. CO C. NO2 D. NH3 3、关于氨气的下列叙述中,正确的是( ) A.氨气因为有刺激性气味,因此不用来作制冷剂 B.氨气具有还原性,可以被氧化为NO C.氨气极易溶于水,因此氨水比较稳定(不容易分解) D.氨气溶于水显弱碱性,因此可使石蕊试剂变为红色 4、下列反应起了氮的固定作用是( ) A.NO与O2反应生成NO2 B.NH3经催化氧化生成NO C.N2和O2在放电下生成NO D.由NH3制碳铵或硫铵 5、下列各组中的两种物质作用时,反应条件(温度、反应物用量、反应物浓度等)改变,不会引起产物改变的是( ) A.Na2O2和CO2 B. NaOH和CO2 C.Na和O2 D.Cu和HNO3 6、设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.6.4g Cu与足量硝酸反应时转移电子的数目一定为0.2NA B.1mol Cl2参加反应时转移的电子数目一定为2NA C.1mol·L-1 KCl溶液中含有的氯离子数目为NA D.22.4L NH3中含有4NA个原子 7、下列物质中,加热不易分解的是( ) A. NaHCO3 B. NH4Cl C. Na2SO4 D. NH4HCO3 8、将过量CO2通入下列溶液中,出现浑浊的是( ) A.CaCl2溶液 B.饱和碳酸钠溶液 C.漂白粉溶液 D.澄清石灰水 9、下列溶液中Cl-的物质的量浓度最大的是( ) A. 200mL 2mol/L MgCl2溶液 B. 1000mL 2.5mol/L NaCl溶液 C. 250mL 1mol/L AlCl3溶液 D. 300mL 5mol/L KCl溶液 10、下列反应中HNO3既表现出酸性又表现出强氧化性的是( ) A. 稀硝酸与CuO反应 B. 稀硝酸与NaOH 溶液反应 C. 浓硝酸与铜反应 D. 浓硝酸与灼热的碳反应 11、下列对硝酸的认识,不正确的是( ) A. 浓硝酸和稀硝酸都具有氧化性 B. 铜与硝酸的反应属于置换反应 C. 金属与硝酸反应不产生氢气 D. 可用铁或铝制品盛装浓硝酸 12、下图所示的实验操作,不能达到相应目的的是( ) 13、实验室制取少量N2,常利用的反应是NaNO2+NH4ClNaCl+N2↑+2H2O,关于该反应的说法不正确的是( ) A.NaNO2是氧化剂 B.生成1 mol N2时转移的电子数为3mol C.NH4Cl中的氮元素被还原 D.N2既是氧化产物又是还原产物 14、下列叙述正确的是( ) A. SO2的漂白原理与次氯酸相同 B. 硫在空气中燃烧生成大量SO3 C. SO2能使紫色石蕊溶液先变红后褪色 D.浓硝酸呈黄色是因为硝酸不稳定,容易分解出NO2气体溶于其中的缘故 15、检验铵盐的方法是取少量待检固体放入试管中然后( ) A.加水溶解,用红色石蕊试纸检验溶液的酸碱性 B.加热,将湿润的红色石蕊试纸放在试管口 C.加入NaOH溶液,加热,将湿润的红色石蕊试纸放靠近试管口 D.加水溶解,测溶液的PH值 16、在酸性溶液中,下列各组离子能大量共存的是 ( ) A.K+、NO3-、OH-、Na+ B.Na+、K+、HCO3-、SO42- C.K+、NO3-、Cl-、Ca2+ D.K+、NO3-、Fe2+、Cl- 17、按照物质不同的分类方法,HNO3应属于( ) ①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸 ⑥混合物 ⑦一元酸 ⑧化合物. A. ①②③④⑤⑦⑧ B. ①④⑦⑧ C. ①⑥ D. ①④⑤⑦⑧ 18、氨的喷泉实验中,充满氨的烧瓶被水充满时,瓶内氨水的浓度为(标准状况)( ) A.0.029 mol·L-1 B.0.45 mol·L-1 C.0.045 mol·L-1 D.1 mol·L-1 19、下列气体,可以用排水法收集的是( ) A. NO B. NH3 C. HCl D. Cl2 20、向NaOH和Na2CO3混合溶液中滴加0.1 mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( ) A.在0~a范围内,只发生中和反应 B.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶1 C.a=0.3 D.ab段发生反应的离子方程式为:CO+2H+=H2O+CO2↑ 第Ⅱ卷(非选择题,共40分) 21、(14)已知A、B、C、D、E、F是含有氮元素的化合物,其中A为红棕色气体,F是能使湿润红色石蕊试纸变蓝的气体,它们之间能发生如下反应: ①A+H2O→B+C ②C+F→D ③D+NaOHF+E+H2O (1)写出它们的化学式: B 、C 、D ; (2)写出各步反应的化学方程式. ① , ② . ③ . (3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O,写出该步反应的化学方程式 22、(14分)某纯碱样品中含有少量NaCl杂质,现用如图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下: ①按图连接装置,并检查气密性; ②准确称得盛有碱石灰的干燥管D的质量为80.2g; ③准确称得7g纯碱样品放入容器b中; ④打开分液漏斗a的旋塞, 缓缓滴入稀硫酸,至不再产生气泡为止; ⑤打开弹簧夹,往试管A中 缓缓鼓入空气数分钟,然后称得干燥管D的总质量为82.4g 。试回答: (1)装置B中发生反应的离子方程式_____________________________________________; (2)鼓入空气的目的是_______________________________________________________, (3)装置A中试剂X应选用( ) A 、NaOH B、浓H2SO4 C、NaHCO3 D、NaCl (4)若没有C装置,则会导致测定结果______(“偏大”或“偏小”“不变”) (5)如果将分液漏斗中的硫酸换成浓度相同的盐酸,则会导致测定结果______(“偏大”或“偏小”“不变”) (6)E装置的作用是___________________________; (7)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为______________。(结果保留一位小数)。 23.(12分) (1)实验室常用下图所示装置制取并收集氨气。 ①实验室制取氨气反应的化学方程式为 ; ②图中方框内收集氨气的装置可选用 (填字母序号); ③尾气处理装置中使用倒扣漏斗的作用是 。 (2)在盛有一定量浓硝酸的试管中加入6.4g的铜片发生反应。请回答下列问题: ①开始阶段,反应的化学方程式为 ,若该反应共产生标准状况下气体2.24L,则反应过程中被还原的HNO3的物质的量为 。 ②反应结束后铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式为 。 漳平一中2018—2019学年第一学期第二次月考 高一化学试题答案 一、 选择题(每小题3分,共60分。每小题只有一个选项符合题意) 1 2 3 4 5 6 7 8 9 10 C C B C A A C B D C 11 12 13 14 15 16 17 18 19 20 B D C D C C B C A B 第Ⅱ卷(非选择题,共40分) 21、(14分)(1)NO;HNO3;NH4NO3; (2)①3NO2+H2O=2HNO3+NO; ②HNO3+NH3=NH4NO3; ③NH4NO3+NaOH=NaNO3+NH3+H2O(条件:加热); (3)4NH3+5O24NO+6H2O. 22、(14分) (1)CO32-+2H+═H2O+CO2↑; (2)将装置内残留的二氧化碳全部排出,达到精确测量的目的, (3)A (4)偏大 (5)偏大 (6)防止空气中CO2和水蒸气进入D的干燥管中; (7)75.7% 23.(12分) (1) ① 2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O; ②C; ③防止烧杯中的水倒吸。 (2) ①Cu+4HNO3(浓)=Cu(NO)3+2NO2↑+2H2O 0.1mol ②3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。 查看更多