- 2021-08-23 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高中化学 期末君之讲稿(五)铝及其重要化合物学案(无答案)新人教版
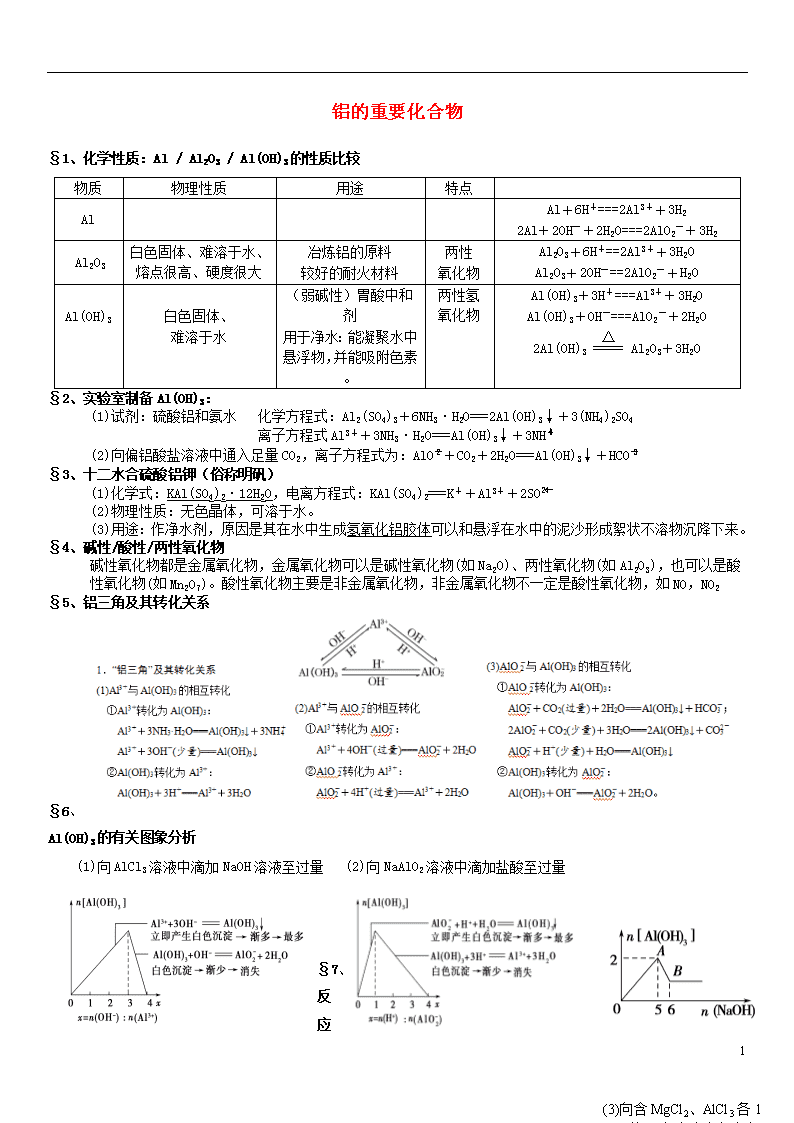
铝的重要化合物 §1、化学性质:Al / Al2O3 / Al(OH)3的性质比较 物质 物理性质 用途 特点 Al Al+6H+===2Al3++3H2 2Al+2OH-+2H2O===2AlO2-+3H2 Al2O3 白色固体、难溶于水、熔点很高、硬度很大 冶炼铝的原料 较好的耐火材料 两性 氧化物 Al2O3+6H+==2Al3++3H2O Al2O3+2OH-==2AlO2-+H2O Al(OH)3 白色固体、 难溶于水 (弱碱性)胃酸中和剂 用于净水:能凝聚水中悬浮物,并能吸附色素。 两性氢氧化物 Al(OH)3+3H+===Al3++3H2O Al(OH)3+OH-===AlO2-+2H2O 2Al(OH)3Al2O3+3H2O §2、实验室制备Al(OH)3: (1)试剂:硫酸铝和氨水 化学方程式:Al2(SO4)3+6NH3·H2O===2Al(OH)3↓+3(NH4)2SO4 离子方程式Al3++3NH3·H2O===Al(OH)3↓+3NH (2)向偏铝酸盐溶液中通入足量CO2,离子方程式为:AlO+CO2+2H2O===Al(OH)3↓+HCO §3、十二水合硫酸铝钾(俗称明矾) (1)化学式:KAl(SO4)2·12H2O,电离方程式:KAl(SO4)2===K++Al3++2SO (2)物理性质:无色晶体,可溶于水。 (3)用途:作净水剂,原因是其在水中生成氢氧化铝胶体可以和悬浮在水中的泥沙形成絮状不溶物沉降下来。 §4、碱性/酸性/两性氧化物 碱性氧化物都是金属氧化物,金属氧化物可以是碱性氧化物(如Na2O)、两性氧化物(如Al2O3),也可以是酸 性氧化物(如Mn2O7)。酸性氧化物主要是非金属氧化物,非金属氧化物不一定是酸性氧化物,如NO,NO2 §5、铝三角及其转化关系 (3)向含MgCl2、AlCl3各1 mol的混合溶液中加入氢氧化钠溶液至过量 §6、Al(OH)3的有关图象分析 (1)向AlCl3溶液中滴加NaOH溶液至过量 (2)向NaAlO2溶液中滴加盐酸至过量 §7、 10 反应过程中铝元素存在的形式分析 (1)向1 L 1 mol·L-1的AlCl3溶液中滴加NaOH溶液 (2)向1 L 1 mol·L-1的NaAlO2溶液中滴加稀盐酸 §8、重点题型过关 知识点一 Al(OH)3沉淀量的计算 (1).(多选)若100 mL 0.1 mol/L硫酸铝溶液与氢氧化钠溶液反应,得到1.17 g沉淀,则需0.5 mol/L的NaOH 溶液体积为( ) A.130 mL B.100 mL C.90 mL D.50 mL (2).(双选)向50 mL 1 mol·L-1的Al2(SO4)3溶液中加入100 mL KOH溶液,充分反应得到3.9 g沉淀,则KOH溶液的物质的量浓度可能是( ) A.1 mol·L-1 B.3 mol·L-1 C.1.5 mol·L-1 D.3.5 mol·L-1 (3).在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH 体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( ) A. 2∶1 B. 1∶2 C. 1∶1 D. 1∶3 (4).向100 mL 0.1 mol·L-1的AlCl3溶液中加入1 mol·L-1的NaOH溶液V mL后,再滴 加1 mol·L-1盐酸。生成沉淀的质量与滴加盐酸体积的关系如图所示,则加入的 NaOH溶液的体积为( ) A.10 mL B.30 mL C.40 mL D.50 mL (5).将一小块铝片加入某盐酸中,铝片完全溶解,在所得溶液中继续滴加NaOH溶液。 生成Al(OH)3的量与加入NaOH溶液体积的变化关系如图,下列说法正确的是( ) A.盐酸与铝片反应后,盐酸还有剩余 B.图中B点之前发生的离子反应为Al3++3OH-===Al(OH)3↓ C.A→B段消耗的NaOH溶液的体积与B→C段消耗的NaOH溶液的体积比≥3∶1 D.溶解铝片的盐酸浓度与滴加的NaOH溶液浓度相等 知识点二 铝的化合物之间的转化关系 (6).将AlCl3溶液和NaOH溶液等体积混合,所得沉淀物中铝元素的质量是所得溶液中铝元素的质量的2倍,则 原AlCl3溶液和NaOH溶液的物质的量浓度之比可能是( ) ①2:3 ②1:2 ③3:10 ④2:7 A. ①② B.②③ C.①④ D.③④ 【跟踪训练】 1.化学在生产和日常生活中有着重要的应用,下列说法不正确的是( ) A.Al2O3用作耐火材料 B.Na2O2常用于潜水艇或呼吸面具的供氧剂 C.明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 D.Al(OH)3既溶于NaOH溶液、氨水,又能溶于盐酸 2.铝是一种低毒金属元素,它并非人体需要的微量元素,不会导致急性中毒,但食品中铝的含量超过国家标准就 会对人体造成危害。下列关于铝元素的说法正确的是( ) A.铝在空气中不易被氧化是因为铝的性质不活泼 B.氢氧化铝可与胃酸反应,常用作中和胃酸的药物 C.明矾可用于饮用水的杀菌消毒 D.硫酸铝铵不溶于水 3.下列有关说法中不正确的是( ) A.Al(OH)3在用于治疗胃酸过多类疾病时表现出弱碱性 B.明矾溶于水后可得到少量的有强吸附性的Al(OH)3,故明矾可作净水剂 C.Al(OH)3可用于中和馒头制作过程(如发酵阶段)中产生的酸 D.Al2O3可用于制作耐火材料而Al(OH)3不能 E. 擦去表面氧化膜的铝条,在酒精灯上灼烧时,熔化的铝不会滴落下来 4.已知NaOH+Al(OH)3→Na[Al(OH)4]。向集满CO2 10 的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是( ) A.CO2+2OH− ===CO32- +H2O B.Al2O3+2OH−+3H2O===2[Al(OH)4]− C.2Al+2OH−+6H2O === 2[Al(OH)4]−+3H2↑ D.Al3++4OH−=== [Al(OH)4]− 5.氧化铝的熔点很高,常用于制造耐火材料,例如制作耐火坩埚。下列操作不能在氧化铝坩埚中进行的是( ) A.加热使CuSO4·5H2O失水 B.加热使KMnO4分解 C.加热熔化烧碱 D.加热分解碱式碳酸铜 6.把Fe2O3中混有的少量Al2O3除去,应选用的试剂是( ) A.稀硝酸 B.硫酸铜溶液 C.烧碱溶液 D.稀盐酸 7.用含有少量镁的铝片制取纯净的Al(OH)3,可能有的步骤为①加盐酸溶解;②加过量苛性钠溶液;③过滤;④通 入过量CO2;⑤加过量纯碱溶液,实验操作最合理的组合及顺序是( ) A. ①⑤④③ B.②③④③ C.②③⑤③ D.①⑤③ 8.只用试管和胶头滴管而不用其他试剂无法区别的一组溶液是( ) A.KOH溶液和AlCl3溶液 B.Na2CO3溶液和盐酸 C.AlCl3溶液和氨水 D.盐酸和NaAlO2溶液 9.下列物质①Al ②NaHCO3 ③Al2O3 ④Mg(OH)2 ⑤Al(OH)3中,既能与盐酸反应又能与氢氧化钠溶液反应的 化合物是( ) A.①②③⑤ B.①④⑤ C.②③⑤ D.①③④ 10.有200 mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为( ) A.40 mL B.72 mL C.80 mL D.128 mL 11.相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( ) A.Al B.Al(OH)3 C.AlCl3 D.Al2O3 12.把一定量的Ba(OH)2溶液滴入明矾[KAl(SO4)2·12H2O]溶液中,使SO全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( ) A.Al3+ B.Al(OH)3 C.AlO D.Al3+和Al(OH)3 13.下列反应的离子方程式书写正确的是( ) A.铝片放入氢氧化钠溶液中:Al+2OH-===AlO+H2↑ B.新制的氧化铝溶于氢氧化钠溶液:Al2O3+OH-===2AlO+H2O C.向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-===Al(OH)3↓ D.AlCl3溶液中滴入过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH 14.如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒数量的关系曲线。判断下列说法不 正确的是( ) A.A线表示Al3+的物质的量的变化 B.x表示NaOH的物质的量 C.C线表示Al(OH)3的物质的量的变化 D.D线表示Al(OH)3的物质的量的变化 15.把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水后有0.58 g白色沉淀生成, 在所得悬浊液中逐滴加入0.5 mol/L的盐酸,加入盐酸的体积与生成沉淀的质量关系如 下图所示: (1)原混合物中NaOH、AlCl3、MgCl2的质量分别是多少? (2)C点所表示的盐酸的体积是多少? 16.有一块镁铝合金,其中镁与铝的质量比是8∶9, 加入足量稀硫酸使其完全溶解后,再加入NaOH 溶液,生成沉淀的质量随NaOH溶液体积变化的 曲线如下图,其中正确的是( ) 17、常见的纯净物A、B、C、X,它们之间有如图转化关系(副产物已略去)。 · 试回答:· (1)若X是强氧化性单质,则A不可能是________。a.S b.N2 c.Na d.Mg e.Al· (2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为________;C溶液在储存时应加入少量X,理由是_________________(用必要的文字和离子方程式表示)。 (3)若A、B、C为含金属元素的无机化合物,X为强电解质溶液,A溶液与C溶液反应生成B,则B的化学 式为________ ,X的化学式可能为________ 或________(写出不同类物质),反应①的离子方程式为 10 或 。 【提升训练】 18.下列物质的稀溶液相互反应,无论是前者滴入后者中,还是后者滴入前者中,反应现象都相同的是( ) A.Na2CO3和盐酸 B.AlCl3和NaOH C.NaAlO2和硫酸 D.Na2CO3和BaCl2 19.有Mg、Al混合粉末10.2 g,将它溶于500 mL 4 mol/L的盐酸里,若要使沉淀质量达到最大,则需加入2mol·L-1氢氧化钠溶液的体积为( ) A.1000 mL B.500 mL C.100 mL D.1 500 mL 20.将一定质量的Mg和Al混合物投入400 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液 中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。 计算: (1)Mg和Al的总质量为________g; (2)硫酸的物质的量浓度为________; (3)生成H2的物质的量为________。 21.某实验小组对一含有Al3+的未知溶液进行了如下分析: (1)滴加少量NaOH溶液,无明显变化;(2)继续滴加NaOH溶液,有白色胶状沉 淀生成;(3)滴加过量的NaOH溶液,白色胶状沉淀明显减少。实验小 组经定量分析,得出如图所示沉淀的物质的量与滴加NaOH溶液体积的关 系。下列说法错误的是( ) A.该未知溶液中至少含有3种阳离子 B.NaOH溶液的物质的量浓度为5 mol·L-1 C.若另一种离子为二价阳离子,则a=10 D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g 22、如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对 应的曲线错误的是( ) A. 曲线A是向NaAlO2溶液中滴入盐酸至过量 B. 曲线B是向澄清石灰水中通入CO2至过量 C. 曲线C是向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 D. 曲线D是向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失 23、 镁铝合金5.1g溶于300mL 2mol•L-1盐酸中,标准状况下放出气体体积为5.6L,向反应后的溶液中加入500mL NaOH溶液充分反应,最终产生白色沉淀.下列有关说法不正确的是( ) A. 5.1 g镁铝合金中含有镁、铝的质量分别为2.4 g、2.7 g B. 溶解5.1 g镁铝合金时,剩余盐酸的物质的量为0.1 mol C. 生成白色沉淀的最大质量为13.6 g D. 若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2 mol•L-1 24、 新型镁铝合金(Mg17Al12)有储氢性能,它一定条件下完全吸氢的反应为:Mg17Al12+17H2═17MgH2+12Al,得到的 混合物Y(17MgH2+12Al)能与酸反应释放出大量氢气。下列说法正确的是( ) A. 该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成 B. 该合金中含有离子键,铝元素呈正价 D. 合金的熔点高于金属镁、金属铝的熔点 C. 1mol Mg17Al12完全吸氢后得到的Y与盐酸完全反应放出H2在标准状况下的体积为1164.8 L 25、甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示。下列说法正确的是( ) A. 若甲是Al,丙是Al(NO3)3, 则乙一定是NaAlO2 B. 若甲是Al2O3,丙是NaAlO2, 则乙一定是Al(NO3)3 C. 若甲是Al(NO3)3, 丙是NaAlO2, 则乙一定是Al(OH)3 D. 若甲是Al(OH)3, 丙是Al(NO3)3, 则乙一定是NaAlO2 26、在含有0.6mol Cl−、0.8mol SO42−及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图。若反应前Al3+的物质的量为a mo,Al3+的物质的量与混合溶液中离子总物质的量的比值为x,则下列正确的是( ) A. x=3a /(5−a) B. x的取值范围是0查看更多
相关文章
- 当前文档收益归属上传用户