- 2021-08-23 发布 |
- 37.5 KB |
- 10页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年甘肃省庆阳二中高二第一次月考化学(理)试题
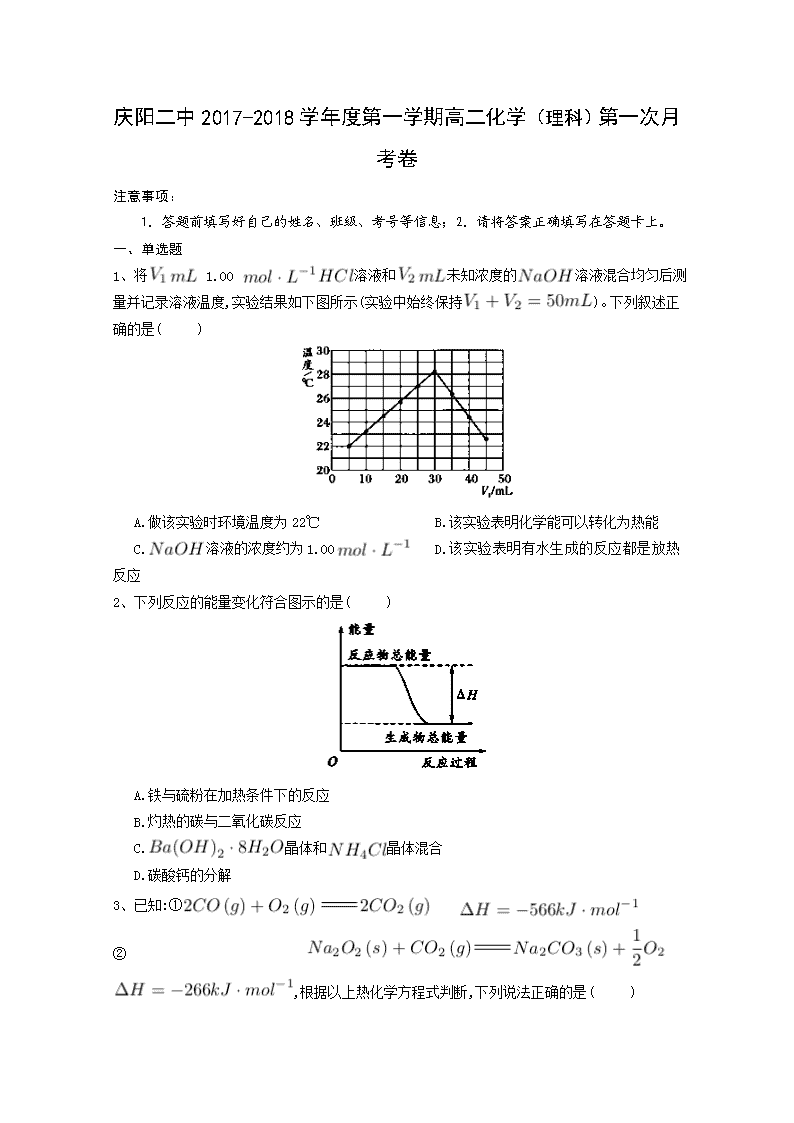
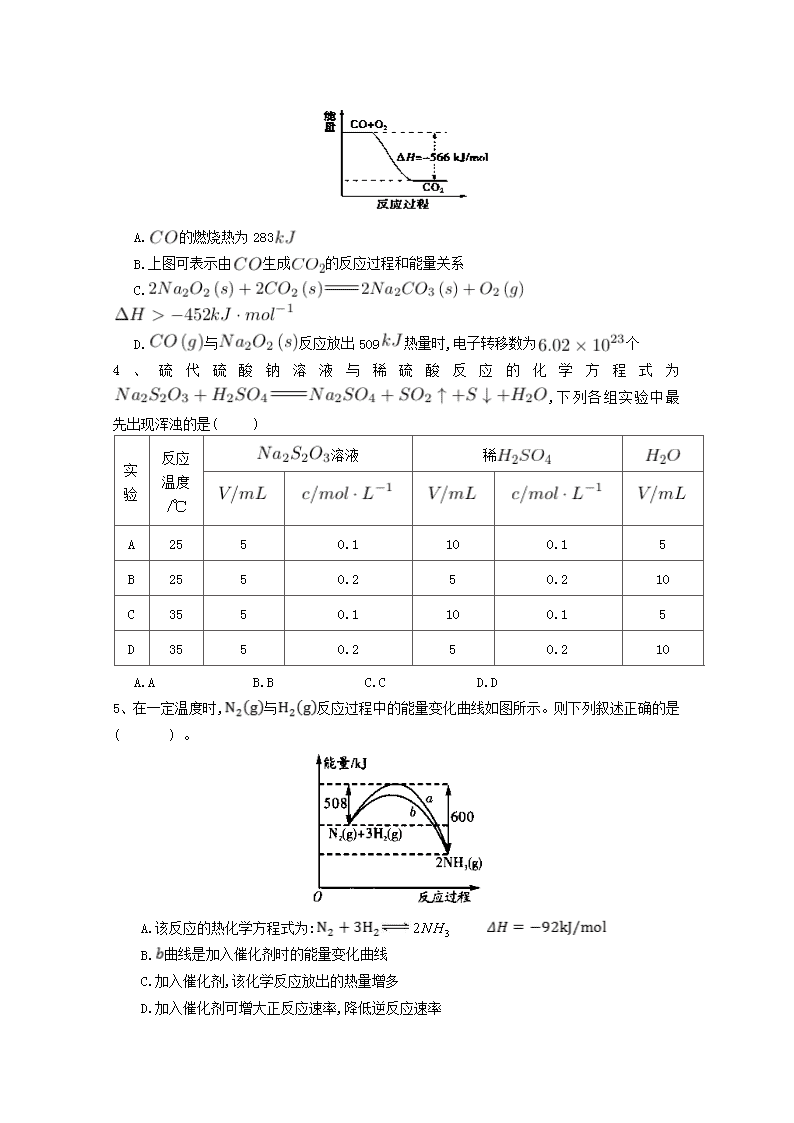
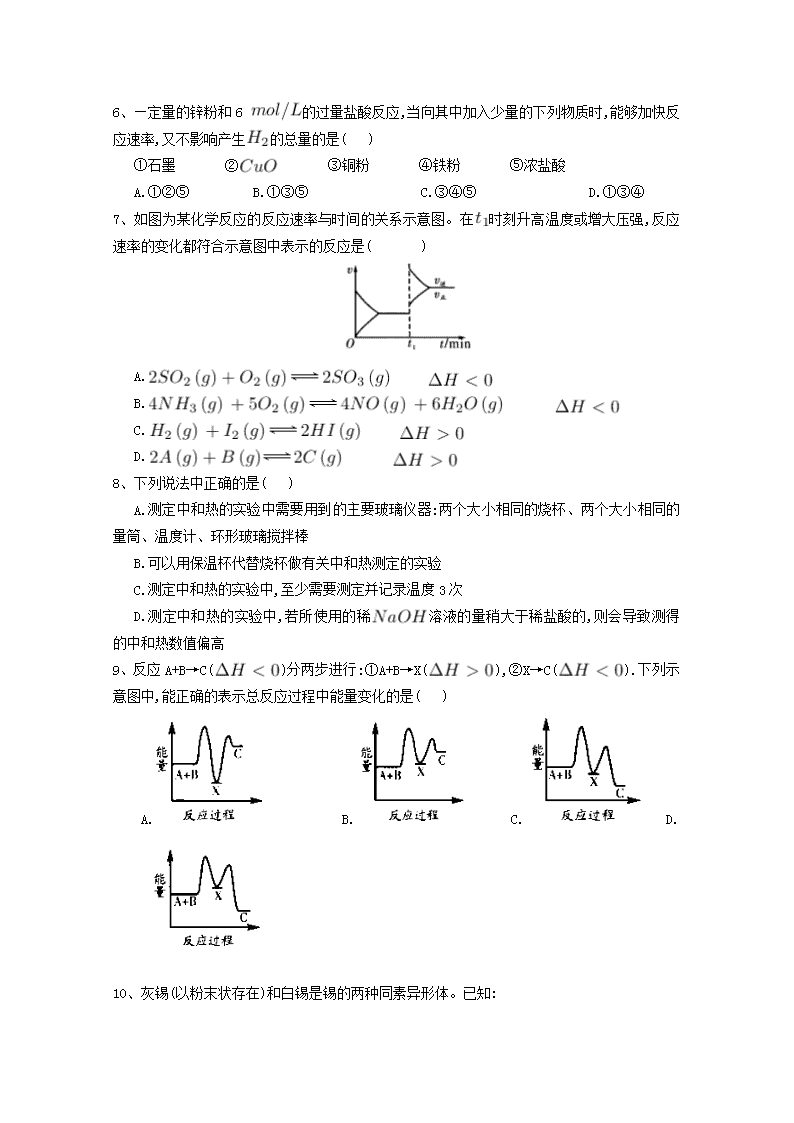
庆阳二中2017-2018学年度第一学期高二化学(理科)第一次月考卷 注意事项: 1.答题前填写好自己的姓名、班级、考号等信息;2.请将答案正确填写在答题卡上。 一、单选题 1、将 1.00 溶液和未知浓度的溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持)。下列叙述正确的是( ) A.做该实验时环境温度为22℃ B.该实验表明化学能可以转化为热能 C.溶液的浓度约为1.00 D.该实验表明有水生成的反应都是放热反应 2、下列反应的能量变化符合图示的是( ) A.铁与硫粉在加热条件下的反应 B.灼热的碳与二氧化碳反应 C.晶体和晶体混合 D.碳酸钙的分解 3、已知:① ② ,根据以上热化学方程式判断,下列说法正确的是( ) A.的燃烧热为283 B.上图可表示由生成的反应过程和能量关系 C. D.与反应放出509热量时,电子转移数为个 4、硫代硫酸钠溶液与稀硫酸反应的化学方程式为,下列各组实验中最先出现浑浊的是( ) 实验 反应温度/℃ 溶液 稀 A 25 5 0.1 10 0.1 5 B 25 5 0.2 5 0.2 10 C 35 5 0.1 10 0.1 5 D 35 5 0.2 5 0.2 10 A.A B.B C.C D.D 5、在一定温度时,与反应过程中的能量变化曲线如图所示。 则下列叙述正确的是( ) 。 A.该反应的热化学方程式为: B.曲线是加入催化剂时的能量变化曲线 C.加入催化剂,该化学反应放出的热量增多 D.加入催化剂可增大正反应速率,降低逆反应速率 6、—定量的锌粉和6 的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生的总量的是( ) ①石墨 ② ③铜粉 ④铁粉 ⑤浓盐酸 A.①②⑤ B.①③⑤ C.③④⑤ D.①③④ 7、如图为某化学反应的反应速率与时间的关系示意图。在时刻升高温度或增大压强,反应速率的变化都符合示意图中表示的反应是( ) A. B. C. D. 8、下列说法中正确的是( ) A.测定中和热的实验中需要用到的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒 B.可以用保温杯代替烧杯做有关中和热测定的实验 C.测定中和热的实验中,至少需要测定并记录温度3次 D.测定中和热的实验中,若所使用的稀溶液的量稍大于稀盐酸的,则会导致测得的中和热数值偏高 9、反应A+B→C()分两步进行:①A+B→X(),②X→C().下列示意图中,能正确的表示总反应过程中能量变化的是( ) A. B. C. D. 10、灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知: ①(,白) ; ②(,灰) ; ③(,灰)(,白) 。 下列说法正确的是( ) A. B.锡在常温下以灰锡状态存在 C.灰锡转化为白锡的反应是放热反应 D.锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏 11、反应在一可变容积的密闭容器中进行,下列条件的改变能够引起反应速率增大的是( ) A.增加的质量 B.将容器的体积缩小一半 C.保持体积不变,充入氦气使体系压强增大 D.保持压强不变,充入氮气使容器体积增大 12、心脏起搏器电源——锂碘电池的电池反应为: 已知: 则下列说法正确的是 ( ) A. B. C. D. 13、下列有关活化分子的说法正确的是( )。 A.增大反应物浓度可以提高活化分子百分数 B.增大体系的压强一定能提高活化分子百分数 C.使用合适的催化剂可以增大活化分子的能量 D.升高温度能提高活化分子百分数 14、增大压强,能使下列反应速率增大的是( )。 A.溶液与溶液反应 B.和水蒸气在一定条件下反应生成和 C.将加人石灰水中 D.溶于水中 15、下列说法不正确的是( )。 A.在化学反应过程中 , 发生物质变化的同时一定发生能量变化 B.在指定状态下各物质的焓值都是确定且是唯一的 C.反应产物的总焓大于反应物的总焓时 ,反应吸热, D.当同一个化学反应以不同的过程完成时,反应的焓变是不同的 16、已知反应: ① 101时, ②稀溶液中, 。 下列结论正确的是( ) A.反应①的反应热为221 B.碳的燃烧热为 C.稀硫酸与稀溶液反应的中和热为 D.稀醋酸与稀溶液反应生成1水,放出57. 3热量 17、强酸与强碱的稀溶液发生中和反应的热效应: ,分别向1 0.5的溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时的热效应分别为、、,它们的关系表示正确的是( ) A. B. C. D. 18、工业合成氨是农业用氮肥的主要来源。合成氨的原料气之一可由甲烷制得,反应的化学方程式为。下面是一组化学反应的能量变化图: 下列热化学方程式正确的是( ) A. B. C. D. 19、下列说法正确的是( ) A.在25℃、101,1 和2 的燃烧热相等 B.1 (浓)与1 完全中和所放出的热量为中和热 C.是不稳定的氧化物,它能继续和氧气反应生成稳定的,所以的燃烧反应一定是吸热反应 D.101时,1 燃烧所放出的热量为氢气的燃烧热 20、将等质量的、 分别投入到等浓度的足量稀盐酸中,在相同条件下产生氢气的体积随时间变化的曲线分别用、表示,则下列图像正确的是( ) A. B. C. D. 21、已知20°C时,将50.1的溶液和等体积、等浓度的稀混合,9后溶液中明显出现浑浊;50°C时,同样的反应要明显看到浑浊,仅需20的时间。则温度每升高10°C,反应速率增大为原来的( ) A.1.5 倍 B.2 倍 C.3 倍 D.5 倍 二、填空题 22、已知: ,反应过程中的能量变化如下图所示,回答下列问题: 1. 、、分别代表什么意义? ; ; 。 2.该反应是放热反应还是吸热反应? 。 大于零还是小于零? 3.若已知 则 (填“>”、“<"、“=”,下同) , 。 23、依据事实,写出下列反应的热化学方程式。 1.在、下,甲醇燃烧生成和液态水时放热。则表示甲醇燃烧热的热化学方程式为 2.若适量的和完全反应,每生成需要吸收的热量。则和完全反应生成的热化学方程式为: 3.已知拆开键,键,键分别需要的能量是、、,则与 反应生成的热化学方程式为 。 24、向含有H2SO4的H2O2溶液中滴加定量的KMnO4溶液,反应开始时,溶液中Mn2+的浓度c 将随时间的变化而变化。某学生在做实验前认为,Mn2+的浓度c与时间t的关系如下图中①,做完实验后,得到的结果为下图中②,请说明下列问题: 1.写出H2O2与KMnO4反应的化学方程式: 2.②图中Oa段的意义: 3.②图中ab段的意义及ab段很陡的原因: 4.bc段的意义。 25、在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生有合适取向的碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ • mol-1表示。请认真观察下图,然后回答问题。 1.图中所示反应是 (填“吸热”或“放热”)反应,该反应填 (“需要”“不需要”)加热,该反应的= (用含、的代数式表示)。 2.对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是 。 26、某化学兴趣小组设计实验探究反应速率的测定和比较。 [实验步骤] (1)取一套装置(装置如下图所示),加入401的硫酸,测量收集10 所需的时间。 (2)取另一套装置,加入40 4的硫酸,测量收集10 所需的时间。 1.[实验现象]锌跟硫酸反应 ;收集10气体,(2)所用时间比(1)所用时间 。 2.[实验结论]4硫酸与锌反应比1硫酸与锌反应速率 。 3.[注意事项] (1)锌粒的颗粒(即表面积)大小 ; (2)40硫酸要迅速加入; (3)装置 ,且计时要迅速、准确; (4)气体收集可以用排水量气装置代替。 4.[实验讨论]除本实验测定反应速率的方法外,可行的方案还有: (1) (2) (3) 高二理科化学参考答案 一、单选题 1. B 2. A 3. C 4. D 5. B 6. B 7. B 8. B 9. D 10. D 11. B 12. C 13. D 14.B 15. D 16. C 17. D 18. C 19. A 20. B 21. C 二、填空题 22. 1.代表旧键断裂吸收的能量; 代表新键形成放出的能量; 代表反应热 2.放热反应; 小于零; 3.>; 23. 1. 2. 3. 24. 1.5H2O2+2KMnO4+3H2SO4K2SO4+2MnSO4+8H2O+5O2↑。 2.Oa段说明反应非常慢,溶液中c(Mn2+)随时间变化很小. 3.ab段说明反应非常快,c(Mn2+)迅速增大,表明Mn2+达到一定浓度时,对上述反应起到了催化作用。 4.bc段说明反应趋于完全,最终溶液中c(Mn2+)为定值。 25. 1.放热; 需要; -(E1-E2)kJ•mol-1[(E2-E1)kJ•mol-1]2.使用了催化剂 26. 1.产生气泡; 短 ; 2.大; 3.基本相同; 气密性良好; 4.(1)测定一段时间内产生的体积 (2)测定一段时间内的农度变化 (3)测定一段时间内辞粒质量的变化查看更多