- 2021-08-23 发布 |
- 37.5 KB |
- 33页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习元素周期表、元素周期律课件(33张)(全国通用)
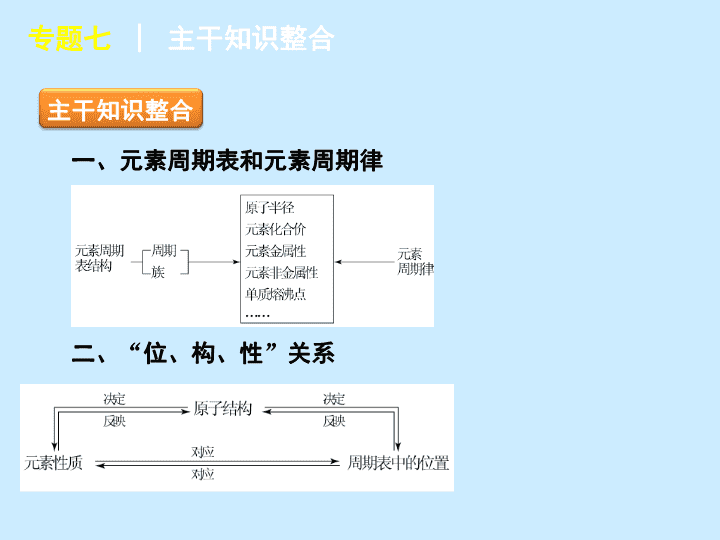
专题七 元素周期表、元素周期律 专题七 元素周期表、元素周期律 主干知识整合 专题七 │ 主干知识整合 一、元素周期表和元素周期律 二、 “ 位、构、性 ” 关系 要点热点探究 专题七 │ 要点热点探究 ► 探究点一 元素周期表的结构 1 .记住元素周期表的 18 个纵行及对应的族 专题七 │ 要点热点探究 2 .记住元素周期表的边界 专题七 │ 要点热点探究 3 .记住元素周期表的一些特点 (1) 短周期元素只有前三周期; (2) 主族中只有 Ⅱ A 族元素全部为金属元素; (3) Ⅰ A 族元素不等同于碱金属元素, H 元素不属于碱金属元素; (4) 元素周期表第 18 列是 0 族,不是 Ⅷ A 族,第 8 、 9 、 10 列是 Ⅷ 族,不是 Ⅷ B 族; (5) 长周期不一定是 18 种元素,第六周期有 32 种元素。 专题七 │ 要点热点探究 例 1 短周期元素 X 、 Y 、 Z 、 W 、 Q 在元素周期表中的相对位置如图 7 - 1 所示。下列说法正确的是 ( ) A .元素 X 与元素 Z 的最高正化合价 之和的数值等于 8 B .原子半径的大小顺序为: r X > r Y > r Z > r W > r Q C .离子 Y 2 - 和 Z 3 + 的核外 电子数和电子层数都不相同 D .元素 W 的最高价氧化物对应的水化物的酸性比 Q 的强 专题七 │ 要点热点探究 A 【 解析 】 由元素的相对位置关系可推得: X 为 N , Y 为 O , Z 为 Al , W 为 S , Q 为 Cl 。主族元素的最高正价等于最外层电子数, N 为+ 5 价, Z 为+ 3 价,两者之和为 8 , A 对;电子层数越多,原子半径越大,同一周期元素从左到右原子半径逐渐减小,故原子半径大小顺序为: r Z > r W > r Q > r X > r Y , B 错; O 2 - 和 Al 3 + 的离子结构示意图与 Ne 相同,核外电子数和电子层数均相同, C 错;非金属性 S < Cl ,则酸性 H 2 SO 4 < HClO 4 , D 错。 专题七 │ 要点热点探究 【 点评 】 残缺元素周期表类的元素推断往往为给出元素周期表中短周期元素的一部分,根据文字信息或者周期表结构中“隐藏”的信息进行推断,如第一周期只有两端有元素、某元素上方有相邻元素,则必为第三周期元素或 Li 或 Ne 等。 专题七 │ 要点热点探究 变式题 如图 7 - 2 为周期表中短周期的一部分,若 X 原子最外层电子数比次外层电子数少 3 ,则下列说法正确的是 ( ) A . X 的氢化物比 R 的氢化物稳定 B .原子半径大小顺序是 Z>Y>X C . Y 、 R 形成的化合物 YR 2 能使 KMnO 4 溶液褪色 D . X 、 Z 可形成化合物 XZ 5 ,分子中各原子均满足最外层 8 电子结构 专题七 │ 要点热点探究 C 【 解析 】 X 原子最外层电子数比次外层电子数少 3 ,则 X 为 P 元素,依此可推出 Y 、 Z 、 R 分别为 S 、 Cl 、 O 元素。 专题七 │ 要点热点探究 ► 探究点二 元素周期表中的规律 1 .电子排布规律 (1) 最外层电子数为 1 或 2 的原子可以是 Ⅰ A 族、 Ⅱ A 族或副族元素的原子;最外层电子数是 3 ~ 8 的原子一定是主族元素的原子,且最外层电子数等于主族的族序数。 2 .短周期元素原子结构的特殊性 (1) 原子核中无中子的原子: H 。 (2) 最外层只有一个电子的元素: H 、 Li 、 Na 。 (3) 最外层有两个电子的元素: Be 、 Mg 、 He 。 (4) 最外层电子数等于次外层电子数的元素: Be 、 Ar 。 专题七 │ 要点热点探究 (5) 最外层电子数是次外层电子数 2 倍的元素: C ;三倍的是 O ;四倍的是 Ne 。 (6) 电子层数与最外层电子数相等的元素: H 、 Be 、 Al 。 (7) 电子总数为最外层电子数 2 倍的元素: Be 。 (8) 次外层电子数是最外层电子数 2 倍的元素: Li 、 Si 。 (9) 内层电子数是最外层电子数 2 倍的元素: Li 、 P 。 3 .序数差规律 (1) 同周期相邻主族元素原子的 “ 序数差 ” 规律 ① 除第 Ⅱ A 族和第 Ⅲ A 族外,其余同周期相邻元素序数差为 1 。 ② 同周期第 Ⅱ A 族和第 Ⅲ A 族为相邻元素,其原子序数差为:第二、三周期时相差 1 ,第四、五周期时相差 11 ,第六、七周期时相差 25 。 专题七 │ 要点热点探究 (2) 同主族相邻元素的 “ 序数差 ” 规律 ① 第二、三周期的同族元素原子序数相差 8 。 ② 、第三、四周期的同族元素原子序数相差有两种情况:第 Ⅰ A 族、 Ⅱ A 族相差 8 ,其他族相差 18 。 ③ 第四、五周期的同族元素原子序数相差 18 。 ④ 第五、六周期的同族元素原子序数镧系之前的相差 18 ,镧系之后的相差 32 。 ⑤ 第六、七周期的同族元素原子序数相差 32 。 专题七 │ 要点热点探究 4 .奇偶差规律 元素的原子序数与该元素在周期表中的族序数和该元素的主要化合价的奇偶性一致。若原子序数为奇数时,主族族序数、元素的主要化合价均为奇数,反之则均为偶数 ( 但要除去 N 元素,有多种价态, Cl 元素也有 ClO 2 ) 。零族元素的原子序数为偶数,其化合价看做 0 。 专题七 │ 要点热点探究 专题七 │ 要点热点探究 需要说明的是,除了这些常规的判据之外,还有一些间接的判断方法:例如,在构成原电池时,一般来说,负极金属的金属性更强。根据电解时,在阳极或者阴极上放电的先后顺序来判断等。 需要特别注意的是,利用原电池原理比较元素金属性时,不要忽视介质对电极反应的影响。如 Al—Mg— NaOH 溶液构成原电池时, Al 为负极, Mg 为正极; Fe—Cu—HNO 3 ( 浓 ) 构成原电池时, Cu 为负极, Fe 为正极。 专题七 │ 要点热点探究 例 2 下列叙述正确的是 ( ) A . Fe 分别与氯气和稀盐酸反应所得氯化物相同 B . K 、 Zn 分别与不足量的稀硫酸反应所得溶液均呈中性 C. Li 、 Na 、 K 的原子半价和密度随原子序数的增加而增大 D . C 、 P 、 S 、 Cl 的最高价氧化物对应水化物的酸性逐渐增强 专题七 │ 要点热点探究 D 【 解析 】 氯气具有强氧化性,铁在氯气中燃烧生成 FeCl 3 , H + 的氧化性较弱,与铁反应生成 FeCl 2 , A 项错误。锌与不足量的稀硫酸反应生成 ZnSO 4 溶液,属于强酸弱碱盐,溶液显酸性, K 与硫酸反应后得到 K 2 SO 4 为中性,而过量的 K 继续与水反应生成 KOH ,因此最后溶液显碱性, B 项错误。 Li 、 Na 、 K 为同主族元素,从上到下原子半径依次增大,但密度金属钠大于金属钾,出现反常, C 项错误。非金属性越强,其最高价氧化物对应水化物的酸性越强, C 、 P 、 S 、 Cl 的非金属性依次增强,因此 D 项正确。 专题七 │ 要点热点探究 【 点评 】 元素金属性及非金属性强弱比较是元素推断题中的主要考查点之一,其考查方式主要为:在推断出元素的基础上考查元素氢化物的稳定性、元素最高价氧化物对应水化物的酸碱性、元素对应单质的氧化性或还原性等。 专题七 │ 要点热点探究 变式题 某矿石由前 20 号元素中的四种组成,其化学式为 WYZX 4 。 X 、 Y 、 Z 、 W 分布在三个周期,原子序数依次增大, Y 、 W 为金属元素, X 原子的最外层电子数是次外层电子数的 3 倍, W 能与冷水剧烈反应, Y 、 Z 原子的最外层电子数之和与 X 、 W 原子的最外层电子数之和相等, Y 、 Z 位于同一周期, Z 单质是一种良好的半导体。则下列判断正确的是 ( ) A . Y 、 Z 的氧化物都有两性 B .气态氢化物的稳定性: Z>X C .原子半径: W>Y>Z>X D .最高价氧化物对应水化物的碱性: Y>W 专题七 │ 要点热点探究 C 【 解析 】 首先推出 X 和 Z 分别为 O 元素和 Si 元素。 W 能与冷水剧烈反应,且原子序数最大,推测 W 为 K 或 Ca ,若 W 为 Ca , Y 、 Z 原子的最外层电子数之和与 X 、 W 原子的最外层电子数之和相等,推出 Y 、 Z 最外层分别有 4 个和 4 个电子,而题中说, Y 、 Z(Si ) 位于同一周期,矛盾,故 W 只能是 K ,则 Y 为铝。 专题七 │ 要点热点探究 ► 探究点三 元素推断题的解题思路 1 .元素推断题的解题思路一般为:先确定该元素所在的主族位置,然后再根据该族元素性质变化规律进行推测判断。 2 .确定元素形成的化合物的解题思路一般为:推价态、定元素、想可能、得形式,从而获得结果。 3 .对元素 “ 位、构、性 ” 关系的分析思路一般为:先确定元素所在周期表中的位置,然后再根据位置推测性质。 专题七 │ 要点热点探究 例 3 有 A 、 B 、 C 三种短周期元素在周期表中相对位置如图 7 - 3 : (1)A 与 B 形成的液态化合物是常见的重要有机溶剂,则 A 、 B 、 C 三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是: ________>________>________( 用化学式表示 ) 。 专题七 │ 要点热点探究 (2)X 、 Y 为 B 、 C 两种元素形成的单质。标准状况下, X 的密度为 3.17 g·L - 1 。 Z 是一种化合物,焰色反应呈紫色 ( 透过蓝色钴玻璃 ) ,室温下 0.1 mol·L - 1 Z 水溶液 pH = 13 。 X 、 Y 、 Z 有如图 7 - 4 所示转化关系: 专题七 │ 要点热点探究 ① 写出 X 与 Z 反应的离子方程式: _________________ 。 ② 已知丙能与稀硫酸反应生成使品红褪色的气体。丁的化学式 _____ ,丁的水溶液 pH>7 的原因: ________________________( 用离子方程式表示 ) 。 ③ 将 20 mL 0.5 mol·L - 1 丙溶液逐滴加入 20 mL 0.2 mol·L - 1 KMnO 4 溶液 ( 硫酸酸化 ) 中,恰好褪色。写出反应的离子方程式 _____________________________ 。 专题七 │ 要点热点探究 专题七 │ 要点热点探究 专题七 │ 要点热点探究 变式题 A 、 B 、 C 、 D 、 E 是核电荷数依次增大的短周期元素,原子半径按 D 、 E 、 B 、 C 、 A 的顺序减小, B 和 E 同主族,下列推断不正确的是 ( ) A . A 、 B 、 E 一定在不同周期 B . D 为第二周期元素 C . A 、 D 可能在同一主族 D . C 和 D 的单质可能化合为离子化合物 专题七 │ 要点热点探究 B 【 解析 】 由 E 的核电荷数最大, B 和 E 同主族,则 E 在 B 下一周期相邻,由原子半径 E 在 D 、 B 之间,则 D 必位于 E 的左侧。再由原子半径 B>C>A ,结合原子序数可知 B 、 C 同周期,且 C 在 B 的右侧,而 A 必为氢元素。故 D 必为第三周期, B 项错误。 专题七 │ 教师备用习题 【备用理由】 本题可作为例 3 的强化训练。 教师备用习题 短周期元素 W 、 X 、 Y 、 Z 的原子序数依次增大,且 W 、 X 、 Y + 、 Z 的最外层电子数与其电子层数的比值依次为 2 、 3 、 4 、 2( 不考虑零族元素 ) 。下列关于这些元素的叙述错误的是 ( ) A . X 和其他三种元素均可形成至少两种的二元化合物 B . W 和 X 、 Z 两种元素分别形成的二元化合物中,均有直线形分子 C . W 、 X 和 Y 三种元素可以形成碱性化合物 D . Z 和其他三种元素形成的二元化合物,其水溶液均呈酸性 专题七 │ 教师备用习题 专题七 │ 教师备用习题 专题七 │ 教师备用习题查看更多