河南省林州一中2019-2020学年高二上学期9月月考化学测试题
2019-2020学年高二上9月化学测试题化学试题
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
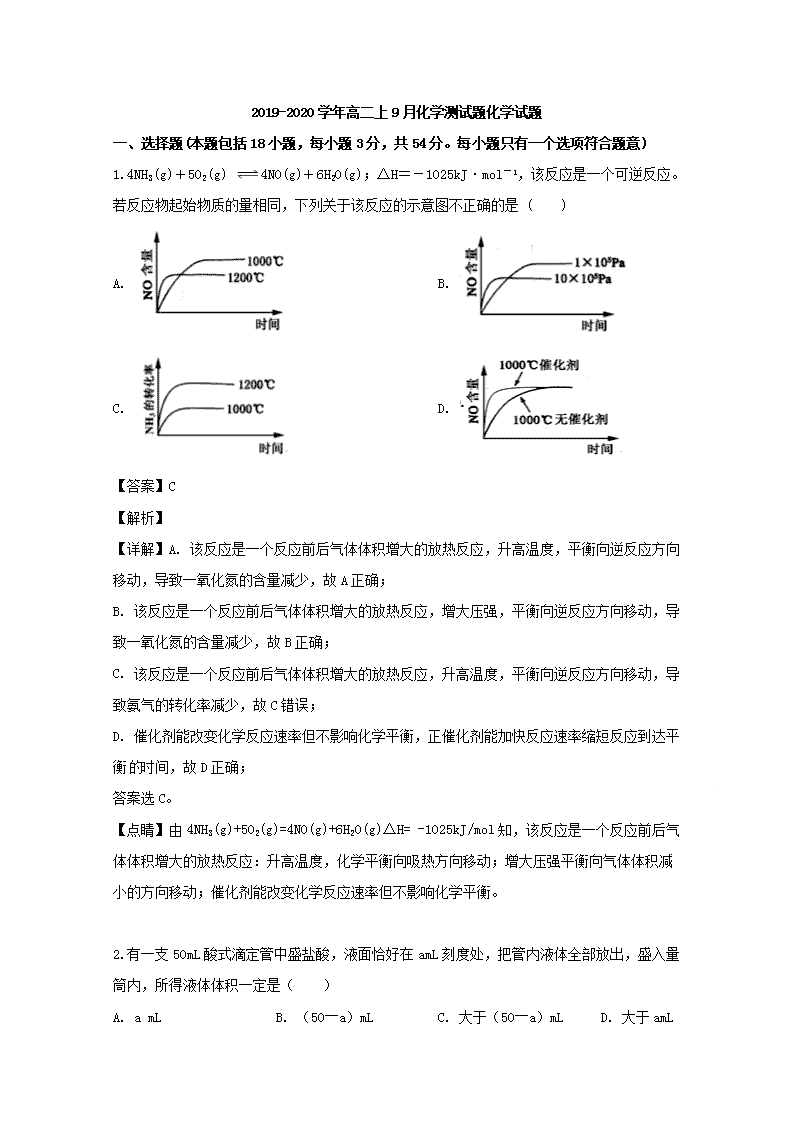
1.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH=-1025kJ·mol-1,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
A. B.
C. D.
【答案】C
【解析】
【详解】A. 该反应是一个反应前后气体体积增大的放热反应,升高温度,平衡向逆反应方向移动,导致一氧化氮的含量减少,故A正确;
B. 该反应是一个反应前后气体体积增大的放热反应,增大压强,平衡向逆反应方向移动,导致一氧化氮的含量减少,故B正确;
C. 该反应是一个反应前后气体体积增大的放热反应,升高温度,平衡向逆反应方向移动,导致氨气的转化率减少,故C错误;
D. 催化剂能改变化学反应速率但不影响化学平衡,正催化剂能加快反应速率缩短反应到达平衡时间,故D正确;
答案选C。
【点睛】由4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H= -1025kJ/mol知,该反应是一个反应前后气体体积增大的放热反应:升高温度,化学平衡向吸热方向移动;增大压强平衡向气体体积减小的方向移动;催化剂能改变化学反应速率但不影响化学平衡。
2.有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
A. a mL B. (50―a)mL C. 大于(50―a)mL D. 大于amL
【答案】C
【解析】
【详解】滴定管的“0”刻度在上端,满刻度在下端,滴定管刻度值从上到下刻度逐渐增大,滴定管满刻度以下还有一段空间没有刻度,50mL滴定管中实际盛放液体的体积大于50mL,因此,一支50mL酸式滴定管中盛盐酸,液面恰好在a mL刻度处,把管内液体全部放出,还有满刻度以下的溶液一并放出,总量超过(50–a)mL,故选C。
3.用水稀释 0.1mol/L 氨水时,溶液中随着水量的增加而减小的是( )
A. c(OH﹣)/ c(NH3.H2O) B. c(NH3.H2O)/ c(OH﹣)
C. c(H+)和 c(OH﹣)的乘积 D. OH﹣的物质的量
【答案】B
【解析】
【详解】A.由NH3.H2OOH-+NH4+可知,加水促进电离,则n(NH3.H2O)减少,n(OH-)增大,c(OH﹣)/ c(NH3.H2O),上下同时乘以体积,c(OH﹣)/ c(NH3.H2O)= n(OH-)/ n(NH3.H2O),二者的比值增大,A项不符合题意;
B. 由NH3.H2OOH-+NH4+可知,加水促进电离,则n(NH3.H2O)减少,n(OH-)增大,c(OH﹣)/ c(NH3.H2O),上下同时乘以体积, c(NH3.H2O)/ c(OH﹣) = n(NH3.H2O)/ n(OH-),二者的比值减小,B项符合题意;
C.因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,C项不符合题意;
D.由NH3·H2OOH-+NH4+可知,加水促进电离,OH-的物质的量增大,D项不符合题意;
故选B。
4.下列溶液加热蒸干后,能析出溶质固体的是
A. AlCl3 B. KHCO3 C. Fe2(SO4)3 D. NH4HCO3
【答案】C
【解析】
【详解】A.AlCl3加热后水解生成Al(OH)3和HCl,Al(OH)3易分解生成Al2O3,HCl易挥发,最后得到Al2O3固体;
B.KHCO3加热易分解生成K2CO3,最后得到K2CO3固体;
C.Fe2(SO4)3加热后水解生成Fe(OH)3和硫酸,但硫酸难以挥发,最后又能得到Fe2(SO4)
3;
D.NH4HCO3加热易分解生成氨气、水和二氧化碳气体,最后没有固体剩余。
本题选C。
5.1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
A. 9.0 B. 9.5 C. 10.5 D. 11.5
【答案】C
【解析】
【详解】据题意,一元强酸和一元强碱恰好反应,故有H+与OH-的物质的量相等,设强酸的体积为V,则强碱的体积为10V,有V10-2.5=10V10pH-14,解得pH=10.5,故选C。
6.把X气体和Y气体混合于2L容器中使它们发生如下反应,3X(g)+Y(g)nZ(g)+2W(g),5 min末已生成0.2molW,若测知以Z浓度变化来表示反应平均速率为0.01 mol·L-1·min-1,则上述反应中Z气体的反应方程式系数n的值是( )
A. 1 B. 2 C. 3 D. 4
【答案】A
【解析】
【详解】5 min末已生成0.2molW,以W浓度变化来表示的反应平均速率为0.02 mol·L-1·min-1,以Z浓度变化来表示的反应平均速率为0.01 mol·L-1·min-1,根据速率比等于系数比,则n=1,故选A。
7.在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法正确的是( )
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
【答案】C
【解析】
【详解】A.反应前2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,故v(Y)= =0.002mol/(L•min),速率之比等于化学计量数之比,故v(Z)=2v(Y)=2×0.002mol/(L•min)=0.004mol/(L•min),故A错误;
B.正反应放热,降低温度平衡正向移动,其他条件不变,降低温度,反应达到新平衡前v(逆)
0达到平衡后,改变以下条件,下列说法正确的是( )
A. 增大压强,正、逆反应速率同等程度增大,平衡不移动
B. 升高温度,正反应速率增大,逆反应速率减小,平衡向正方向移动
C. 增加A的浓度,平衡向正方向移动,平衡常数增大
D. 增加B的用量,正、逆反应速率不变,平衡不移动
【答案】D
【解析】
【详解】A、B物质是固体,反应后气体系数和增大,增大压强,平衡逆向移动,故A错误;
B、升高温度,正、逆反应速率均增大;正反应吸热,升高温度平衡向正方向移动,故B错误;
C、平衡常数只与温度有关,增加A的浓度,平衡向正方向移动,平衡常数不变,故C错误;
D、 B物质是固体,增加B的用量,浓度不变,所以正、逆反应速率不变,平衡不移动,故D正确;
本题答案选D。
9.如图曲线表示其他条件一定时,2NO(g)+O2(g)2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
A. a点 B. b点 C. c点 D. d点
【答案】C
【解析】
【分析】
当温度一定时,NO2的百分含量也一定,故曲线上任意一点都表示达到平衡状态,而曲线外的任意一点都表示未达平衡状态。在曲线下方的任意一点,要想达到同温度下的平衡状态,应该向上引垂直线到曲线上的一点,这样NO2的百分含量要增大,平衡向右移动;而在曲线上方的任意一点,要想达到同温度下的平衡状态,则应该向下引垂直线到曲线上的一点,这样NO2的百分含量要减小,平衡向左移动。
【详解】A、a点在曲线上方,未达到平衡状态,要想达到同温度下的平衡状态,需要由a点向下引垂直线到曲线上的一点,这样NO2的百分含量要减小,平衡向左移动,故v(正)<v(逆),故不选A;
B、b点在曲线上,处于平衡状态,v(正)=v(逆),故不选B;
C、c点在曲线下方,未达到平衡状态,要想达到同温度下的平衡状态,需要由c点向上引垂直线到曲线上的一点,这样NO2的百分含量要增大,平衡向右移动,故v(正)>v(逆),故选C;
D、d点在曲线上,处于平衡状态,v(正)=v(逆),故不选D;
本题答案选C。
【点睛】该题的关键是对图像的理解,知道曲线上的点为对应温度下的平衡点,而曲线外的任意一点都表示未达平衡状态;由不平衡到平衡,由曲线外的点引竖直垂线与曲线相交,根据y轴数据变化判断反应方向。
10.在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
A. ③②① B. ③①② C. ①②③ D. ②①③
【答案】A
【解析】
【详解】3A(g)+B(g) 2C(g)是体积减小的、放热的可逆反应。①容器反应过程中,体积不变,温度升高,与容器②相比,相当于升温,不利于反应正向移动,C物质的体积分数②>①;③容器体积可变、压强不变,正反应体积减小,所以③中的压强始终高于②,有利于反应正向移动,C物质的体积分数③>②,达到平衡时各容器中C物质的体积分数由大到小的顺序为③②①,故选A。
【点睛】本题考查温度、压强对化学平衡移动的影响,能正确分析①②容器温度变化、②③压强变化是解题的关键。
11.1 g碳与适量水蒸气反应生成CO和H2,需吸收10.94 kJ热量,此反应的热化学方程式为( )
A. C+H2O===CO+H2 ΔH=+131.3 kJ·mol-1
B. C(s)+H2O(g)===CO(g)+H2(g) ΔH=+10.94 kJ·mol-1
C. C(s)+H2O(l)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
D. C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
【答案】D
【解析】
【详解】碳和水蒸气反应是吸热反应,所以△H大于0。根据题意可知1mol碳即12g碳吸热是10.94kJ×12=131.28kJ,因此选项D正确;
A.没有注明物质的状态,A项错误;
B.中反应热不正确,B项错误;
C.中水的状态不是气态;C项错误;
D. 碳和水蒸气反应是吸热反应,所以△H大于0。根据题意可知1mol碳即12g碳吸热是10.94kJ×12=131.28kJ,因此选项D正确;
答案选D。
12.强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
A. △H1>△H2>△H3 B. △H1<△H3<△H2 C. △H1<△H2<△H3 D. △H1>△H3>△H2
【答案】D
【解析】
试题分析:】醋酸是弱酸,存在电离平衡,电离是吸热的,所以醋酸反应中放出的热量少。浓硫酸溶于水放出热量,所以反应中放出的热量多,但△H小于0,所以正确的答案选D。
考点:中和热和电离平衡 。
13.已知下列热化学方程式:
(1)CH3COOH (l)+2O2 (g) == 2CO2 (g)+2H2O (l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2 (g) △H2=-393.5 kJ•mol-1
(3)H2(g) +O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2 (g) +O2 (g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1
C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
【答案】A
【解析】
【分析】
根据化学反应的反应热只与反应的始态和终态有关,而与反应进行的途径无关分析;
由盖斯定律可知2×②+③×2-①得:2C(s)+2H2(g)+O2(g)=CH3COOH(l);再根据反应热也要进行相应计算可得△H=2△H2+2△H3-△H1,带入数据进行计算。
【详解】已知①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3kJ/mol,
②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol,
③H2(g)+1/2O2(g)=H2O(l) △H3=-285.8kJ/mol,
将热化学方程式2×②+③×2-①得:2C(s)+2H2(g)+O2(g)=CH3COOH(l),
则△H=2△H2+2△H3-△H1=2×(-393.5kJ/mol)+(-571.6kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol。
故选A。
14.下列热化学方程式中的反应热下划线处表示燃烧热的是( )
A. NH3(g)+O2(g)=N2(g)+H2O(g);ΔH= -a kJ·mol-1
B. C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l);ΔH= -b kJ·mol-1
C. C(s)+H2O(g)=CO(g)+H2(g);ΔH= -c kJ·mol-1
D. CH3CH2OH(l)+O2(g)=CH3CHO(l)+H2O(l);ΔH= -d kJ·mol-1
【答案】B
【解析】
【详解】A. H2O(g)不是稳定氧化物,不是燃烧热,故A错误;
B. 燃烧生成二氧化碳及液态水为稳定氧化物,且1mol葡萄糖燃烧为燃烧热,故B正确;
C. 该反应是不是燃烧反应过程,故C错误;
D. 1mol CH3CH2OH燃烧应生成二氧化碳和液态水时为燃烧热,CH3CHO不是稳定氧化物,故D错误;
答案选B。
【点睛】1mol纯物质燃烧生成稳定氧化物时放出的热量为燃烧热,结合物质的状态、常见的稳定氧化物判断燃烧热,以此来解答。
15.下列装置或操作能达到目的的是( )
A. 装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)N2O4(g)平衡移动的方向
B. 装置②依据U管两边液面的高低判断Na和水反应的热效应
C. 装置③测定中和热
D. 装置④依据褪色快慢比较浓度对反应速率的影响
【答案】B
【解析】
【详解】A. NO2是红棕色气体,2NO2(g)N2O4(g)颜色加深表明平衡逆向移动,装置①依据两容器内气体颜色变化,能判断反应2NO2(g)N2O4(g)平衡移动的方向,故不选A;
B. 钠与水反应放热,温度升高,大试管内温度升高,气体膨胀,U型管左侧液面降低,装置②可以依据U管两边液面的高低判断Na和水反应的热效应,故选B;
C. 装置③中没有环形玻璃搅拌器,不能测定中和热,故不选C;
D. 两种高锰酸钾的浓度不同,颜色不同,不符合控制变量法,应保证高锰酸钾浓度相同,用不同浓度的草酸来做实验,故不选D;
本题答案选B。
【点睛】涉及中和热的测定、仪器使用、化学平衡影响因素判断等知识点,明确实验原理及操作规范性是解本题关键。注意在探究影响反应速率的因素的实验中,控制变量法的应用。
16.25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-a mol/L,下列说法不正确的是( )
A. a<7时,水的电离受到促进 B. a>7时,水的电离受到抑制
C. a<7时,溶液的pH一定为a D. a>7时,溶液的pH一定为14-a
【答案】D
【解析】
【详解】A.如果a<7,则水电离出的c(H+)>1×10-7mol/L,则水的电离受到促进,故A正确;
B.如果a>7,则水电离出的c(H+)<1×10-7mol/L,则水的电离受到抑制,故B正确;
C.如果a<7,则促水的电离受到促进,该溶液为盐溶液,溶液的pH=a,故C正确;
D.如果a>7,则水的电离受到抑制,该溶液为酸溶液或碱溶液,则该溶液的pH值为a或14-a,故D错误;
答案选D。
【点睛】向水中加入酸或碱抑制水电离,加入含有弱根离子的盐促进水电离,根据某物质的溶液中由水电离出的c(H+)和纯水中c(H+)相对大小判断是促进水电离还是抑制水电离。
17.已知当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1。现用0.1mol/L的盐酸滴定l0mL0.05mol/L的氨水,用甲基橙作指示剂达到终点时所用盐酸的量应是()
A. 10mL B. 5mL C. 大于5mL D. 小于5mL
【答案】C
【解析】
【详解】当盐酸与NH3·H2O恰好完全反应,n(HCl)=n(NH3·H2O),解得消耗盐酸的体积为5mL,此时溶液中c(NH4Cl)=<0.1mol·L-1,溶液的pH>5.1,而甲基橙变色范围是3.1~4.4,因此溶液不能变色,还需继续加入盐酸降低pH,因此最终消耗盐酸的量大于5mL,故C正确;
答案选C。
18.某温度下,0.1 mol/L醋酸溶液的pH=3。将该温度下0.2 mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7。下列说法正确的是( )
A. 该温度下,0.0l mol/L醋酸溶液的pH=4
B. 该温度下,用0.1 mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1∶100
C. 该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH<4.7
D. 该温度下,0.4 mol/L醋酸溶液和0.2 mol/L氢氧化钠溶液等体积混合后,混合液的pH=4.7
【答案】D
【解析】
【详解】A、醋酸是弱酸,存在电离平衡,加水稀释时电离平衡正向移动,氢离子物质的量增多,0.0l mol/L醋酸溶液的pH的范围为:3<pH<4,故A错误;
B、1体积0.1 mol/L醋酸和10体积0.01 mol/L醋酸溶液中所含醋酸物质的量相同,所以中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1:10,故B错误;
C、0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,得到0.1 mol/L醋酸和0.2mol/L醋酸钠的混合溶液,相当于0.1 mol/L醋酸和0.1mol/L醋酸钠溶液中其醋酸钠溶液的浓度增大为0.2mol/L,醋酸钠水解成碱性,因此其酸性弱于醋酸和醋酸钠浓度均为0.1 mol/L的混合溶液,其pH>4.7,故C错误;
D. 该温度下,0.4 mol/L醋酸溶液和0.2 mol/L氢氧化钠溶液等体积混合后,得到醋酸和醋酸钠浓度均为0.1 mol/L的混合溶液,其pH=4.7,故D正确;
本题答案选D。
二、(本题包括4小题,共46分)
19.基本知识填空
(1)在一定条件下,当一个可逆反应的_____与____相等时,反应物的浓度与生成物的浓度不再改变,即达到化学平衡状态。
(2)化学平衡状态的特征:_____、____、_____、_____、_____。
(3)对于可逆化学反应 mA+nB⇋pC+qD在一定温度下达到化学平衡时,其平衡常数表达式为:______。
(4)强电解质包括的范围:____、____、____。弱电解质包括的范围:____、_____、____、_____。
【答案】 (1). 正反应速率 (2). 逆反应速率 (3). 逆 (4). 等 (5). 动 (6). 定 (7). 变 (8). (9). 强酸 (10). 强碱 (11). 大多数盐 (12). 弱酸 (13). 弱碱 (14). 少数盐 (15). 水
【解析】
【详解】(1)化学平衡的定义:一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物与生成物的浓度保持不变,达到表面上静止的一种“平衡状态”,这种状态叫化学平衡状态;
(2)化学平衡的特征:①逆:可逆反应;②等:正逆反应速率相等;③动:动态平衡;④定:平衡混合物中百分含量一定;⑤变:改变平衡条件,平衡就会改变,建立新平衡。
(3)平衡常数是平衡时生成物浓度系数次方的乘积与反应物浓度系数次方的乘积的比,对于可逆化学反应 mA+nB⇋pC+qD在一定温度下达到化学平衡时,其平衡常数表达式为:。
(4)强电解质是在水溶液中完全电离的化合物,包括的范围:强酸、强碱、大多数盐。弱电解质是在水溶液中部分电离的化合物,包括的范围:弱酸、弱碱、少数盐、水。
20.(1)AgNO3的水溶液呈________________(填“酸”、“中”、“碱”)性,常温时的pH_____7(填“>”、“=”、“<”),原因是(用离子方程式表示):_______________________________________________________________________________________;
实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以____________(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈_______性 ,原因是(用离子方程式表示):_____________________________________________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________________。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的______________。
【答案】 (1). 酸 (2). < (3). Ag++ H2OAgOH + H+ (4). 抑制 (5). 酸 (6). Al3++3H2OAl(OH)3+3H+ (7). Al2O3 (8). NaOH
【解析】
【详解】(1)AgNO3是强酸弱碱盐,阴离子水解,水溶液呈酸性,pH小于7。水解方程式是Ag++ H2OAgOH + H+;硝酸银溶于水,银离子水解,溶液显酸性。所以将AgNO3固体先溶于较浓的硝酸中的目的是抑制银离子的水解;
(2)氯化铝溶于水,铝离子水解,溶液显酸性,水解方程式是Al3++3H2OAl(OH)3+3H
+。水解吸热,加热促进水解,且生成的氯化氢挥发,进一步促进水解,所以最终得到的是氢氧化铝,灼烧得到氧化铝;
(3)硫化钠溶于水,硫离子水解,溶液显碱性。所以在配制硫化钠溶液时,为了防止发生水解,可以加入少量的氢氧化钠。
【点睛】盐电离出来的离子结合水电离出来的 H+或 OH-生成弱电解质的过程。盐类水解的应用主要有:①判断盐溶液的酸碱性和比较盐溶液酸碱性的强弱时,通常需考虑盐的水解。②比较盐溶液中各离子浓度的相对大小时,当盐中含有易水解的离子,需考虑盐的水解。③判断溶液中离子能否大量共存。当有弱碱阳离子和弱酸阴离子之间能发生强烈双水解,则不能在溶液中大量共存。④配制易水解的盐溶液时,需考虑抑制盐的水解。⑤选择制备盐的途径时,需考虑盐的水解。⑥离子除杂、化肥的使用需考虑盐类的水解。⑦溶液中离子浓度大小比较时需要考虑盐类水解。
21.(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_______(填“酸性”,“ 中性”或“碱性”,下同),溶液中c(Na+)________c(CH3COO-)(填“>”或“=”或“<”下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈______,溶液中c (Na+)_________c (CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈__________,醋酸体积___________氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)______氢氧化钠溶液中c(OH-),m与n的大小关系是m_________n。
【答案】 (1). 碱性 (2). > (3). 酸性 (4). < (5). 中性 (6). > (7). < (8). >
【解析】
【详解】(1)将等体积等物质量浓度的醋酸和氢氧化钠溶液混合后,生成了醋酸钠溶液,为强碱弱酸盐,醋酸根水解呈碱性,由于醋酸根水解,所以c(Na+)>c(CH3COO-);
(2)醋酸为弱酸,故pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液后生成了醋酸钠和醋酸的混合溶液,并且醋酸的量远远大于醋酸钠的量,故其该混合溶液呈酸性,根据电荷守恒可以知道c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因为溶液为酸性,所以c(H+)>c(OH-),故c(Na+)<c(CH3COO-);
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,根据电荷守恒可以知道c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故混合后溶液呈中性,等体积混合后,溶液呈碱性,现溶液呈中性,则醋酸需要多加,醋酸体积大于氢氧化钠溶液体积;
(4)将mmol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,由于醋酸为弱酸,所以醋酸溶液中c(H+)小于氢氧化钠溶液中c(OH-);如果恰好反应生成醋酸钠溶液,溶液呈碱性,为了呈中性,则醋酸需要多加,m与n的大小关系是m大于n。
22.维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,人体缺乏这样的维生素能得坏血症,所以维生素C又称抗坏血酸。在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如新鲜橙汁中维生素C的含量在500mg/L左右。某校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量,下面是测定实验分析报告。(请填写有关空白)
(一)测定目的:测定××牌软包装橙汁中维生素C的含量。
(二)测定原理:C6H8O6+I2 →C6H6O6+2H++2I―
(三)实验用品及试剂
(1)仪器和用品(自选,略)
(2)试剂:指示剂___(填名称),浓度为7.50×10-3mol·L-1的I2标准溶液、蒸馏水等。
(四)实验过程
(1)洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
(2)用___(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
(3)用左手控制滴定管的___(填部位),右手摇动锥形瓶,眼睛注视___,直到滴定终点。滴定至终点时的现象是___。
(五)数据记录与处理(请在下面设计并画出数据记录和数据处理的表格,不必填数据)。__
若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是___mg/L。
(六)问题讨论:
(1)滴定时能否剧烈摇动锥形瓶?为什么?_____
(2)从分析数据看,此软包装橙汁是否是纯天然橙汁?___(填“是”或“不是”或“可能是”)。制造商最可能采取的做法是____(填编号):
A.加水稀释天然橙汁 B.橙汁已被浓缩 C.将维生素C作为添加剂
【答案】 (1). 淀粉溶液 (2). 酸式滴定管(或移液管) (3). 活塞 (4). 锥形瓶内溶液颜色变化 (5). 溶液无色变蓝色,且半分钟内不恢复原色 (6).
读数
组别
起始(mL)
终点(mL)
△V
1
2
3
(7). 990 (8). 不能;防止液体溅出 (9). 不是 (10). C
【解析】
【分析】
(1)根据滴定原理C6H8O6+I2 →C6H6O6+2H++2I―,用碘液滴定维生素C溶液,碘遇淀粉变蓝;
(2)根据维生素C水溶液呈酸性选择仪器;
(3)根据滴定操作的规范回答;滴入最后一滴碘液时,碘液有剩余;
(4)滴定操作需要记录滴定管开始和终点的刻度,实验重复2-3次;
(5)根据反应方程式C6H8O6+I2 →C6H6O6+2H++2I―计算此橙汁中维生素C的含量;
(6)剧烈摇动锥形瓶,液体易溅出;
(7)根据天然橙汁中维生素C的含量判断;
【详解】(1)根据滴定原理C6H8O6+I2 →C6H6O6+2H++2I―,用碘液滴定维生素C溶液,所以选择的指示剂是淀粉溶液;
(2)根据维生素C水溶液呈酸性,用酸式滴定管(或移液管)向锥形瓶中移入20.00mL待测橙汁;
(3)用左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色变化,直到滴定终点。滴定至终点时的现象是滴入最后一滴碘液溶液由无色变蓝色,且半分钟内不恢复原色;
(3)滴定操作需要记录滴定管开始和终点的刻度,实验重复2-3次,表格为
读数
组别
起始(mL)
终点(mL)
△V
1
2
3
;
(5)设20.00mL待测橙汁中维生素C的含量为xmol;
C6H8O6 + I2 → C6H6O6 + 2H++ 2I―
1 1
7.50×10-3mol·L-1×0.015L x
X=1.125×10-4mol
此橙汁中维生素C含量是0.99g/L=990mg/L。
(6)防止液体溅出,滴定时不能剧烈摇动锥形瓶;
(7)新鲜橙汁中维生素C的含量在500mg/L左右,而该软包装橙汁维生素C的含量在990mg/L,所以不是纯天然橙汁;加水稀释天然橙汁,维生素C含量会降低;橙汁已被浓缩,提高了成本;将维生素C作为添加剂,提高维生素的含量,故选C;
23.(1)将pH=l的盐酸平均分成2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为____。
(2)在100℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为___
(3)在250C时,有pH为a的盐酸和pH为b的NaOH溶液,取Va L该盐酸,同该NaOH溶液中和,需Vb LNaOH溶液。填空:
①若a + b = 14,则Va∶Vb = __(填数字)。
②若a + b = 13,则Va∶Vb = ___(填数字)。
③若a + b >14,则Va∶Vb = ___(填表达式)。
【答案】 (1). 11:1 (2). 1:10 (3). 1 (4). 0.1 (5). 10a+b-14
【解析】
【分析】
此题为溶液pH的计算,涉及两种题型,一种为溶液的稀释,另一种为酸碱溶液的混合,计算时前者根据溶质的物质的量不变,后者计算反应后剩余的酸的物质的量和溶液的体积进行计算.由稀释规律知,1份pH=1的盐酸升高pH=2时所加水应该约为9份;设加NaOH溶液x份,则盐酸与NaOH溶液(据题意知其浓度应为0.1 mol•L-1)反应后仍有盐酸剩余,即得加入的水与NaOH溶液的体积比;
25℃时水的离子积Kw=c(H+)×c(OH-)=10-14,pH= -lgc(H+);25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸用该NaOH溶液中和,需VbLNaOH溶液,则有Va L×10-amol/L=Vb L×10b-14mol/L;根据Va L×10-amol/L=Vb L×10b-14mol/L,即Va:Vb=10a+b-14,以此进行解答。
【详解】(1)根据题意盐酸平均分成2份,设每份都为1L,将pH= 1的盐酸加适量的水, pH升高1,则体积是原盐酸体积的10倍,说明所加的水的体积是原溶液的9倍,即水的体积为9L ;另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH也升高了1,可设碱液体积x,依题意可列出下列等式:10-1mol/L×1L-10-1mol/L×xL= 10-2mol/L×(1+x)L,解之得x= L ,则加入的水与NaOH溶液的体积比为9:=11:1;
(2)pH=3的硫酸溶液的H+浓度为10-3,pH=10的NaOH的OH-浓度为10-4,故若使混合后溶液的pH=7,则硫酸溶液和NaOH溶液两者中和反应需要物质的量相等,因此体积比为应为1:10;
(3)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取Va L该盐酸用该NaOH溶液中和,需Vb LNaOH溶液,则有Va L×10-amol/L=Vb L×10b-14mol/L,即Va:Vb=10a+b-14,
①若a+b=14,则Va:Vb=10a+b-14=1;
②若a+b=13,则Va:Vb=10a+b-14=1:10=0.1;
③若a+b>14,则Va:Vb=10a+b-14>1,即Va>Vb。