- 2021-08-23 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年新疆兵团第二师华山中学高二下学期期末考试化学试题 Word版
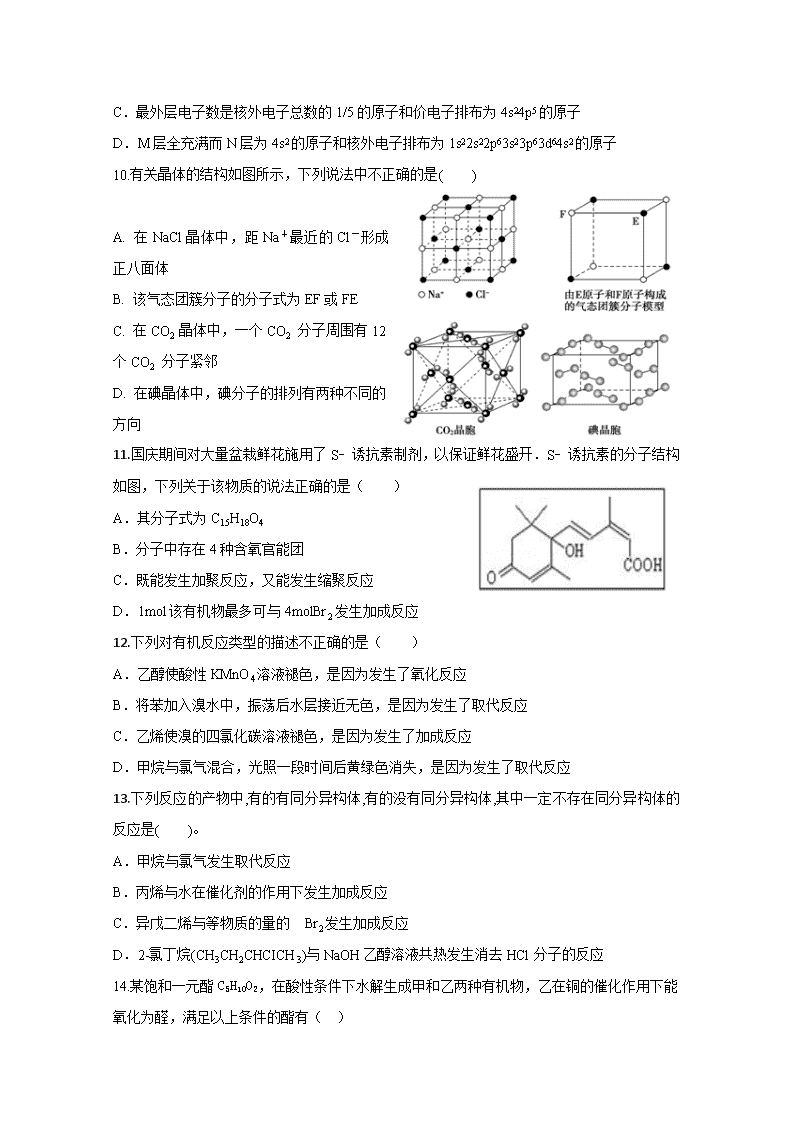
2017-2018学年新疆兵团第二师华山中学高二下学期期末考试化学 试卷 (考试时间:90分钟,满分:100分) 命题教师:杨静 一、选择题(本题共16道小题,每小题3分,共48分) 1.下列有关化学用语使用正确的是 A. 石英的分子式:SiO2 B. NH4Cl的电子式: C. Cr原子的基态简化电子排布式为[Ar]3d54s1 D. S原子的外围电子排布图为 2.下列对一些实验事实的理论解释正确的是( ) 选项 实验事实 理论解释 A 碘单质在CCl4中溶解度比在水中大 CCl4和I2都是非极性分子,而H2O是极性分子 B CO2为直线形分子 CO2分子中C═O是极性键 C[] 金刚石的熔点低于石墨 金刚石是分子晶体,石墨是原子晶体 D HF的沸点高于HCl HF的相对分子质量小于HCl 3.下列说法中正确的是 A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构 B. PH3和CH4都是正四面体形分子且键角都为109°28′ C. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 D. NH4+的电子式为,离子呈平面正方形结构 4.砷是氮族元素,黄砷(As4)是其一种单质,其分子结构与白磷(P4)相似,以下关于黄砷与白磷的比较叙述正确的是( ) A.黄砷中共价键键能大于白磷 B.黄砷的熔点高于白磷 C.黄砷易溶于水 D.分子中共价键键角均为109°28′ 5.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”.下列关于“暖冰”的说法正确的是( ) A.暖冰中水分子是直线型分子 B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化 C.暖冰中水分子的各原子均满足8电子稳定结构 D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” 6.下列各项叙述中,正确的是( ) A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是p区元素 C.47Ag原子的价层电子排布式是4d95s2 D.电负性由小到大的顺序是N<O<F 7.下列变化需克服相同类型作用力的是( ) A. 碘和干冰的升华 B. 硅和C60的熔化 C. 氯化氢和氯化钾的溶解 D. 溴和汞的气化 8.下列说法正确的是( ) ①具有规则几何外形的固体一定是晶体 ②NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 ③非极性分子中一定含有非极性键 ④晶格能由大到小:NaF>NaCl>NaBr>NaI ⑤含有共价键的晶体一定具有高的熔、沸点及硬度 ⑥s﹣sσ键与s﹣pσ键的电子云形状相同 ⑦含有π键的化合物与只含σ键的化合物的化学性质不同 ⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体. A.①②⑤⑥ B.③④⑥⑦ C.②④⑦⑧ D.③④⑤⑧ 9.下列各组表述中,两个微粒一定不属于同种元素原子的是( ) A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子 B.2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子 C.最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子 D.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子 10.有关晶体的结构如图所示,下列说法中不正确的是( ) A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体 B. 该气态团簇分子的分子式为EF或FE C. 在CO2 晶体中,一个CO2 分子周围有12个CO2 分子紧邻 D. 在碘晶体中,碘分子的排列有两种不同的方向 11.国庆期间对大量盆栽鲜花施用了S﹣诱抗素制剂,以保证鲜花盛开.S﹣诱抗素的分子结构如图,下列关于该物质的说法正确的是( ) A.其分子式为C15H18O4 B.分子中存在4种含氧官能团 C.既能发生加聚反应,又能发生缩聚反应] D.1mol该有机物最多可与4molBr2发生加成反应 12.下列对有机反应类型的描述不正确的是( ) A.乙醇使酸性KMnO4溶液褪色,是因为发生了氧化反应 B.将苯加入溴水中,振荡后水层接近无色,是因为发生了取代反应 C.乙烯使溴的四氯化碳溶液褪色,是因为发生了加成反应 D.甲烷与氯气混合,光照一段时间后黄绿色消失,是因为发生了取代反应 13.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )。 A.甲烷与氯气发生取代反应 B.丙烯与水在催化剂的作用下发生加成反应 C.异戊二烯与等物质的量的 Br2发生加成反应 D.2-氯丁烷(CH3CH2CHCICH3)与NaOH乙醇溶液共热发生消去HCl分子的反应 14.某饱和一元酯C5H10O2,在酸性条件下水解生成甲和乙两种有机物,乙在铜的催化作用下能氧化为醛,满足以上条件的酯有( ) A. 6种 B. 7种 C. 8种 D. 9种 15.稀土是我国的丰产元素,17种稀土元素性质非常接近,用有机萃取剂来分离稀土元素是一种重要的技术。有机萃取剂A的结构式如图所示,据你所学知识判断A属于 A. 酸类 B. 酯类 C. 醛类 D. 醚类 16.CH3CH(C2H5)CH(C2H5)CH(CH3)2的名称是 A. 2, 3-二甲基-4-乙基戊烷 B. 2-甲基-3,4-二乙基戊烷 C. 2, 5-二甲基-3-乙基己烷 D. 2, 4二甲基-3-乙基己烷 二、填空题(本题共4道小题,共52分) 17.(14分) (一)铁和钴是两种重要的过渡元素。 (1) 钴位于元素周期表中第___族,其基态原子中未成对电子的个数为_________。 (2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________,其中尿素分子中σ键与π键的数目之比为___,所含非金属元素的电负性由大到小的顺序是_______。 (二) 已知元素镓和砷的单质及其化合物在工业生产上有重要的用途。回答下列问题: (1)砷元素基态原子的电子排布式为_____________。 (2)砷与氢元素。可形成化合物砷化氢,该化合物的空间构型为_____,其中 砷原子的杂化方式为__________。 (3)根据等电子原理,写出由短周期元素组成且与砷化氢互为等电子体的一种离子的化学式__________。 18.(8分)科学家成功合成了新型抗肿瘤铂(Ⅳ)类化合物Pt( HPxSC)Cl3,请回答下列问题: (1)基态磷原子价电子排布图为__________________。 (2)在元素周期表中,铂元素与铁元素同族,则铂元素位于_________。 A.s区 B.p区 C.d区 D. ds区 E.f区 (3)磷、硫、氯的第一电离能由小到大的顺序为__________________(填化学式)。 (4)与S同族的相邻元素氢化物沸点最高的为_________(填化学式),其原因为_________ 。 (5)铂(Pt)单质晶体中原子的堆积方式如图所示,由图可知,晶体铂的堆积方式为_________,一个晶胞中含有_________个铂原子,距离每个铂原子最近且等距离的铂原子有_________个。 19.(8分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示): (1)A、B、C、D的第一电离能由小到大的顺序为____________________________________。 (2)B的氯化物的熔点远高于C的氯化物的熔点,理由是________________________; (3)A的最高价含氧酸根离子中,其中心原子采取____________杂化,D的低价氧化物分子的空间构型是___________________________。 (4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为________________;(每个球均表示1个原子) 若相邻A原子和E原子间的距离为a nm,阿伏伽德罗常数为NA,则该晶体的密度为_____________g/cm3(用含a、NA的符号表示)。 20.(10分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下: 相对分子质量 密度/(g•cm-3) 沸点/℃ 水中溶解性 异戊醇 88 0.8123 131 微溶 乙酸 60 1.0492 118 溶 乙酸异戊酯 130 0.8670 142 难溶 实验步骤: 在A中加入4.4 g异戊醇(3-甲基-1-丁醇)、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min 。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。 回答下列问题: (1)仪器B的具体名称是____________,实验时冷却水的进水口是_____(a或b)。 (2)在洗涤操作中,先水洗再饱和NaHCO3溶液洗而不是直接用饱和NaHCO3溶液洗涤的原因是____________________。 (3)该制备反应的化学反应方程式为__________________________。 (4)本实验中加入过量乙酸的目的是___________________________。 (5)本实验中不能用生石灰代替无水MgSO4的原因________________________。 (6)在蒸馏操作中,仪器选择及安装都正确的是___________(填标号)。 (7)本实验的产率是___________________________ 21.(12分)Atropic 酸(H)是某些具有消炎、镇痛作用药物的中间体,其一种合成路线如下: (1)G中含氧官能团的名称是____________;反应1为加成反应,则B的结构简式是________________。 (2)反应2的反应类型为________________,反应3的反应条件为________________。 (3)C→D的化学方程式是________________________________。 (4)写出E与银氨溶液水浴反应的离子方程式_______________________________。 (5)下列说法正确的是________。 a. B中所有原子可能在同一平面上 b. 合成路线中所涉及的有机物均为芳香族化合物 c.一定条件下1mol有机物H最多能与5mol H2发生反应 d. G能发生取代、加成、消去、氧化、缩聚等反应 (6)化合物G有多种同分异构体,其中同时满足下列条件:①能发生水解反应和银镜反应; ②能与FeC13发生显色反应;③核磁共振氢谱只有4个吸收峰的同分异构体的结构简式是_________。 2017-2018学年第二学期高二年级期末考试 化学 答案 一、选择题(本题共16道小题,每小题3分,共48分) 1--5:CACBD 6--10:DACDB 11--16:CBAABD 二、填空题(本题共4道小题,共52分) 17.(一) (每空2分共10分)(1)VIII 3 (2) [ Ar] 3d5( 或1s2s2p63s3p63d5 ) 7:1 O>N>C>H (二) (每空1分,共4分) (1) ls22s22p63s23p63d104s24p3 (2)三角锥型 sp3 (3)H3O+ 18.(每空1分共8分) (1) (2) C (3)S查看更多
相关文章
- 当前文档收益归属上传用户