- 2021-08-07 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年河南省实验中学高二上学期期中考试 化学 Word版
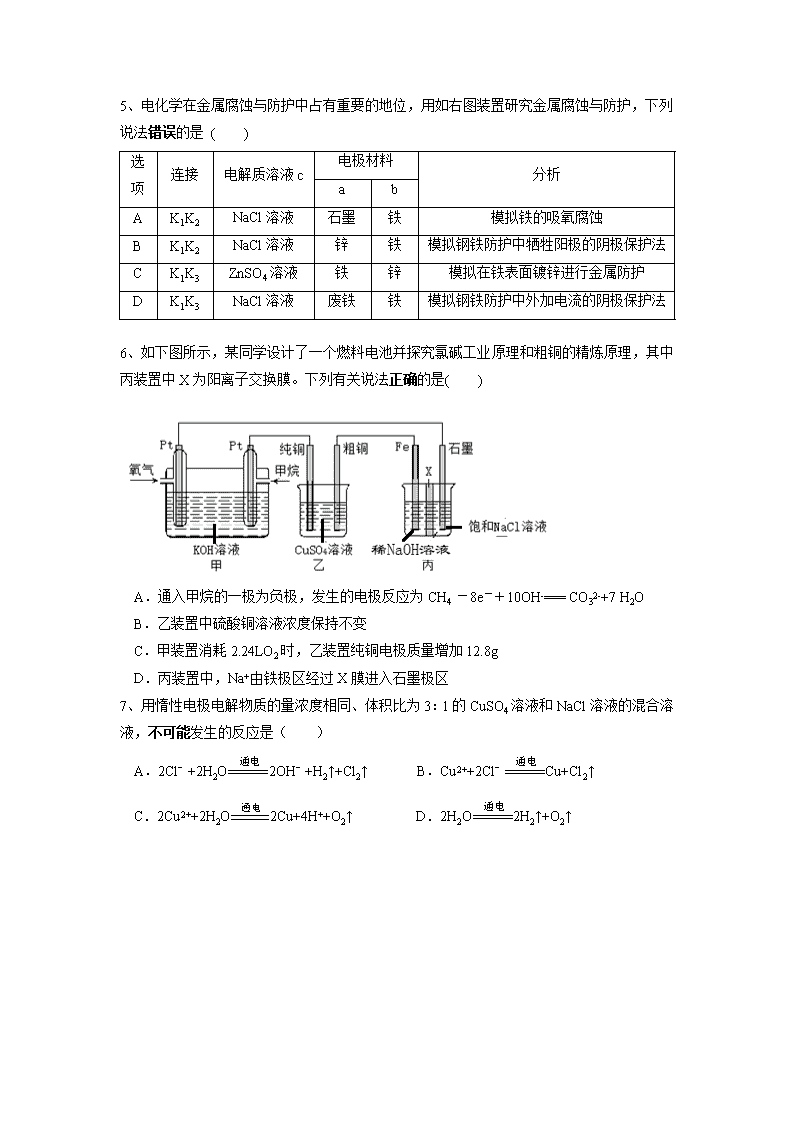
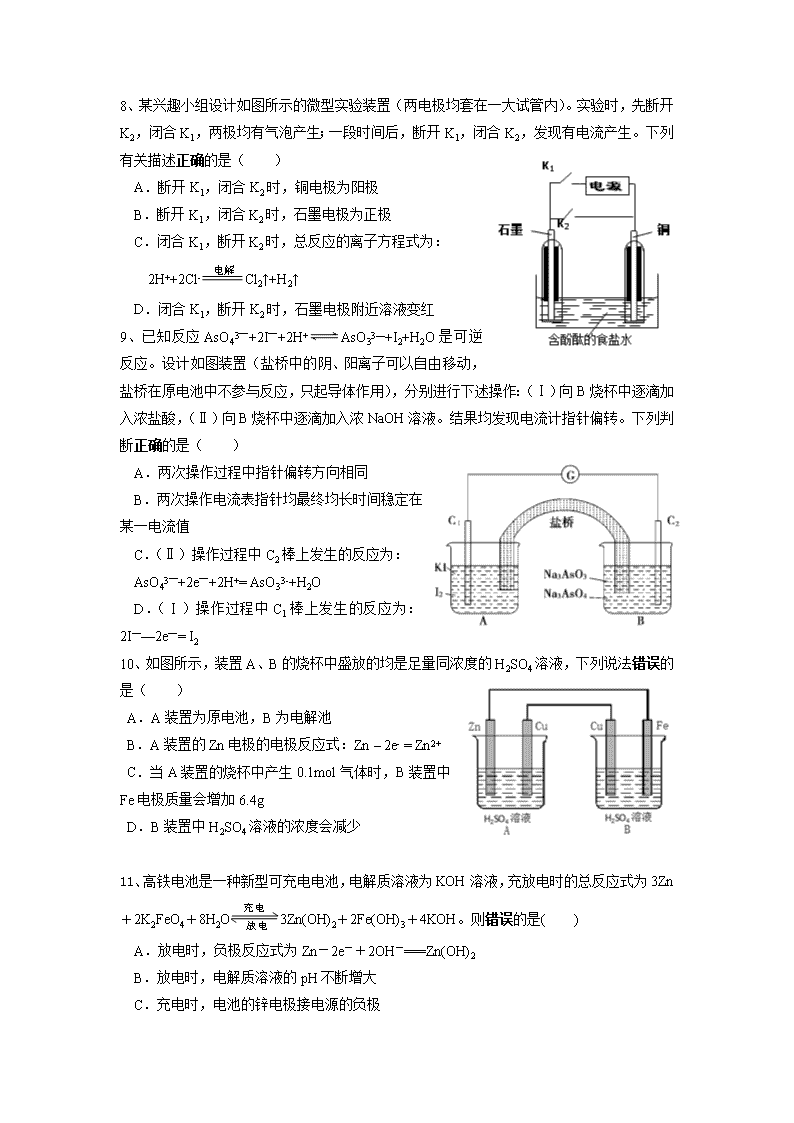
河南省实验中学2017——2018学年上期期中试卷 高二 化学 命题人:王欣羽 王贵艳 审题人:周庆 (时间:90分钟,满分:100 分) 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Fe-56 Cu-64 一、选择题(本大题共16小题,每小题3分,共48分,每小题只有一个正确答案。) 1、10月17日开幕的党的十九大,继续倡导可持续发展理念,建设健康和谐美丽中国。下列错误的是( ) A.利用垃圾焚烧产生的热能发电或供热,从而充分地利用生活垃圾中的生物质能 B.通过煤的液化、气化等物理方法可以将煤转化为CO、CH4等燃料,提高煤燃烧的热效率 C.推出共享单车,呼吁全民绿色出行,从而减少汽车尾气的排放 D.推广使用天然气和液化石油气等清洁燃料,从而减少大气污染物的排放 2、下列说法正确的( ) A.甲烷的燃烧热△H=-890kJ/mol,则:CH4(g)+O2(g)=CO2(g)+H2O(g) △H=-445kJ/mol B.一定条件下将1molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则:2SO2(g)+O2(g) 2SO3(g) △H=-158.4kJ·mol-1 C.若破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,此反应为放热反应 D.焓是描述物质能量高低的物理量,恒压条件下,反应的热效应等于物质的焓 3、已知:C(s)+H2O(g)=CO(g)+H2(g) △H=+130 kJ/mol C(s)+1/2 O2(g)=CO(g) △H= a kJ/mol H-H、O=O和O-H键的键能分别为436kJ/mol、496kJ/mol和462 kJ/mol,则a为( ) A.-220 B.-118 C.-110 D.+350 4、已知:C(s)+O2(g)=CO2(g) △H1CO2(g)+C(s)=2CO(g) △H2 2CO(g)+O2(g)=2CO2(g) △H34Fe(s)+3O2(g)=2Fe2O3(s) △H4 3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5 下列关于上述反应焓变的判断正确的是( ) A.△H1>0,△H3<0 B.△H2>0,△H4>0 C.△H3=△H4+△H5 D.△H1=△H2+△H3 5、电化学在金属腐蚀与防护中占有重要的地位,用如右图装置研究金属腐蚀与防护,下列说法错误的是 ( ) 选项 连接 电解质溶液c 电极材料 分析 a b A K1K2 NaCl溶液 石墨 铁 模拟铁的吸氧腐蚀 B K1K2 NaCl溶液 锌 铁 模拟钢铁防护中牺牲阳极的阴极保护法 C K1K3 ZnSO4溶液 铁 锌 模拟在铁表面镀锌进行金属防护 D K1K3 NaCl溶液 废铁 铁 模拟钢铁防护中外加电流的阴极保护法 6、如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中丙装置中X为阳离子交换膜。下列有关说法正确的是( ) A.通入甲烷的一极为负极,发生的电极反应为CH4 -8e-+10OH-=== CO32-+7 H2O B.乙装置中硫酸铜溶液浓度保持不变 C.甲装置消耗2.24LO2时,乙装置纯铜电极质量增加12.8g D.丙装置中,Na+由铁极区经过X膜进入石墨极区 7、用惰性电极电解物质的量浓度相同、体积比为3:1的CuSO4溶液和NaCl溶液的混合溶液,不可能发生的反应是( ) A.2Cl﹣+2H2O2OH﹣+H2↑+Cl2↑ B.Cu2++2Cl﹣Cu+Cl2↑ C.2Cu2++2H2O2Cu+4H++O2↑ D.2H2O2H2↑+O2↑ 8、某兴趣小组设计如图所示的微型实验装置(两电极均套在一大试管内)。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现有电流产生。下列有关描述正确的是( ) A.断开K1,闭合K2时,铜电极为阳极 B.断开K1,闭合K2时,石墨电极为正极 C.闭合K1,断开K2时,总反应的离子方程式为: 2H++2Cl-Cl2↑+H2↑ D.闭合K1,断开K2时,石墨电极附近溶液变红 9、已知反应AsO43—+2I—+2H+AsO33—+I2+H2O是可逆反应。设计如图装置(盐桥中的阴、阳离子可以自由移动,盐桥在原电池中不参与反应,只起导体作用),分别进行下述操作:(Ⅰ)向B烧杯中逐滴加入浓盐酸,(Ⅱ)向B烧杯中逐滴加入浓NaOH溶液。结果均发现电流计指针偏转。下列判断正确的是( ) A.两次操作过程中指针偏转方向相同 B.两次操作电流表指针均最终均长时间稳定在某一电流值 C.(Ⅱ)操作过程中C2棒上发生的反应为: AsO43—+2e—+2H+= AsO33-+H2O D.(Ⅰ)操作过程中C1棒上发生的反应为:2I——2e—= I2 10、如图所示,装置A、B的烧杯中盛放的均是足量同浓度的H2SO4溶液,下列说法错误的是( ) A.A装置为原电池,B为电解池 B.A装置的Zn电极的电极反应式:Zn – 2e- = Zn2+ C.当A装置的烧杯中产生0.1mol气体时,B装置中Fe电极质量会增加6.4g D.B装置中H2SO4溶液的浓度会减少 11、高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,充放电时的总反应式为3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。则错误的是( ) A.放电时,负极反应式为Zn-2e-+2OH-===Zn(OH)2 B.放电时,电解质溶液的pH不断增大 C.充电时,电池的锌电极接电源的负极 D.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原 12、为了减轻大气污染,可以利用反应:2NO(g) + 2CO(g) N2(g) + 2CO2(g)处理汽车尾气。则下列说法错误的是( ) A.该反应为吸热反应 B.该反应在低温下容易进行 C.除了判断该反应进行的方向,还需研究该反应的化学反应速率和反应物的转化率 D.对该反应方向起决定性作用的是焓变 13、1000K时,反应Ni(s) +H2O(g)NiO(s) + H 2(g)在一恒容密闭容器中进行,已知此时该反应的平衡常数K=0.0059。下列说法能说明该反应已达平衡状态的是( ) A.容器内压强不再变化 B.混合气体的密度不再变化 C.水蒸气和氢气的物质的量浓度相等D.1molH-O键断裂的同时,有1molH-H键断裂 14、在一体积可变的密闭容器中,加入一定量的A、B,发生反应:mA(g)+nB(g)pC(g) △H=Q kJ·mol-1,反应达到平衡时,B的物质的量浓度与温度、气体体积的关系如下表所示。下列判断正确的是( ) A.m+n>pQ>0 B.m+n>pQ<0 C.m+n查看更多