- 2021-08-06 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学(素质班)卷·2018届江西省景德镇市第一中学高二上学期期末考试(2017
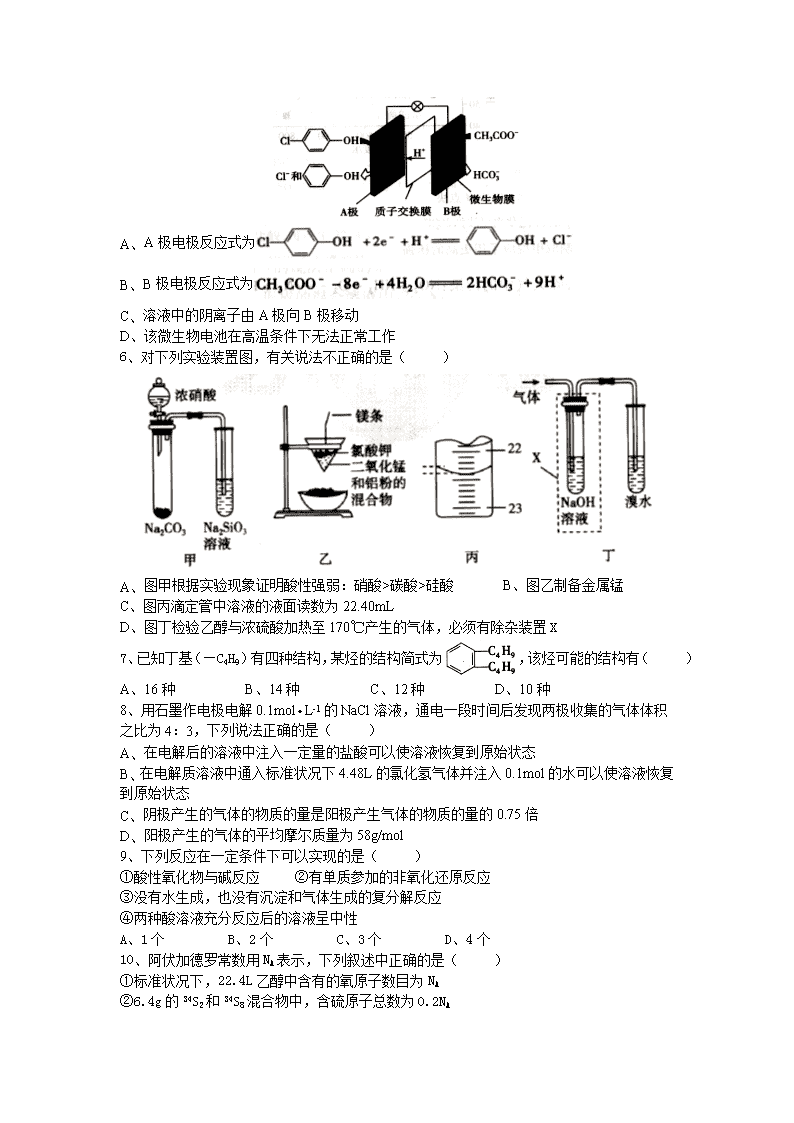
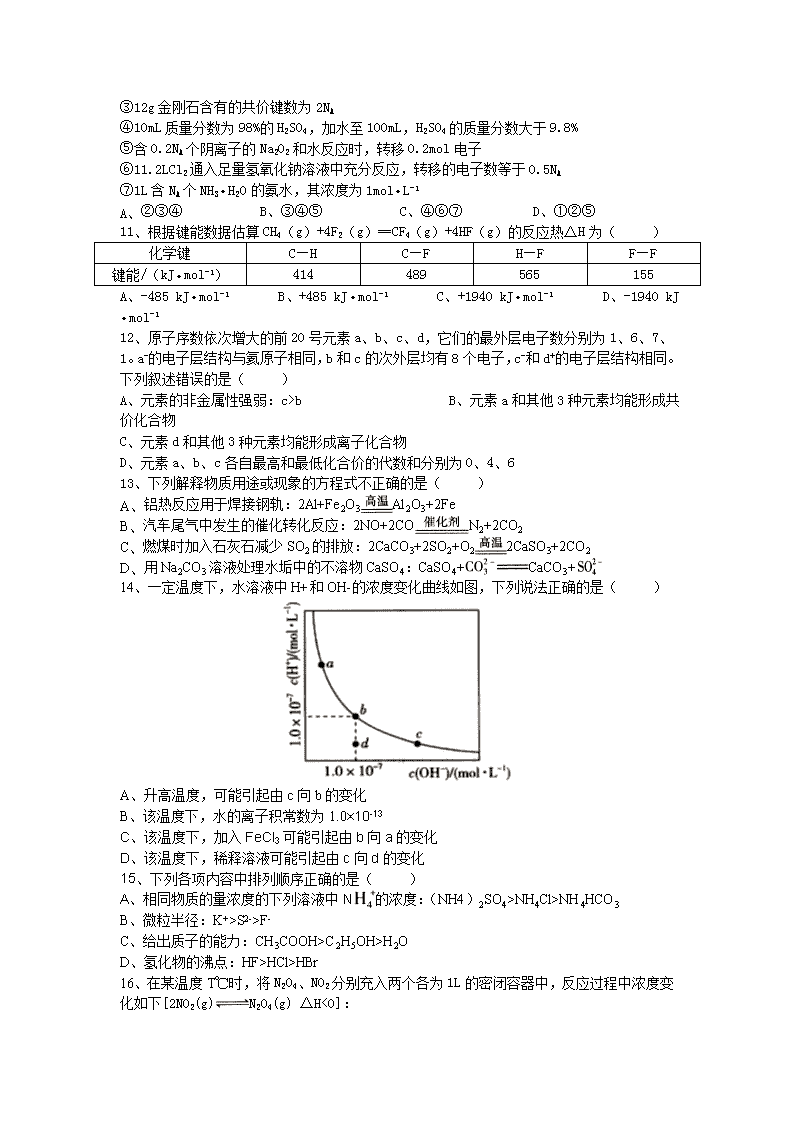
高二素质班期末考试化学测试卷 可能用到的相对原子质量: 一、单选题 1、化学与生产、生活、社会密切相关。下列说法中正确的是( ) A、 铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮吸能够引起铅中毒 B、 “轻轨电车”是一种交通工具,当电车启动时,电车电刷与导线的接触点上由于摩擦会产生高温,因此接触点上的材料应该选用耐高温、能导电的物质,石墨恰好合适 C、 为防止中秋月饼等富含脂质食品氧化变质,常在包装袋中放入生石灰 D、 双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害 2、下列物质与其用途完全符合的有几项( ) ①SiO2——太阳能电池 ②NH3——制硝酸 ③NaCl——制纯碱 ④Al2O3——焊接钢轨 ⑤NaClO——消毒剂 ⑥MgO——耐火材料 ⑦H2SO4——制炸药 ⑧Na2CO3——制水泥 A、4 B、5 C、6 D、7 3、我国学者成功发现了新一类水分解产氢催化剂:通过调控三氧化钨(WO3)局部原子结构,制备出深蓝色钨氧化物(WO2.9),该种钨的氧化物能高效而快速地催化水分解产生H2。下列有关说法正确的是( ) A、 WO3和WO2.9是同分异构体 B、由WO3制备WO2.9的过程发生了氧化还原反应 C、18gH2O在WO2.9的高效催化下产生H2体积为22.4L D、利用这种新型催化剂分解水的同时可放出热量 4、下列实验能获得成功的是( ) 选项 实验目的 实验步骤 A 比较CH3COOH和H2CO3酸性强弱 测同浓度的Na2CO3、CH3COONa溶液的pH B 比较S和Si非金属性强弱 向Na2SiO3溶液中通入SO2出现浑浊 C 除去KNO3中少量NaCl 将混合物制成热的饱和溶液,冷却结晶,过滤 D 探究蔗糖水解的产物中是否含有葡萄糖 取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并且加热 5、科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图所示。下列有关说法错误的是( ) A、 A极电极反应式为 B、 B极电极反应式为 C、 溶液中的阴离子由A极向B极移动 D、该微生物电池在高温条件下无法正常工作 6、对下列实验装置图,有关说法不正确的是( ) A、 图甲根据实验现象证明酸性强弱:硝酸>碳酸>硅酸 B、图乙制备金属锰 C、图丙滴定管中溶液的液面读数为22.40mL D、图丁检验乙醇与浓硫酸加热至170℃产生的气体,必须有除杂装置X 7、已知丁基(—C4H9)有四种结构,某烃的结构简式为,该烃可能的结构有( ) A、16种 B、14种 C、12种 D、10种 8、用石墨作电极电解0.1molL-1的NaCl溶液,通电一段时间后发现两极收集的气体体积之比为4:3,下列说法正确的是( ) A、 在电解后的溶液中注入一定量的盐酸可以使溶液恢复到原始状态 B、 在电解质溶液中通入标准状况下4.48L的氯化氢气体并注入0.1mol的水可以使溶液恢复到原始状态 C、 阴极产生的气体的物质的量是阳极产生气体的物质的量的0.75倍 D、 阳极产生的气体的平均摩尔质量为58g/mol 9、下列反应在一定条件下可以实现的是( ) ①酸性氧化物与碱反应 ②有单质参加的非氧化还原反应 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④两种酸溶液充分反应后的溶液呈中性 A、1个 B、2个 C、3个 D、4个 10、阿伏加德罗常数用NA表示,下列叙述中正确的是( ) ①标准状况下,22.4L乙醇中含有的氧原子数目为NA ②6.4g的34S2和34S8混合物中,含硫原子总数为0.2NA ③12g金刚石含有的共价键数为2NA ④10mL质量分数为98%的H2SO4,加水至100mL,H2SO4的质量分数大于9.8% ⑤含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子 ⑥11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA ⑦1L含NA个NH3H2O的氨水,其浓度为1molL-1 A、 ②③④ B、③④⑤ C、④⑥⑦ D、①②⑤ 11、根据键能数据估算CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为( ) 化学键 C—H C—F H—F F—F 键能/(kJmol-1) 414 489 565 155 A、-485 kJmol-1 B、+485 kJmol-1 C、+1940 kJmol-1 D、-1940 kJmol-1 12、原子序数依次增大的前20号元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦原子相同,b和c的次外层均有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( ) A、元素的非金属性强弱:c>b B、元素a和其他3种元素均能形成共价化合物 C、元素d和其他3种元素均能形成离子化合物 D、元素a、b、c各自最高和最低化合价的代数和分别为0、4、6 13、下列解释物质用途或现象的方程式不正确的是( ) A、 铝热反应用于焊接钢轨:2Al+Fe2O3Al2O3+2Fe B、 汽车尾气中发生的催化转化反应:2NO+2CON2+2CO2 C、 燃煤时加入石灰石减少SO2的排放:2CaCO3+2SO2+O22CaSO3+2CO2 D、 用Na2CO3溶液处理水垢中的不溶物CaSO4:CaSO4+CaCO3+ 14、一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( ) A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10-13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化 15、下列各项内容中排列顺序正确的是( ) A、相同物质的量浓度的下列溶液中N的浓度:(NH4)2SO4>NH4Cl>NH4HCO3 B、微粒半径:K+>S2->F- C、给出质子的能力:CH3COOH>C2H5OH>H2O D、氢化物的沸点:HF>HCl>HBr 16、在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g)N2O4(g) △H<0]: 容器 物质 起始浓度/(molL-1) 平衡浓度/(molL-1) Ⅰ N2O4 0.100 0.040 NO2 0 0.120 Ⅱ N2O4 0 0.0142 NO2 0.100 0.0716 下列说法不正确的是( ) A、 平衡时,Ⅰ、Ⅱ中反应的转化率(N2O4)>(NO2) B、 平衡后,升高相同温度,以N2O4表示的反应速率(Ⅰ)<(Ⅱ) C、 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(Ⅰ)= D、 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 二、非选择题 17、肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4H2O): NaClO过量时,易发生反应: 实验一:制备NaClO溶液(实验装置如图甲所示) (1) 锥形瓶中发生反应的离子方程式是 。 实验二:制取水合肼(实验装置如图乙所示) 控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分。 (1) 分液漏斗中的溶液是 (填序号); A、 CO(NH2)2溶液 B、NaOH溶液 C、NaOH和CO(NH2)2混合溶液 D、NaOH和NaClO混合溶液 选择的理由是 。 实验三:测定馏分中肼含量 称取馏分5.000g加入适量NaHCO3固体,加入配成250mL溶液,移出25.00mL,用0.1000mol/L的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右(已知:N2H4H2O+2I2═N2↑+4HI+H2O)。 (3) 配制250mL溶液所需仪器除分析天平、烧杯、玻璃棒外,还需 。 (4) 滴定过程中,NaHCO3能控制溶液的pH在6.5左右,用离子方程式解释其原因: 。 (5) 实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4H2O)的质量分数为 。 18、Ⅰ.已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按如下框图进行反应。 回答下列问题: (1) 组成单质A、B、C的三种元素中的任意两种元素形成的化合物所属物质类别一定不是 。 ①氢化物 ②酸 ③碱 ④盐 ⑤氧化物 (2) 如果E溶液是一种强酸,则E的化学式为 。 Ⅱ.下图是一些常见元素的单质或化合物之间的转化关系。溶液中的水以及部分反应物或生成物未标出。A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,并且C的原子数、最外层电子数之和与SiC相同,J是一种能引起温室效应的气体,K是两性化合物。反应③、④、⑤用于工业中生产H。 回答下列问题: (1) 写出A的电子式: ,G的化学式: ; (2) 写出D和H反应的化学方程式: ; (3) 写出反应⑥的离子方程式: ; (4) B和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料。反应① 是科学家研究开发制备该纳米级复合粉末的最新途径。已知B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1:4,写出反应①的化学方程式: 。 19、 锰的化合物种类较多,大多具有广泛的用途。 Ⅰ.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性。某化学兴趣小组通过实验探究MnO2的性质。 (1) 该小组设计了如下4个方案以验证MnO2的氧化性,可行的是 (填序号)。 A、 把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成 B、 把MnO2固体加入到H2O2溶液中,观察是否有气泡产生 C、 Na2SO3溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成 D、 FeSO4溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红 (2) 为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL0.2mol/L NaOH溶液、1mL水、1mL0.1mol/L稀硫酸。现象记录如表所示: 试管编号 实验现象 A 溶液不变色 B 溶液缓慢变浅棕褐色 C 溶液迅速变棕褐色 ①从以上实验中,我们可以得出的结论是 。 ②写出C试管中发生反应的离子方程式: 。 Ⅱ.铁酸锰(MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机。MnFe2O4的制备工艺流程如图: 已知:Fe3+、Mn2+沉淀的pH如表格所示。 开始沉淀 完全沉淀 Fe3+ 2.7 4.2 Mn2+ 8.3 10.4 (1) 步骤一中投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比理论上应为 。 (2) 步骤二中需控制pH的范围是 。 (3) 步骤三中是否洗涤干净的判断方法是 。 三、 (二选一,考生请在两道题中选做一道) 20、氧化锌、氮化镓及新型多相催化剂组成的纳米材料能利用可见光分解水,生成氢气和氧气。 (1) Zn2+基态核外电子排布式为 ,其核外存在 对自旋相反的电子。 (2) 写出两个与水分子具有相同空间构型的分子和阴离子: , 。 (3) 水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+ )。下列对上述过程的描述不合理的是 (填序号)。 A、 氧原子的杂化类型发生了改变 B、微粒的空间构型发生了改变 C、微粒的化学性质发生了改变 D、微粒中的键角发生了改变 (4) 在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图甲),已知冰的升华热是+51kJmol-1,除氢键外,水分子间还存在范德华力(11kJmol-1),则冰晶体中氢键的键能是 kJmol-1。 (5) 氮化镓的晶体结构如图乙所示,其中氮原子的杂化轨道类型是 ;N、Ga原子之间存在配位键,该配位键中提供电子对的原子是 ;该晶体的化学式为 。金刚砂(SiC)和氮化镓并称为第三代半导体材料的双雄,它与金刚石具有相似的晶体结构,试比较金刚石和金刚砂的熔点高低,并说明理由: 。 (6) 某种ZnO晶体的晶胞如图丙所示,Zn2+的配位数为 ,其晶胞中Zn2+和O2-之间的距离为apm,列式表示该晶体的密度: gcm-3(不必计算结果)。 21、石油的裂解是石油化工的重要方法之王,石油的裂解产物是合成材料的重要的基础原料。例如工业上以丙烯为原料可制得一种重要合成橡胶IR和一种合成树脂X。 B的分子式是C6H6O,可与NaOH溶液反应。 已知以下信息: (—R、—R’、—R’’表示可能相同或可能不同的原子或原子团。) Ⅲ.同一碳原子上有两个碳碳双键时,分子不稳定。 请回答下列问题。 (1) 在一定条件下,丙烯可与下列物质反应的是 。 A、 H2O B、NaOH溶液 C、Br2的CCl4溶液 D、酸性KMnO4溶液 (2) A与C2H2合成D的化学方程式是 ,反应类型是 。 (3) E、F中均含有碳碳双键,则E的结构简式是 。 (4) H的结构简式是 。 (5) B与C在一定条件下反应生成合成树脂X的化学方程式是 。 (6) 有多种同分异构体,符合下列要求的有 种,其中在核磁共振氢谱中只出现四组峰的有 种。 ① 能与FeCl3溶液反应显紫色 ②只能发生银镜反应,不能发生水解反应 高二素质班期末考试化学答案 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 B B B C C A D D D B D B C C A B 17、(1)Cl2+2OH-=Cl-+ClO-+H2O (2)D 如果次氯酸钠装在烧瓶中,因过量而使N2H4H2O氯化 (3)250mol容量瓶,胶头滴管 (4)Hl+H+═H2O+CO2↑ (5)10% 18、Ⅰ(1)③⑤ (2)HCl Ⅱ(1):NN: NO (2)C+4HNO3CO2↑+4NO2↑+2H2O (3)CO2+2Al+3H2O═2A(COH)3↓+C (4)Al4SiC4+2N24AlN+SiC+3C 19、Ⅰ(1)D (2)①酸性越强,MnO2的氧化能力越强 ②MnO2+4H++2I-═Mn2++I2+2H2O Ⅱ(1)2:1 (2)PH10.4 (3)最后的洗涤液量中性 20、(1)[Ar]3Cl10 14 (2)H2S,NH (3)A (4)20 (5)SP3 N GaN 金刚石的熔点高于金刚砂的熔点,因为碳原子半径小于硅原子半径,所以C-C键的键长小于C-Si键 (6)8 21、(1)acd (2) O OH || KOH | H-C三C-H+CH3-C-CH3H-C三C-C-CH3 加成反应 | CH3 (3) OH | H2C=CH-C-OH3 | CH3 (4) (5) (6)6 2查看更多