- 2021-08-06 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
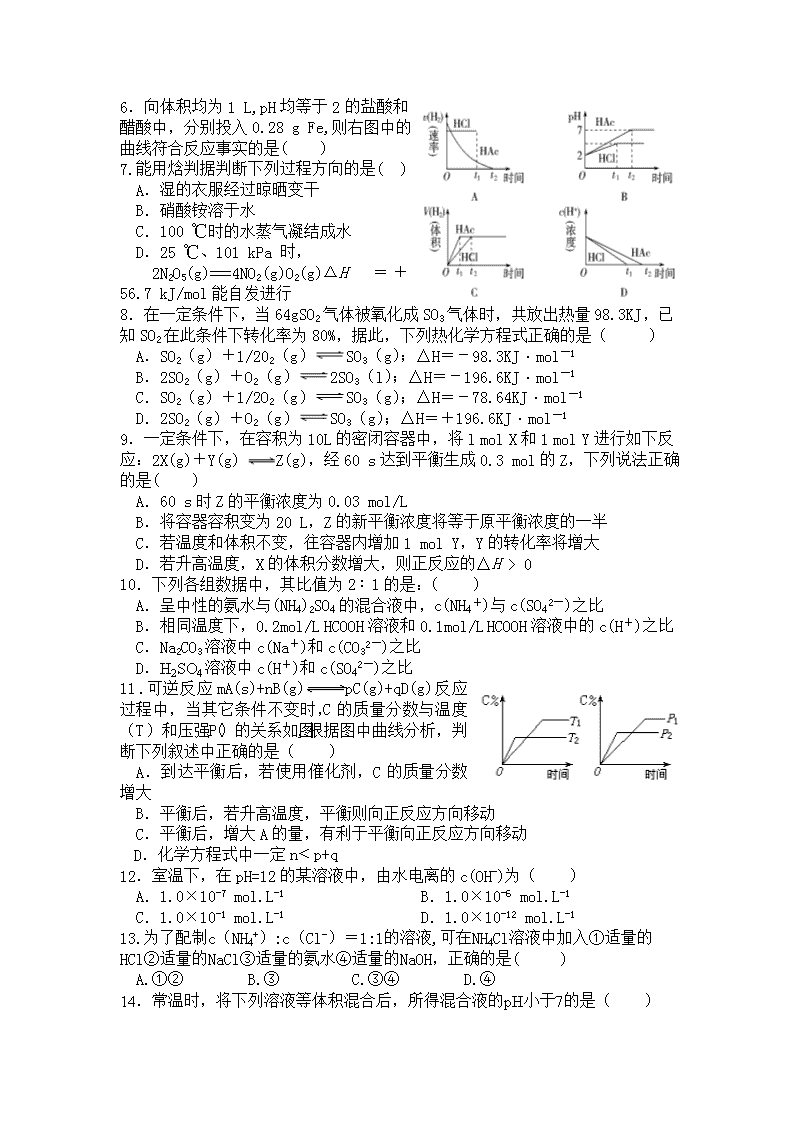
化学卷·2018届河南省安阳市第三十六中学高二上学期期中考试(2016
安阳市第三十六中学2016—2017学年上学期期中考试试题 高二化学 命题人:王保才 HUBEIZHAN本试卷分第Ⅰ卷和第Ⅱ卷两部分,考试时间90分钟,满分100分。 可能用到的相对原子质量:Fe:56 A1:27 H:1 O:16 S:32 第I卷 选择题(共60分) 一、选择题(每小题只有一个选项符合题意,每小题3分。共60分) 1.用已知浓度的酸滴定未知浓度的碱时,导致待测碱液的浓度偏低的是( ) ①酸式滴定管用蒸馏水洗后,未用标准液润洗 ②碱式滴定管用蒸馏水洗后,未用待测液润洗 ③配制碱液时,称量的固体吸潮 ④滴定前酸式滴定管尖嘴部分未充满溶液 ⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外 A. ①③④ B. ②⑤ C. ②③⑤ D. ①③ 2.已知热化学方程式: ① C2H2(g) +O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1 ② C(s)+ O2(g) == CO2(g) △H2=-393.5 kJ•mol-1 ③ H2(g)+ O2(g) == H2O(1) △H3 = -285.8 kJ·mol-1 则反应④ 2C(s)+ H2(g) == C2H2(g)的△H为( ) A. +228.2 kJ·mol-1 B. -228.2 kJ·mol-1 C. +1301.0 kJ·mol-1 D. +621.7 kJ·mol-1 3.某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4.在调节溶液pH值时,应选用的试剂是( ) A. NaOH B. ZnO C. ZnSO4 D. Fe2O3 4.在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOHCH3COO-+H+ 对于该平衡,下列叙述正确的是( ) A.加入水时,平衡向逆反应方向移动 B.加入少量NaOH固体,平衡向正反应方向移动 C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 D.加入少量CH3COONa固体,平衡向正反应方向移动 5.在下列四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有() A、滴加石蕊试液显红色的溶液:Fe3+ 、NH4+ 、Cl- 、I- B、pH值为1的溶液:Cu2+、Na+ 、Mg2+、NO3- C、水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ D、所含溶质为Na2SO4的溶液:K+ 、CO32-、NO3-、Al3+ 6.向体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.28 g Fe,则右 图中的曲线符合反应事实的是( ) 7.能用焓判据判断下列过程方向的是( ) A.湿的衣服经过晾晒变干 B.硝酸铵溶于水 C.100 ℃时的水蒸气凝结成水 D.25 ℃、101 kPa 时, 2N2O5(g)===4NO2(g)O2(g)ΔH=+56.7 kJ/mol能自发进行 8.在一定条件下,当64gSO2气体被氧化成SO3气体时,共放出热量98.3KJ,已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是( ) A.SO2(g)+1/202(g)SO3(g);△H=-98.3KJ·mol-1 B.2SO2(g)+O2(g)2SO3(l);△H=-196.6KJ·mol-1 C.SO2(g)+1/2O2(g)SO3(g);△H=-78.64KJ·mol-1 D.2SO2(g)+O2(g)SO3(g);△H=+196.6KJ·mol-1 9.一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:2X(g)+Y(g) Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( ) A.60 s时Z的平衡浓度为0.03 mol/L B.将容器容积变为20 L,Z的新平衡浓度将等于原平衡浓度的一半 C.若温度和体积不变,往容器内增加1 mol Y,Y的转化率将增大 D.若升高温度,X的体积分数增大,则正反应的△H > 0 10.下列各组数据中,其比值为2∶1的是:( ) A.呈中性的氨水与(NH4)2SO4的混合液中,c(NH4+)与c(SO42-)之比 B.相同温度下,0.2mol/L HCOOH溶液和0.1mol/L HCOOH溶液中的c(H+)之比 C.Na2CO3溶液中c(Na+)和c(CO32-)之比 D.H2SO4溶液中c(H+)和c(SO42-)之比 11.可逆反应mA(s)+nB(g)pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( ) A.到达平衡后,若使用催化剂,C的质量分数增大 B.平衡后,若升高温度,平衡则向正反应方向移动 C.平衡后,增大A的量,有利于平衡向正反应方向移动 D.化学方程式中一定n﹤p+q 12.室温下,在pH=12的某溶液中,由水电离的c(OH -)为( ) A.1.0×10-7 mol.L-1 B.1.0×10-6 mol.L-1 C.1.0×10-1 mol.L-1 D.1.0×10-12 mol.L-1 13.为了配制c(NH4+):c(Cl-)=1:1的溶液,可在NH4Cl溶液中加入①适量的HCl②适量的NaCl③适量的氨水④适量的NaOH,正确的是( ) A.①② B.③ C.③④ D.④ 14.常温时,将下列溶液等体积混合后,所得混合液的pH小于7的是( ) A.pH为2的醋酸溶液与pH为12的氢氧化钠溶液 B.0.0l mol·L-1 的醋酸溶液与0.01 mol·L-1的氢氧化钠溶液 C. pH为2的硫酸溶液与pH为12的氢氧化钠溶液 D.0.010 mol·L-1的盐酸溶液与0.010 mol·L-1的氢氧化钡溶液 15.向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起 始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( ) A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 16. 物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3 ④NH4HSO4 ⑤NH4Cl ⑥NH3·H2O;按c(NH4+)由小到大的排列顺序正确的是( ) A.③⑤④⑥①③ B.⑥③⑤④①② C.⑥⑤③④①② D.⑥③⑤④②① 17.对于难溶盐MX,其饱和溶液中M+和X-浓度之间的关系为Ksp=c(M+)•c(X-),现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是 ( ) ①20mL0.01mol•L-1 KCl溶液;②30mL0.02mol•L-1CaCl2溶液;③40mL0.03mol•L-1HCl溶液;④10mL蒸馏水;⑤50mL0.05mol•L-1AgNO3溶液 A. ①>②>③>④>⑤ B. ④>①>③>②>⑤ C. ⑤>④>②>①>③ D. ④>③>⑤>②>① 18.将0.2mol/LCH3COOK与0.1mol/L盐酸等体积混合后,溶液中下列粒子的物质的量浓度的关系正确的是 ( ) A.c(CH3COO-) = c(Cl-) > c(H+) > c(CH3COOH) B.c(CH3COO-) = c(Cl-) > c(CH3COOH) > c(H+) C.c(CH3COO-) > c(Cl-) > c(H+) > c(CH3COOH) D.c(CH3COO-) > c(Cl-) > c(CH3COOH) > c(H+) 19.25℃时,某强酸溶液pH=a,强碱溶液pH=b,且a+b=12,酸碱溶液混合后溶液的pH=7,则酸溶液的体积(V1)与碱溶液的体积(V2)的关系是( ) A.V1=102V2 B.V2=102V1 C. V1=2V2 D. V2=2V1 20.25℃时,在溶液中逐滴加入醋酸溶液,pH的变化曲线如右图所示,有关粒子浓度关系的比较中,不正确的是 ( ) A.在A点: B.在B点: C.在C点: D.在C点: 考场 班级 姓名 考号 第II卷 非选择题(共40分) 21.(10分)写出下列物质的电离方程式(在水溶液中) (1)NH3·H2O_____________________________________; (2)H2CO3_____________________________ __________; (3)NaHSO4__________________________ __________; (4)NaHCO3_____________________ _______________; (5)Fe(OH)3______________ ____________ ___。 22.(10分)回答下列问题: (1)把FeCl2溶液加热蒸干,灼烧,最后得到的主要固体产物是 (2)纯碱溶液能除去油污。原因是(用离子方程式表示,下同) (3)明矾[KAl(SO4)2·12H2O]能做净水剂的原因是 (4)配制硫酸铜溶液,经常先把晶体溶于少量稀硫酸后,再加水稀释成溶液。 原因是 (5)铵态氮肥与草木灰(成分是K2CO3)不能混合施用。原因是 23.(8分)在一定体积的密闭容器中,进行如下反应: CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示: t℃ 700 800 830 1000 1200 K 0.6 0.9 1.0 1.7 2.6 回答下列问题: ⑴该反应化学平衡常数的表达式:K= ; ⑵该反应为 (填“吸热”或“放热”)反应; ⑶下列说法中能说明该反应达平衡状态的是 A、容器中压强不变 B、混合气体中c(CO)不变 C、混合气体的密度不变 D、c(CO) = c(CO2) E、化学平衡常数K不变 F、单位时间内生成CO的分子数与生成CO2的分子数相等 ⑷某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为 。 24.(12分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。 阳离子 H+、Na+、A13+、Ag+、Ba2+ 阴离子 OH—、C1—、CO32—、NO3—、SO42— 已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。 ②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。 ③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。 试回答下列问题:(1)分别写出A、C、E的化学式: A 、C 、E ; (2)写出A、E反应的离子方程式: ; (3)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序: 。 (4)在100 mL 0.1 mol·L-1 E溶液中,逐滴加入40 mL 1.6 mol·L-1 NaOH溶液,最终得到沉淀物质的量为 mol。 安阳市第三十六中学2016—2017学年上学期期中考试试题 高二化学 参考答案 选择题 1、C 2、A 3、B 4、B 5、B 6、C 7、C 8、A 9、A 10、A 11、D 12、D 13、B 14、A 15、B 16、B 17、B 18、D 19、A 20、A 非选择题 21、(1)NH3·H2O NH4++OH- (2)H2CO3 HCO3-+ H+ HCO3- CO32—+ H+ (3)NaHSO4 == Na++H++SO42- (4)NaHCO3 == Na++ HCO3- (5)Fe(OH)3 Fe3++ 3OH- 22、 (1) Fe2O3 (2)CO32-+ H2O HCO3-+OH- HCO3-+ H2O H2CO3+OH- (3)A13+ +3 H2O A1(OH)3(胶体) (4)Cu2++2 H2O Cu(OH)2+2H+ (5) 2NH4+ + CO32-==2NH3↑ +H2O +CO2↑ 23、(1) (2)吸热 (3)B F (4)830℃ 24、(1)Na2CO3 、 HC1 、 (A1) 2( SO4)3 (2)3CO32-+ 2A13++3 H2O==2 A1(OH)3↓ +3CO2↑ (3)c(Na+)>c(HCO3—)>c(OH—)>c(H+)>c(CO32—) (4)0.016 查看更多