- 2021-08-06 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新教材高中化学第四章材料家族中的元素第二节第1课时铝与铝合金课件鲁科版必修1
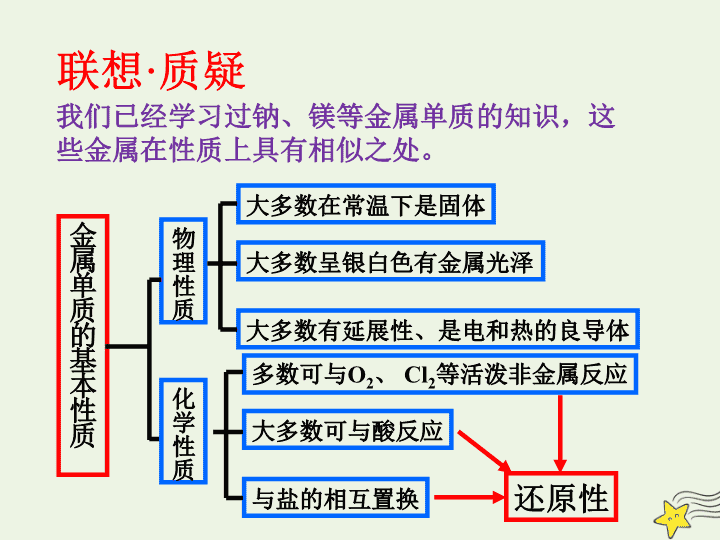
第 2 节 铝 金属材料 学习目标 第 1 课时 铝 金属材料 1. 了解 铝的物理性质和化学性质 。 2. 了解铝的用途 铝 联想 · 质疑 金属单质的基本性质 物理性质 化学性质 大多数在常温下是固体 大多数呈银白色有金属光泽 大多数有延展性、是电和热的良导体 多数可与 O 2 、 Cl 2 等活泼非金属反应 大多数可与酸反应 与盐的相互置换 还原性 我们已经学习过钠、镁等金属单质的知识,这些金属在性质上具有相似之处。 银白色金属光泽的轻金属 良好的延展性、导电性和导热性 一、铝的物理性质 - 3 e - Al 3+ +13 8 2 分析结构 推测性质 铝比较活泼,具有 还原性 Al +13 8 2 3 根据金属活动性顺序表,铝比铁活泼,但铝为什么却不像铁那样容易被空气腐蚀 ? 思考与探究 1 、 常温下,铝在空气中会发生氧化产生 致密氧化膜,保护铝不再被氧气氧化 。 加热时,铝在纯氧中燃烧、铝与氯气、硫等非金属反应 2Al+3Cl 2 = 2AlCl 3 点燃 2Al+3S = Al 2 S 3 加热 二、铝的化学性质 2 、与水反应 2Al+6H 2 O===2Al(OH) 3 ↓ +3H 2 ↑ (了解) Al 与冷水不反应,可以在沸水中发生缓 慢反应 将两张滤纸都折漏斗状,套在一起,使四周都有四层。取出内层,在底部剪一个孔,用 水 润湿,再和另一个漏斗套在一起,架在铁圈上,下面放置盛沙的蒸发皿。 把炒干的 氧化铁粉末和铝粉 混合均匀,放在纸漏斗中, 上面加少量氯酸钾并在混合物中间插一根镁条 ,用小木条引燃镁条,观察现象 。 3 、与某些金属氧化物反应 现象 2 Al +Fe 2 O 3 ===== 高温 剧烈反应,发出耀眼的光芒,产生大量的烟,纸漏斗被烧穿,有红热液珠落下,液珠冷却后变为黑色。 2 Fe +Al 2 O 3 ③哪些金属氧化物可以与铝粉发生类 似的反应 ? ② 找出氧化剂、还原剂、氧化产物、 还原产物。 ① 上述反应属于四种基本反应类型的 哪一类? 置换反应 铝热反应 铝在高温条件下和( 活泼性小于铝的 )金属氧化物发生的反应 铝热剂 铝粉和(活泼性小于铝的)金属氧化物的混合物 归纳总结 镁条、氯酸钾的作用? 放热提供能量;助燃剂 铝热反应的原理? ① Al 在高温下表现出强还原性,把某些金属从它的氧化物中置换出来。 ② 反应放热 铝热反应的应用: 焊接铁轨、定向爆破、冶炼难熔金属。 a) 与稀盐酸、稀硫酸发生置换反应 b) 常温下,铝遇 冷 浓硝酸、 冷 浓硫酸发生 钝化 反应( 钝化属于化学变化) 铝制槽罐用于浓硝酸运输 4 、与酸反应 2Al+6H + = = 2Al 3+ +3H 2 ↑ Al 与稀硝酸? Al+4HNO 3 ( 稀 )==Al(NO 3 ) 3 +NO↑+2H 2 O 练一练 写出下列铝热反应的化学反应方程式 ⑴ 铝与 MnO 2 反应 ⑵铝与 Cr 2 O 3 反应 ⑶铝与 Fe 3 O 4 反应 5 、与盐溶液的反应(如 与硫酸铜溶液) 2Al+3Cu 2+ ==3Cu+2Al 3+ 6 、铝与强碱反应 2Al+2NaOH+6H 2 O==2Na [Al(OH) 4 ] +3H 2 ↑ 四羟基合铝酸钠 现象:铝溶解,产生气泡。 2Al+2NaOH+6H 2 O=2Na[Al(OH) 4 ]+3H 2 ↑ 2Al+6HCl==2AlCl 3 +3H 2 ↑ 注意: 金属铝与酸、碱反应时放出氢气量的关系? 1 、酸碱过量,等量的铝产生的气体的物质的量之比? 2 、铝过量,等物质的量的酸、碱反应时产生的气体的 物质的量之比?查看更多