【化学】河南省临颍县南街高级中学2020届高三下学期第一次月考
河南省临颍县南街高级中学2020届高三下学期第一次月考
可能用到的相对原子质量:C 12 Fe 56
7.化学与社会、生活密切相关。对下列现象或事实的解释错误的是( )
选项
现象或事实
解释
A
食盐能腐蚀铝制容器
Al能与Na+发生置换反应
B
用铁罐贮存浓硝酸
常温下铁在浓硝酸中钝化
C
用(NH4)2S2O8蚀刻铜制线路板
S2的氧化性比Cu2+的强
D
漂白粉在空气中久置变质
Ca(ClO)2与CO2和H2O反应,生成的HClO分解
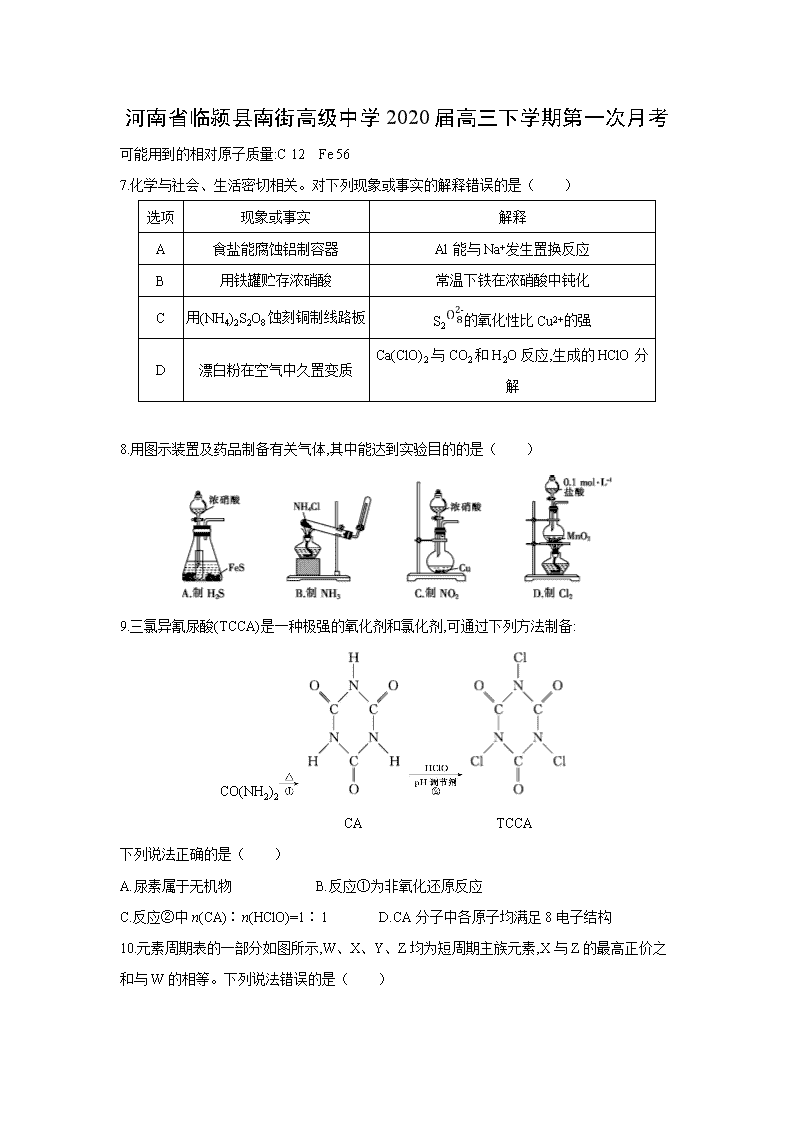
8.用图示装置及药品制备有关气体,其中能达到实验目的的是( )
9.三氯异氰尿酸(TCCA)是一种极强的氧化剂和氯化剂,可通过下列方法制备:
CO(NH2)2
CA TCCA
下列说法正确的是( )
A.尿素属于无机物 B.反应①为非氧化还原反应
C.反应②中n(CA)∶n(HClO)=1∶1 D.CA分子中各原子均满足8电子结构
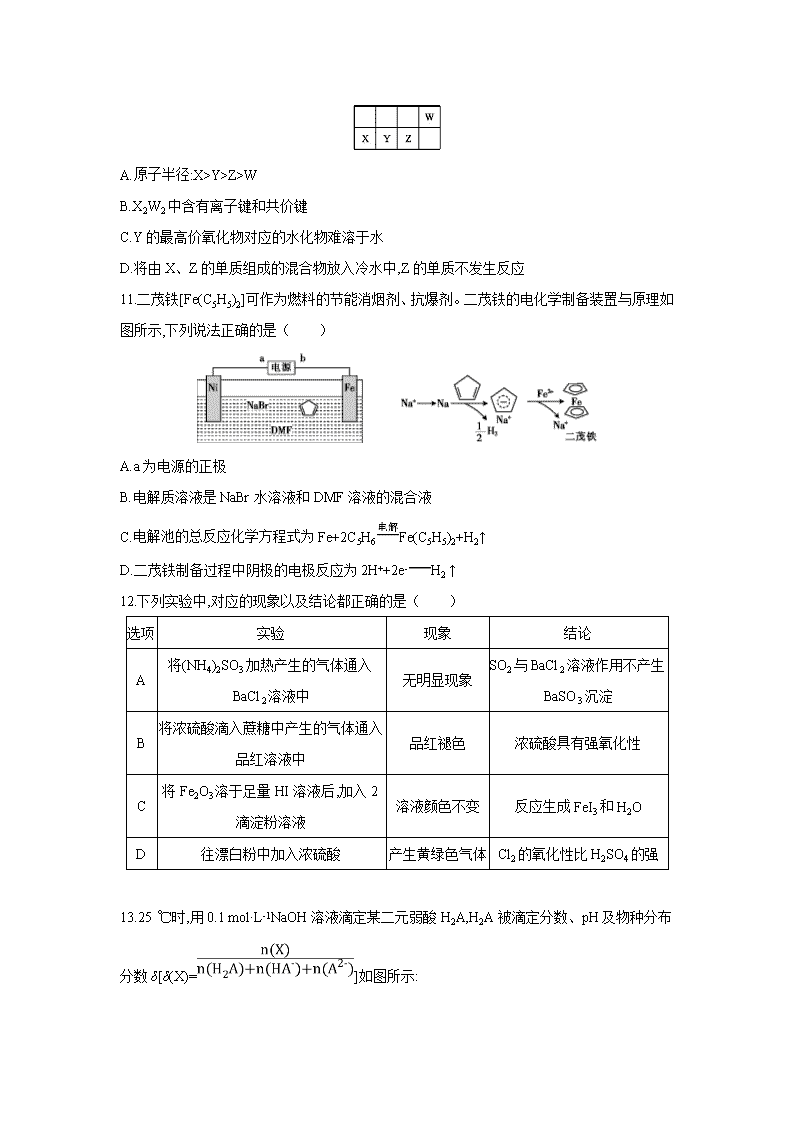
10.元素周期表的一部分如图所示,W、X、Y、Z均为短周期主族元素,X与Z的最高正价之和与W的相等。下列说法错误的是( )
A.原子半径:X>Y>Z>W
B.X2W2中含有离子键和共价键
C.Y的最高价氧化物对应的水化物难溶于水
D.将由X、Z的单质组成的混合物放入冷水中,Z的单质不发生反应
11.二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是( )
A.a为电源的正极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.电解池的总反应化学方程式为Fe+2C5H6Fe(C5H5)2+H2↑
D.二茂铁制备过程中阴极的电极反应为2H++2e-H2 ↑
12.下列实验中,对应的现象以及结论都正确的是( )
选项
实验
现象
结论
A
将(NH4)2SO3加热产生的气体通入BaCl2溶液中
无明显现象
SO2与BaCl2溶液作用不产生BaSO3沉淀
B
将浓硫酸滴入蔗糖中产生的气体通入品红溶液中
品红褪色
浓硫酸具有强氧化性
C
将Fe2O3溶于足量HI溶液后,加入2滴淀粉溶液
溶液颜色不变
反应生成FeI3和H2O
D
往漂白粉中加入浓硫酸
产生黄绿色气体
Cl2的氧化性比H2SO4的强
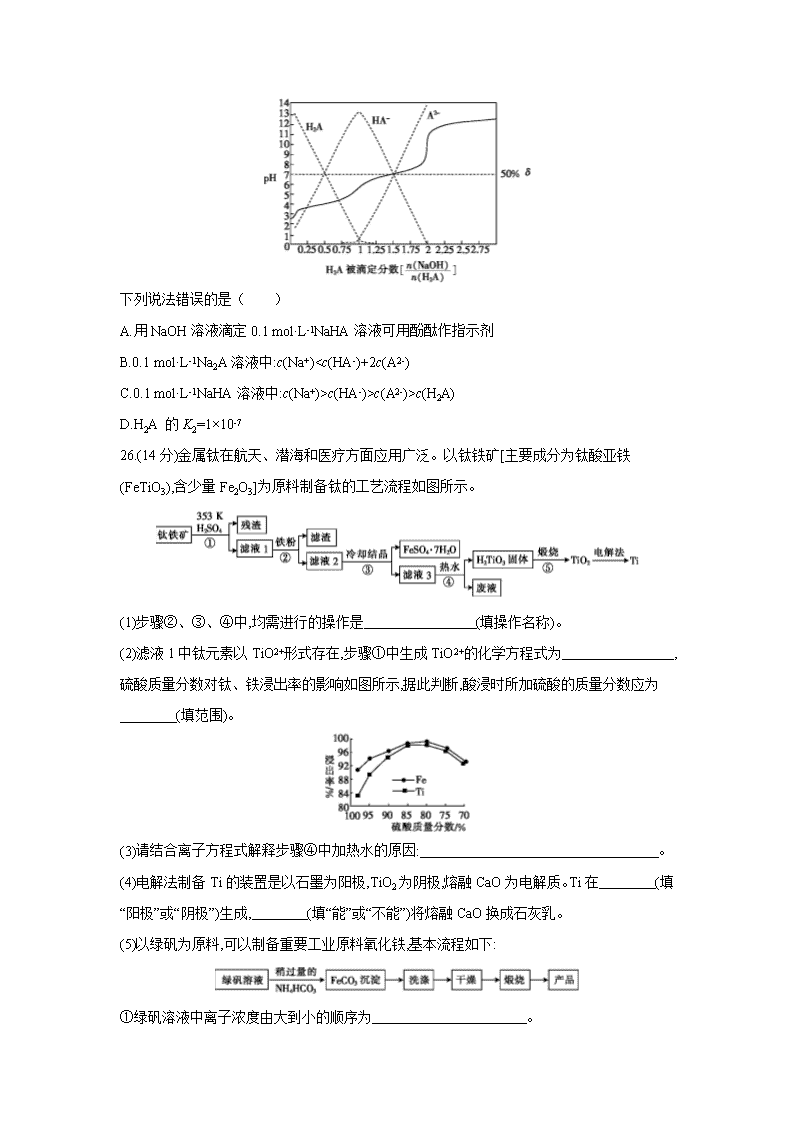
13.25 ℃时,用0.1 mol·L-1NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=]如图所示:
下列说法错误的是( )
A.用NaOH溶液滴定0.1 mol·L-1NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1Na2A溶液中:c(Na+)
c(HA-)>c(A2-)>c(H2A)
D.H2A 的K2=1×10-7
26.(14分)金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3]为原料制备钛的工艺流程如图所示。
(1)步骤②、③、④中,均需进行的操作是 (填操作名称)。
(2)滤液1中钛元素以TiO2+形式存在,步骤①中生成TiO2+的化学方程式为 ,硫酸质量分数对钛、铁浸出率的影响如图所示,据此判断,酸浸时所加硫酸的质量分数应为
(填范围)。
(3)请结合离子方程式解释步骤④中加热水的原因: 。
(4)电解法制备Ti的装置是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。Ti在 (填“阳极”或“阴极”)生成, (填“能”或“不能”)将熔融CaO换成石灰乳。
(5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下:
①绿矾溶液中离子浓度由大到小的顺序为 。
②FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)=1.0×10-5 mol·L-1。所得FeCO3中 (填“含”或“不含”)有Fe(OH)2。(已知: Ksp[Fe(OH)2] = 4.9×10-17)
27.(14分)实验室用酸性蚀刻废液(含Cu2+、H+、CuC、Cl-等)和碱性蚀刻废液[N、Cu(NH3、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
(1)步骤Ⅰ中发生了多个反应,其中Cu(NH3与盐酸反应生成Cu(OH)Cl的离子方程式为 。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是 。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、 、 。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。
①装置a中盛装浓硫酸的仪器的名称是 ,圆底烧瓶中发生反应的化学方程式为 。
②装置c中反应完成的现象是 。
③用装置d中的溶液洗涤制得的CuI的目的是 ,然后再用无水乙醇洗涤的目的是 。
28.(15分)雾霾由多种污染物形成,包含颗粒物(PM2.5)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:①2CO(g)+O2(g)2CO2(g) ΔH1=-566.0 kJ·mol-1
②2NO(g)+O2(g)2NO2(g) ΔH2=-116.5 kJ·mol-1
③N2(g)+O2(g)2NO(g) ΔH3=+180.5 kJ·mol-1
废气中NO2 与CO 转化成无污染气体的热化学方程式为 。
(2)研究发现利用NH3可除去硝酸工业尾气中的NO。NH3与NO的物质的量之比分别为1∶2、1∶1.5、3∶1时,NO脱除率随温度变化的曲线如图所示。
①曲线a中,NO的起始浓度为6×10-4 mg·m-3,从X点到Y点经过10 s,则该时间段内NO的脱除速率为 mg· m-3·s-1。
②曲线c对应的NH3与NO的物质的量之比是 ,其理由是 。
(3)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化氧可以快速氧化SO2。活化过程的能量变化模拟计算结果如图所示。
无水情况下,一个氧分子的活化能为 ,容易活化氧分子的条件是 (填“有水”或“无水”)。
(4)利用反应6NO2+8NH37N2+12H2O构成的电池既能有效消除氮氧化物的排放,减轻雾霾污染,又能充分利用化学能,装置如图所示。
①B极的电极反应式为 。
②若反应转移1.2 mol电子,A极生成N2的体积为 L(标准状况)。
35.[化学——物质结构与性质](15分)
(NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为 。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是 。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE()。
①CH3CN中碳原子的杂化方式是 和 。
②TCNE中第一电离能较大的是 (填元素符号),分子中所有原子 (填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:
Fe3C的密度为 (列出计算式)g·cm-3。
36.[化学——有机化学基础](15分)
花椒毒素(H)有抗实验性心律失常、镇痛、抗炎等作用。由芳香族化合物A为原料合成H的一种合成路线如下:
已知:+ClCH2CH2Cl+HCl。
回答下列问题:
(1)A的化学名称是 (用系统命名法)。
(2)G中所含官能团的名称是 。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中 (填“有”或“没有”)手性碳。
(4)反应⑥的反应类型是 。
(5)D的结构简式为 。
(6)F与足量NaOH溶液反应的化学方程式为 。
(7)芳香族化合物W是D的同分异构体,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应;W的核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1。符合上述要求的W有 种。
(8)有机物M()是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线。(无机试剂及有机溶剂任用)
【参考答案】