- 2021-08-06 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年湖南省六校隆回县一中高二优生1月联考化学试题
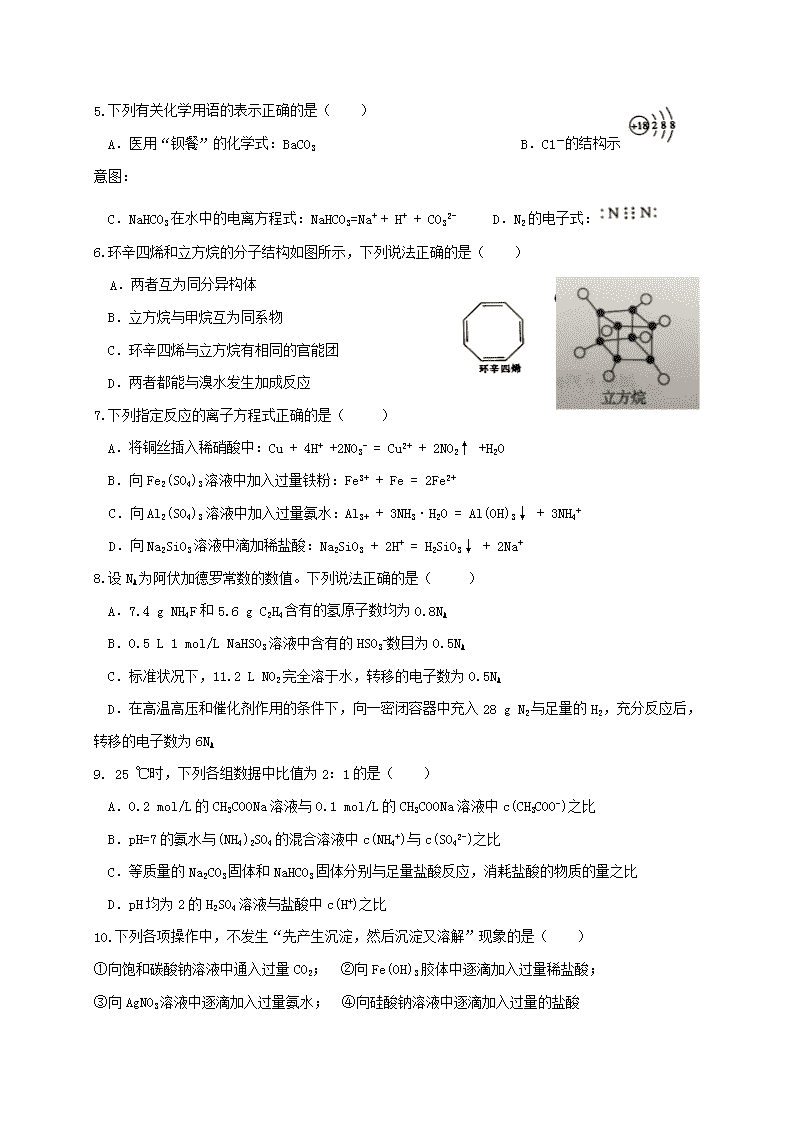
启用前☆保密 邵东县一中 邵阳市一中 邵阳市二中 武冈县二中 隆回县一中 双峰县一中 高二优生2018年1月联赛试卷 化 学 时量:90分钟 分值:100分 可能用到的相对原子质量:H-1 C-12 N-14 O-16 F-19 Fe-56 Cu-64 Ag-108 第Ⅰ卷(选择题 共50分) 一、选择题(本题为单选题,共10个小题,每小题2分,共计20分) 1.化学已经渗透到人类生活的方方面面。下列说法正确的是( ) A.“青蒿一握,以水二升渍,绞取汁”,该过程属于化学变化 B.去皮苹果放在空中久置变黄与纸张久置变黄原理相似 C.高纯硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” D.酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关 2.下列有关物质的性质与用途具有对应关系的是( ) A.MgO、Al2O3熔点高,均可用作耐高温材料 B.NH4HCO3受热易分解,可用作氮肥 C.Fe2(SO4)3易溶于水,可用作净水剂 D.SO2具有氧化性,可用于漂白纸浆 3.下列事实与平衡移动原理无关的是( ) A.向含酚酞的Na2CO3溶液中滴加BaCl2溶液,红色变浅 B.加热MgCl2·6H2O固体最终得到Mg(OH)Cl C.将FeS2矿石粉碎更有利于焙烧制备SO2气体 D.NO2气体经过冷凝和加压成无色液体 4.根据元素周期表和周期律分析下面的推断,其中错误的是( ) A.氢氟酸的酸性强于盐酸 B.氢氧化钡的碱性强于氢氧化钙 C.硅酸的酸性强于氢氧化铝 D.砹化氢不稳定. 5.下列有关化学用语的表示正确的是( ) A.医用“钡餐”的化学式:BaCO3 B.C1-的结构示意图: C.NaHCO3在水中的电离方程式:NaHCO3=Na+ + H+ + CO32- D.N2的电子式: 6.环辛四烯和立方烷的分子结构如图所示,下列说法正确的是( ) A.两者互为同分异构体 B.立方烷与甲烷互为同系物 C.环辛四烯与立方烷有相同的官能团 D.两者都能与溴水发生加成反应 7.下列指定反应的离子方程式正确的是( ) A.将铜丝插入稀硝酸中:Cu + 4H+ +2NO3- = Cu2+ + 2NO2↑ +H2O B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3+ + Fe = 2Fe2+ C.向Al2(SO4)3溶液中加入过量氨水:Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+ D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3 + 2H+ = H2SiO3↓ + 2Na+ 8.设NA为阿伏加德罗常数的数值。下列说法正确的是( ) A.7.4 g NH4F和5.6 g C2H4含有的氢原子数均为0.8NA B.0.5 L 1 mol/L NaHSO3溶液中含有的HSO3-数目为0.5NA C.标准状况下,11.2 L NO2完全溶于水,转移的电子数为0.5NA D.在高温高压和催化剂作用的条件下,向一密闭容器中充入28 g N2与足量的H2,充分反应后,转移的电子数为6NA 9. 25 ℃时,下列各组数据中比值为2:1的是( ) A.0.2 mol/L的CH3COONa溶液与0.1 mol/L的CH3COONa溶液中c(CH3COO-)之比 B.pH=7的氨水与(NH4)2SO4的混合溶液中c(NH4+)与c(SO42-)之比 C.等质量的Na2CO3固体和NaHCO3固体分别与足量盐酸反应,消耗盐酸的物质的量之比 D.pH均为2的H2SO4溶液与盐酸中c(H+)之比 10.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( ) ①向饱和碳酸钠溶液中通入过量CO2; ②向Fe(OH)3胶体中逐滴加入过量稀盐酸; ③向AgNO3溶液中逐滴加入过量氨水; ④向硅酸钠溶液中逐滴加入过量的盐酸 A.①③ B.①④ C.②③ D.②④ 二、选择题(本题为单选题,共10个小题,每小题3分,共计30分) 11.电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。 已知:3I2+6OH-===IO+5I-+3H2O。下列说法不正确的是 ( ) A.右侧发生的电极反应式:2H2O+2e-===H2↑+2OH- B.电解结束时,右侧溶液中含IO C.电解槽内发生反应的总化学方程式:KI+3H2OKIO3+3H2↑ D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变 12. 在不同温度下,向VL密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:2NO(g) + C(s) N2(g) + CO2(g) △H = -Q kJ/mol,达到平衡时的数据如下: 温度/℃ n(C)/mol n(CO2)/mol T1 0.15 T2 0.375 下列有关说法正确的是( ) A.由上述信息可推知:T1>T2 B.T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)增大 C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大 D.T1℃时,该反应的平衡常数K=9/16 13. 往含有0.2 mol NaOH和0.1 mol Ba(OH) 2混合溶液中持续稳定地通入CO2气体,当通入气体为8.96 L(标准状况)时立即停止。则这一过程中,溶液中离子的物质的量与通入CO2气体的体积关系正确的图像是(气体的溶解和离子的水解忽略不计) ( ) A B C D 14.现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验: 已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。该同学得出的结论正确的是 ( ) A.根据现象1可推出该试液中含有Na+ B.根据现象2可推出该试液中并不含有葡萄糖酸根 C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+ D.根据现象5可推出该试液中一定含有Fe2+ 15.1.52 g 铜镁合金完全溶解于50 mL 密度为1.40 g/cm3 ,质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL (标准状况下),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时 ,得到2.54 g 沉淀。下列说法不正确的是( ) A.该合金中铜与镁的物质的量之比为2:1 B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L C.得到2.54 g 沉淀时,加入NaOH溶液的体积是600 mL D.NO2和N2O4的混合气体中,NO2的体积分数是80% 16.下列实验的操作、现象和解释或结论都正确的是( ) 选项 操作 现象 解释或结论 A 将饱和Na2SO4溶液加入到饱和石灰水中 产生白色沉淀 说明Ksp[Ca(OH)2]大于Ksp(CaSO4) B 试剂瓶的导管中有一段稳定水柱 装置气密性良好 C 将Al2(SO4)3溶液蒸干 有白色固体生成 Al3+水解生成Al(OH)3 D 锥形瓶溶液产生淡黄色沉淀 苯与溴发生取代反应 17.短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol·L-1的v溶液中:c(OH-)/c(H+)=1.0×1010。上述物质的转化关系如图所示。下列说法正确的是( ) A.原子半径的大小:W >Z > Y > X B.Z分别与Y、W组成的化合物中化学键类型可能相同 C.v能抑制水的电离而u能促进水的电离 D.粘有q的试管可用酒精洗涤 18.在恒温恒容的密闭容器中,发生反应:3A(g)+B(g) xC(g)。[来源:Z|xx|k.Com] Ⅰ.将3 mol A和2 mol B在一定条件下反应,达平衡时C的体积分数为a; Ⅱ.若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是 ( ) A.若Ⅰ达平衡时,A、B、C各增加1 mol,则B的转化率将一定增大 B.若向Ⅰ平衡体系中再加入3 mol A和2 mol B,C的体积分数若大于a,可断定x>4 C.若x=2,则Ⅱ体系起始物质的量应满足3n(B) > n(A)+3 D.若Ⅱ体系起始物质的量满足3n(C)+8n(A)=12n(B),则可判断x=4 19.已知:25℃时某些弱酸的电离平衡常数。下面图像表示常温下稀释CH3COOH,HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是( ) A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度大小关系为:c(Na+) > c(ClO-) > c(CH3COO-)> c(OH-) > c(H+) B.向NaClO溶液中通少量CO2的离子方程式为:2ClO- + CO2 + H2O = 2HClO + CO32- C.图像中a、c两点处的溶液中相等(HR代表CH3COOH或HClO) D.图像中a点对应酸的总浓度大于b点酸的总浓度 20.H2C2O4为二元弱酸,20 ℃时,配制一组c(H2C2O4) + c(HC2O4-) + c(C2O42-)= 0.100mol/L的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( ) A.pH = 2.5的溶液中:c(H2C2O4) +c(C2O42-) > c(HC2O4-) B.c(Na+) = 0.100 mol/L的溶液中:c(H+) +c(H2C2O4) = c(C2O42-)+ c(OH-) C.c(HC2O4-) = c(C2O42-)的溶液中:c(Na+) > 0.100 mol/L + c(HC2O4-) D.pH = 7.0 的溶液中,2c(Na+) = c(C2O42-) 第Ⅱ卷(非选择题 共50分) 三、填空题(共4个小题,每空2分,共计50分) 21、(10分)下表为元素周期表的一部分 (1)⑤⑥⑦⑨⑩的离子半径由大到小的顺序为 (用离子符号表示)。 (2)③与⑩形成的一种化合物每个原子最外层都满足8e-结构,写出该化合物的电子式 。 (3)①②两种元素以原子个数比为3:1形成的一种化合物,写出其二氯取代物的结构简式: 。 (4)与③同主族的元素的化合物亚磷酸H3PO3是二元弱酸,写出H3PO3与过量的NaOH溶液反应的离子方程式 。 (5)由④⑥两种元素组成的一种化合物加入到硫酸亚铁溶液中,产生红褐色沉淀,但无气体产生,写出该反应的离子方程式 。 22.(12分)从含铜丰富的自然资源黄铜矿(主要成分为CuFeS2)中冶炼铜的工艺流程如下: 已知:。 (1)若“过滤1”所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为 。 (2)“除硫”时加入浓盐酸发生反应的离子方程式为 。 (3)“过滤3”所得滤液中可以循环使用的物质为 、 。 (4)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,发生的反应为、。此工艺与前一工艺相比主要缺点有 (任答一点)。 (5)铜溶解于H2O2和H2SO4的混合溶液中可制备CuSO4。测定溶液中Cu2+浓度的方法:准确量取V1 mL溶液于锥形瓶中,调节pH至3~4,加入过量KI溶液,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/L的Na2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL。上述过程中发生的反应为、。 ①“恰好完全反应”时溶液的颜色变化为 。 ②溶液中Cu2+的物质的量浓度为 (用含c、V1、V2的代数式表示)mol/L。 23.(14分)研究CO2的利用对促进低碳社会的构建具有重要意义。 (1)将CO2与焦炭作用生成CO,CO可用于炼铁等。 ①已知: 则CO还原Fe2O3(s)的热化学方程式为 。 (2)常温下,用氨水吸收CO2可得到NH4HCO3溶液。已知常温下:NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11。在NH4HCO3溶液中,c(NH4+) c(HCO3-)(填“>”“<”或“=”),计算反应NH4+ + HCO3- + H2O ⇌ NH3·H2O + H2CO3的平衡常数K= ,物料守恒表达式为 。 (3)以CO2为原料还可以合成多种物质。 ①如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。操作中先在 (1分) 处向饱和NaCl溶液中通入 (1分) 气体(填NH3或CO2),然后再在通入另一种气体。请写出反应的化学方程式 。 ②人工光合作用能够借助太阳能用CO2和水制备化学原料,如图是通过人工光合作用制备HCOOH的原理示意图,请写出催化剂b处的电极反应式: 。 24.(14分)亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐,易溶于水,微溶于乙醇。某化学兴趣小组对亚硝酸钠进行多角度探究: Ⅰ.亚硝酸钠的制备 (1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是_ ___。 (2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为_________ ______。 Ⅱ.探究亚硝酸钠与硫酸反应气体产物成分。 已知:①NO + NO2 + 2OH﹣ ═ 2NO2﹣ + H2O ②气体液化的温度:NO2:21℃,NO:﹣152℃ (3)反应前应打开弹簧夹,先通入一段时间氮气,目的是______ _____。 (4)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接): A、C、___、___、___。 (5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。 ①确认A中产生的气体含有NO,依据的现象是_________________。 ②装置B的作用是____________________。 Ⅲ.设计实验证明酸性条件下NaNO2具有氧化性。(供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液) (6) 。 邵东县一中 邵阳市一中 邵阳市二中 武冈县二中 隆回县一中 双峰县一中 2017年下学期高二优生2018年1月联赛试卷 化 学 时量:90分钟 分值:100分 命题:邵东一中 谢习武 一、选择题(本题为单选题,共10个小题,每小题2分,共计20分) 1-5 DACAD 6-10 ACABB 二、选择题(本题为单选题,共10个小题,每小题3分,共计30分) 11-15 DDCCC 16-20 BBDCB 三、填空题(本题共4小题,共计50分) 21、(10分) 2分一空 22.(12分) (1)Fe2O3 (2) (3)HCl和CuCl2 (4)会产生污染环境的SO2气体(或能耗高等合理答案) (5)①溶液由蓝色变为无色并且半分钟内不恢复蓝色;②CV2/V1 23、(14分) (1) (2)> 1.25×10-3 C(NH4+)+C(NH3·H2O)=C(CO32-)+C(HCO3-)+C(H2CO3) (3)①a,NH3,NaCl + CO2 + NH3 + H2O = NaHCO3 + NH4Cl;② 24、(14分)(1)平衡滴液漏斗与烧瓶内压强,便于硝酸流下 (2)4NO+O2+2CO32-=4NO2-+2CO2 (3)排尽装置中空气,防止生成的NO被氧化,干扰产物气体的检验 (4)E D B (5)①D中通入氧气后,气体由无色变为红棕色 ②尾气处理,吸收氮氧化物,防止空气污染 (6)取硫酸亚铁溶液并滴加稀硫酸酸化,滴加几滴KSCN溶液,溶液仍为浅绿色,滴加少许NaNO2溶液,此时溶液由浅绿色变为血红色,证明NaNO2具有氧化性;(或者取硫酸亚铁溶液并滴加稀硫酸酸化,滴加淀粉溶液,无明显现象,滴加少许NaNO2溶液,溶液变蓝,证明NaNO2具有氧化性)查看更多