- 2021-08-06 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河北省邯郸市磁县第二中学2019-2020学年高一下学期期中考试化学试题
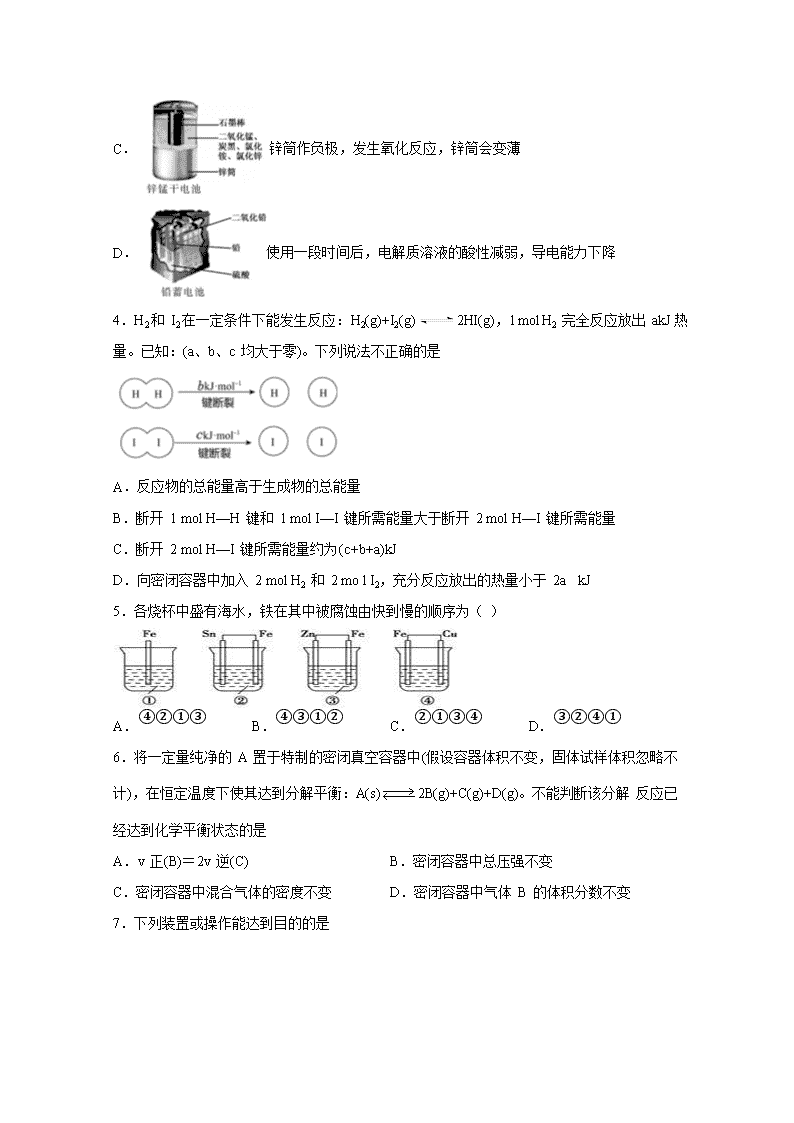
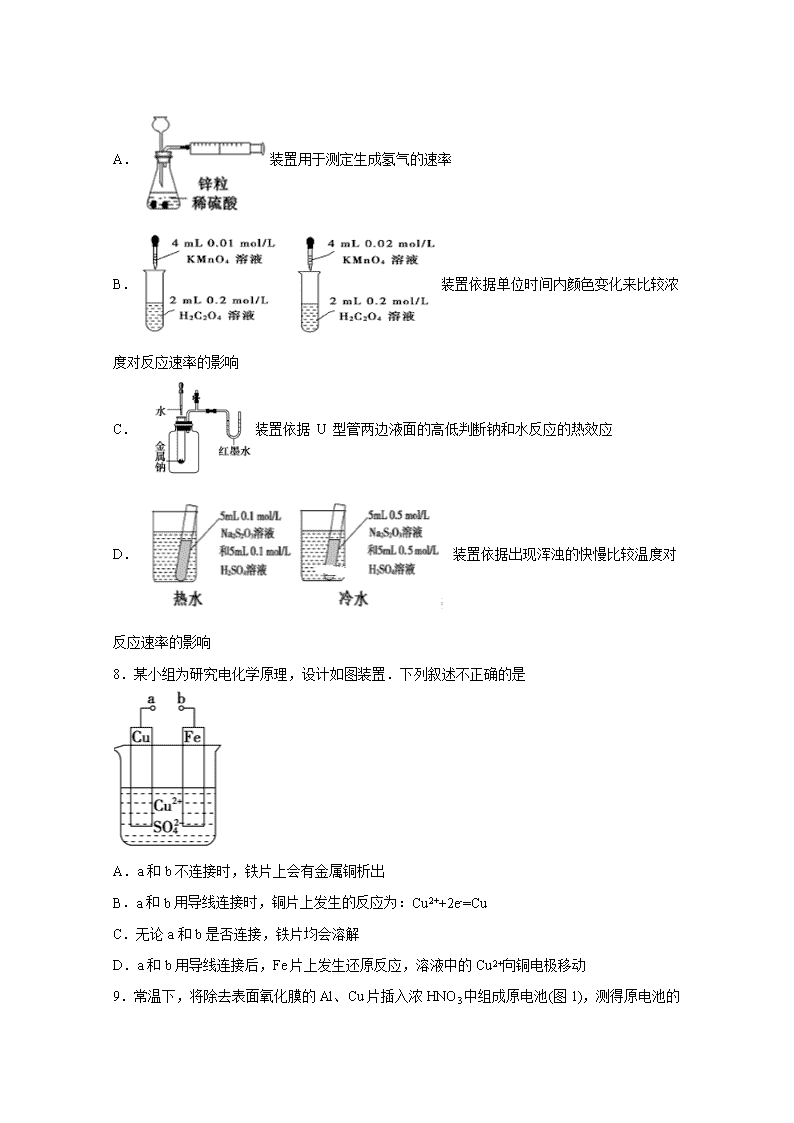
化学试卷 考试范围:必2专一专二;考试时间:60分钟 注意事项: 1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上 第I卷(选择题) 一、单选题(每题3分) 1.下列有关能量的说法不正确的是 ( ) A.化石能源物质内部贮存着大量的能量 B.植物的光合作用使太阳能转化为化学能 C.燃料燃烧时只是将化学能转化为热能 D.由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低 2.短周期主族元素 W、X、Y、Z 的原子序数依次增大,W 的简单氢化物可用作制冷剂, Y 的原子半径是所有短周期主族元素中最大的。由 X、Y 和 Z 三种元素形成的一种盐溶于 水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是 A.X 的简单氢化物的热稳定性比 W 强 B.Y 的简单离子与 X 的具有相同的电子层结构 C.氧化物水化物的酸性 W>Z D.Z 与 X 属于同一主族,与 Y 属于同一周期 3.化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是 A.Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加 B.正极的电极反应式为Ag2O+2e−+H2O2Ag+2OH− C.锌筒作负极,发生氧化反应,锌筒会变薄 D.使用一段时间后,电解质溶液的酸性减弱,导电能力下降 4.H2和 I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是 A.反应物的总能量高于生成物的总能量 B.断开 1 mol H—H 键和 1 mol I—I 键所需能量大于断开 2 mol H—I 键所需能量 C.断开 2 mol H—I 键所需能量约为(c+b+a)kJ D.向密闭容器中加入 2 mol H2 和 2 mo l I2,充分反应放出的热量小于 2a kJ 5.各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( ) A.④②①③ B.④③①② C.②①③④ D.③②④① 6.将一定量纯净的 A 置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:A(s)2B(g)+C(g)+D(g)。不能判断该分解 反应已经达到化学平衡状态的是 A.v 正(B)=2v 逆(C) B.密闭容器中总压强不变 C.密闭容器中混合气体的密度不变 D.密闭容器中气体 B 的体积分数不变 7.下列装置或操作能达到目的的是 A.装置用于测定生成氢气的速率 B.装置依据单位时间内颜色变化来比较浓度对反应速率的影响 C.装置依据 U 型管两边液面的高低判断钠和水反应的热效应 D.装置依据出现浑浊的快慢比较温度对反应速率的影响 8.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是 A.a和b不连接时,铁片上会有金属铜析出 B.a 和 b 用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu C.无论a和b是否连接,铁片均会溶解 D.a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动 9.常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1) ,测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。 下列说法错误的是( ) A.0~t1时,原电池的负极是Al片 B.0~t1时,正极的电极反应式是+2H++e−=NO2↑+H2O C.t1后,原电池的正、负极发生互变 D.t1后,正极上每得到0.3mol电子,则负极质量减少2.7g 10.根据能量变化示意图,下列热化学方程式正确的是( ) A.N2(g)+3H2(g)===2NH3(g) ΔH=-(b-a) kJ·mol-1 B.N2(g)+3H2(g)===2NH3(g) ΔH=-(a-b) kJ·mol-1 C.2NH3(l)===N2(g)+3H2(g) ΔH=2(a+b-c) kJ·mol-1 D.2NH3(l)===N2(g)+3H2(g) ΔH=2(b+c-a) kJ·mol-1 11.下列图示变化为吸热反应的是( ) A. B. C. D. 12.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( ) A.NH4ClNH3↑+HCl↑ B.2Na2O2+2CO2=2Na2CO3+O2 C.2NaOH+Cl2=NaCl+NaClO+H2O D.NH3+CO2+H2O=NH4HCO3 13.一定条件下,在体积一定的密闭容器中加入1 mol N2和3 mol H2发生反应:N2 + 3H2 2NH3 △H=-92 kJ·mol-1。下列有关说法正确的是 A.向容器中再加入N2,可以加快反应速率 B.达到化学反应限度时,反应放出热量92 kJ C.达到化学反应限度时,正、逆反应速率都为0 D.单位时间内生成1 mol N2,同时生成3 molH2,说明该反应达到化学平衡状态 14.下列每组中各物质内既有离子键又有共价键的一组是 A.Na2O2、KOH、Na2SO4 B.MgO、Na2SO4、NH4HCO3 C.NaOH、H2SO4、(NH4)2SO4 D.HCl、Al2O3、MgCl2 15.锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)42-。下列说法正确的是( ) A.充电时,电解质溶液中K+向阳极移动 B.充电时,电解质溶液中c(OH-) 逐渐减小 C.放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42- D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) 16.锂电池是一代新型高能电池,它以质量轻、能量高而重视,目前已研制成功多种锂电池。某种锂电池的总反应方程式为Li+MnO2===LiMnO2,下列说法正确的是( ) A.Li是正极,电极反应式为Li-e-=Li+ B.Li是负极,电极反应式为Li-e-=Li+ C.MnO2是负极,电极反应式为MnO2+e-=MnO2- D.Li是负极,电极反应式为Li-2e-=Li2+ 17.某同学组装了如图所示的电化学装置,电极I为Al,其他电极均为Cu,下列说法正确的是 A.盐桥中通常装有含琼脂的KCl饱和溶液,起作用是平衡电荷,电池工作时,K+、Cl-会分别进入两边的溶液中 B.该装置工作一段时间后,电极III上有红色固体析出 C.该装置工作一段时间后,③号烧杯中电解质溶液浓度不变,两个电极的质量不变 D.该装置工作时,③号烧杯中的SO42-向电极IV移动 18.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是( ) A.由Fe、Cu、FeCl3溶液组成原电池,负极反应式为:Cu-2e-=Cu2+ B.由Al、Cu、稀硫酸组成原电池,负极反应式为:Cu-2e-=Cu2+ C.由Al、Mg、NaOH溶液组成原电池,负极反应式为:Al+4OH--3e-=AlO2-+2H2O D.由Al、Cu、浓硝酸组成的原电池中,负极反应式为:Al-3e-=Al3+ 19.如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化) ( ) A.杠杆为导体和绝缘体时,均为A端高B端低 B.杠杆为导体和绝缘体时,均为A端低B端高 C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低 D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高 20.下列叙述能说明氯元素原子得电子能力比硫元素原子强的是( ) ①的溶解度比大 ②的酸性比氢硫酸强 ③的稳定性比强 ④的还原性比强 ⑤的酸性比强 ⑥与铁反应生成,而与铁反应生成 ⑦能与反应生成 ⑧在元素周期表中处于同周期的右侧 ⑨还原性: A.③④⑤⑦⑧⑨ B.③④⑥⑦⑧ C.③⑥⑦⑧⑨ D.①②③④⑤⑥⑦⑧⑨ 21.某同学用如图所示实验来探究构成原电池的一般条件,下列说法中正确的是 A.左瓶的灯泡发光 B.右瓶的铜棒变粗 C.右瓶中铁棒为正极 D.左瓶:Fe−2e−===Fe2+ 22.下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是 A.反应开始后,针筒活塞 向右移动 B.反应物总能量大于生 成物总能量 C.反应开始后,甲处液面 低于乙处液面 D. 温度计的水银柱不断 上升 23.有关如图所示装置的叙述正确的是( ) A.溶液中Na+向Fe极移动 B.该装置中Pt为正极,电极反应为:O2 + 2H2O + 4e−=4OH− C.该装置中Fe为负极,电极反应为:Fe−2e−=Fe2+ D.该原电池装置最终的产物是Fe(OH)2 24.燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( ) A.a极是负极,该电极上发生氧化反应 B.总反应方程式为2H2+O2═2H2O C.b极反应是O2+4OH--4e-═2H2O D.氢氧燃料电池是一种具有应用前景的绿色电源 25.下列化学用语正确的是( ) A.氮分子的电子式: B.硫原子的结构示意图: C.溴化钠的电子式 D.水分子的电子式: 第II卷(非选择题) 二、填空题(共25分) 26.某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装 置的开关时,观察到电流表的指针发生了偏转。 请回答下列问题: (1)甲池为原电池,通入 CH3OH 电极的电极反应为________。 (2)乙池中A(石墨)电极的名称为_____(填“正极”“负极”或“阴极”“阳极”),总反应为_____。 (3)当乙池B极质量增加 5.4 g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状况),丙池D极析出_____g 铜。 27.(1)合成氨工业中氢气可由天然气和水反应制备,其 主要反应为:CH4(g)+ 2H2O(g) CO2(g)+4H2(g),反应过程中 能量变化如图所示,则该反应为___________(填“吸热”或“放热”)。若已知,破坏 1mol 化学键需要吸收的热量如下表所示: 则消耗 1molCH4 吸收或放出热量为___________________kJ(用含 a b c d 字母的代数式表示)。 (2)在某体积为2L的密闭容器中充入0.5molNO2和1molCO,在一定条件下发生反应:NO2+COCO2+NO,5min时,测得容器中NO的物质的量为0.2mol,则: ①该段时间内,用 CO2 表示的平均反应速为_____________。 ②假设此反应在 5 min 时达到平衡,则此时容器内气体的总物质的量为_________________。 ③平衡时,NO2 的转化率为_________________。 ④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是_____________。 A.相同时间内消耗 n mol 的 NO2 的同时生成 n mol 的 CO2 B.NO2 的物质的量浓度不再改变 C.容器内气体的平均相对分子质量不变 D.v 正(NO)=v 逆(CO) E.容器内压强不再发生变化 F.容器内气体的密度保持不变 G.温度和压强一定时,混合气体的颜色不再发生变化 答案 一选择题(每题3分) 1C 2C 3A 4B 5A 6D 7C 8D 9D 10D 11A 12B 13 A 14 A 15C 16 B 17 A 18 C 19D 20 C 21B 22A 23B 24 C 25D 二填空题 26 (1) CH3OH+8OH--6e-=CO32-+6H2O (2分) (2)阳极 (2分) 4AgNO3+2H2O4Ag+O2↑+4HNO3 (3分) (3)280 (2分) 1.6 (2分) 27 (1) 吸热 (2分) 4a+4b-2c-4d(2分) (2)① 0.05mol/(L·min) ② 1.5mol ③ 40% ④ BDG 查看更多