江苏省连云港市赣榆区2020届高三高考仿真训练化学试题
2020年江苏高考化学模拟试题
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35. 5 K 39 Ca 40 Cr 52 Fe 56 Cu 64 Ag 108 I 127
单项选择题:本题包括10 小题,每小题2 分,共计20 分。每小题只有一个选项符合题意。
1.中国科研提供抗疫“硬核力量”,在对新冠病毒的认识与防控中,化学知识起到了重要作用。下列说法不正确的是
A.为了防止蛋白质变性,病毒疫苗一般需要冷藏存放
B.在选用酒精消毒时,75%的酒精溶液比95%的杀菌效果好
C.新冠病毒DNA分子内存在氢键,氢键具有一定的方向性和饱和性
D.聚丙烯是生产医用口罩熔喷布的主要原料,其单体分子中碳原子均以sp2杂化
2.反应Cl2+2NaOH=NaCl+NaClO+H2O,可用于工业上制取漂白精。下列表示反应中相关微粒的化学用语正确的是
A.NaOH的电子式:Na::H B.中子数为18的Cl原子:Cl
C.Na的结构示意图: D.NaClO的水解方程式:ClO-+H2O=HClO+OH-
3.下列物质性质与用途具有对应关系的是
A.氨气易液化,可用作制冷剂
B.溴化银具有感光性,可用于人工降雨
C.氯化铁具有氧化性,可用了自来水的杀菌消毒
D.氢氧化铝能与氢氧化钠反应,可用于治疗胃酸过多
4.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在水电离出的H+浓度为10X10-13mol·l-1:Na+、K+、、
B.使甲基橙呈红色的溶液中,可能大量存在的是:,K+、ClO−、
C.某无色溶液中可能大量存在:Al3+、Ba2+、、OH−
D.0.1 mol·L−1NH3·H2O溶液:K+、Fe3+、、SCN-
5.用下列实验装置进行相应的实验,能达到实验目的的是
A.图I用于实验室制氨气并收集干燥的氨气
B.图II用于除去Cl2中含有的少量HCl
C.图III用于提取I2的CCl4溶液中的I2
D.图IV用于检查碱式滴定管是否漏液
6.硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是
A.在图示的转化中,Fe3+和CuS是中间产物
B.在图示的转化中,化合价不变的元素只有铜
C.图示转化的总反应是2H2S+O22S+2H2O
D.当有1molH2S转化为硫单质时,需要消耗O2的物质的量为0.5mol
7.下列离子方程式书写正确旳是
A.碳酸氢铵和足量旳氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O
B.三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=2Fe2++S↓+2H+
C.用稀硝酸浸泡做过银镜反应旳试管:Ag+2H++NO3-=Ag++NO2↑+H2O
D.偏铝酸钠溶液中通入过量旳二氧化碳气体:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32-
8.短周期元素W、X、Y和Z的原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代,X2-和Y2+具有相同的电子层结构,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.X的氢化物只含有极性共价键
B.Y单质可通过电解Y的氯化物获得
C.W与氢形成的原子比为1︰1的化合物有多种
D.W与Z形成化合物WZ2中各原子均满足8电子稳定结构
9.在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeFeCl2Fe(OH)2
B.SSO3H2SO4
C.CaCO3CaOCaSiO3
D.NH3NOHNO3
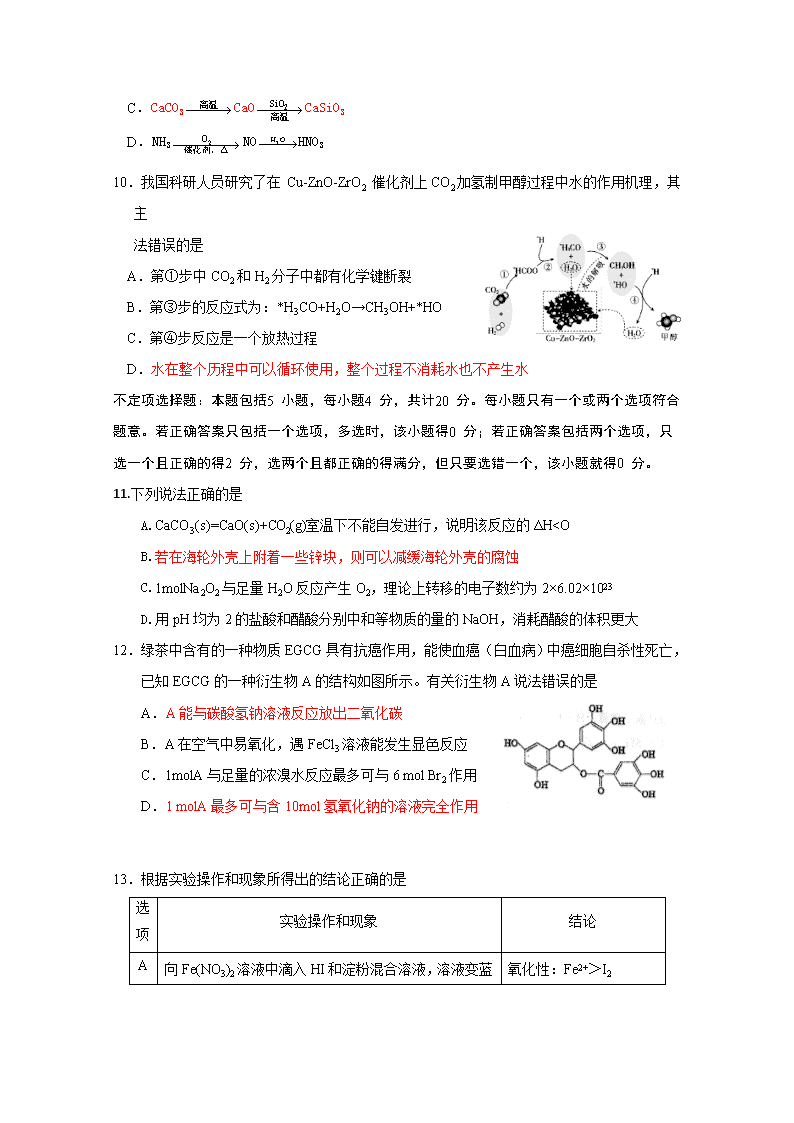
10.我国科研人员研究了在 Cu-ZnO-ZrO2 催化剂上CO2加氢制甲醇过程中水的作用机理,其主
法错误的是
A.第①步中CO2和H2分子中都有化学键断裂
B.第③步的反应式为:*H3CO+H2O→CH3OH+*HO
C.第④步反应是一个放热过程
D.水在整个历程中可以循环使用,整个过程不消耗水也不产生水
不定项选择题:本题包括5 小题,每小题4 分,共计20 分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
11.下列说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH
0
B.180℃,SO2去除率较高的主要原因是
SO2被γAl2O3吸附
C.500℃时,其他条件不变,采用高效
的催化剂可以提高SO2去除率
D.X点恒容下再通入CO、CO2各0.1 mol,达到平衡前v(正)>v(逆)
16.(12分)草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Ni、Fe、Al2O3、CaO、炭及有机物等)制取CoC2O4的工艺流程如下: 己知:①草酸钴晶体难溶于水
Fe3+
Co2+
开始沉淀时
1.9
7.1
沉淀完全时
3.7
9.1
②RH为有机物,可用RH、有机溶剂萃取出溶液
中的Ni2+
③几种金属阳离子的氢氧化物沉淀时的PH如右表所示:
(1)“焙烧”的目的 ▲ 。
(2)“碱浸”过程中Al2O3发生反应的化学方程式为 ▲ 。
(3) 经硫酸酸化后,“钴浸出”过程中Co3+转化为Co2+的离子方程式为 ▲ 。
(4)“浸出液B”中加入CoO并调节pH值至3.7~7.1的目的为 ▲ 。
(5) 加入NaF溶液可将钙离子转化为沉淀并过滤除去,若所得滤液中c(F-)=1.0×10-2 mol·L−1,则滤液中c(Ca2+)为 ▲ mol·L−1[已知Ksp(CaF2)=1.05×10-10]。
(6) 萃取后水层中含有大量的Co2+,将水层与酸性KMnO4溶液充分混合生成Co3+、Mn2+,理论上完全反应消耗的n(Co2+)∶n(MnO4-)= ▲ 。
17.(15分)化合物F是合成一种增强记忆力药物的重要中间体,其合成路线如下:
(1)E中的含氧官能团名称为 ▲ 。(写一种)
(2)A→B的反应类型为 ▲ 。
(3)写出同时满足下列条件的B的一种同分异构体的结构简式: ▲ 。
①为α-氨基酸;②苯环上有4个取代基;③有6种不同化学环境的氢。
(4)C转为D生成的另一种产物的结构简式为 ▲ 。
NaCN
(5)已知:R—Br R—CN
X
请写出以苯甲醇( )和 为原料制备有机物X(结构如右图)的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
△
18.(12分)在碱性条件下使用鸟粪石[Mgx(NH4)y(PO4)z·nH2O
]处理氨氮废水具有加热时间短,氨逸出彻底等优点。反应原理如下:
△
yNa++yOH-+Mgx(NH4)y(PO4)z·nH2O Mgx(Na)y(PO4)z+yNH3↑+(n+y)H2O
Mgx(Na)y(PO4)z+yNH4++nH2O yNa++Mgx(NH4)y(PO4)z·nH2O↓
(1)上述氨氮废水处理过程中鸟粪石所起的作用是 。
(2)其它条件不变,若鸟粪石化学式中的z保持不变,x越大,处理相同量的氨氮废水所需的时间就 (填:“越长”“越短”“不变”)。
(3)为测定鸟粪石的组成,进行下列实验:
①取鸟粪石2.45 g与足量的NaOH溶液混合,加热,收集到标准状况下的气体224mL
②另取鸟粪石2.45 g溶于稍过量盐酸,用蒸馏水配成100.00 mL溶液A;
③取25.00 mL溶液A,调节pH=10,用浓度为0.1000 mol·L-1的EDTA标准溶液滴定Mg2+,滴定至终点,消耗EDTA标准溶液25 mL(已知Mg2+与EDTA反应的化学计量比1∶1);
④取25.00 mL溶液A,加入0.005mol的BiCl3,调节溶液pH生成Mg3(PO4)2和BiPO4沉淀,过滤,滤液中的Bi3+用EDTA标准溶液滴定为 mol。通过计算确定鸟粪石的化学式(写出计算过程)。
19.(15分)以AlCl3、工业V2O5(纯度为96%)为原料,低温提纯制备高纯V2O5,其主要实验流程如下:
已知:①无水AlCl3升华温度约170℃,在空气中会吸水部分水解。
②VOCl3(三氯氧钒)熔点约78 ℃,沸点约127 ℃,易水解生成V2O5。
③V2O5易溶于碱生成VO(偏钒酸盐),溶于强酸生成
VO(氧基钒离子)。
(1)“氯化”产物为VOCl3和Al2O3,装置如图1所示。
向反应装置中不断通入氩气的目的是 ▲ ;反应温度
采用160℃左右的原因是 ▲ 。
(2)“沉钒”时控制温度为35 ℃、pH约为1,VOCl3转化为
图1
(NH4)2V6O16(多钒酸铵),其离子方程式为 ▲ 。
(3)“煅烧”时为避免生成的NH3将产物还原,需采取的措施
是 ▲ 。
(4)氨解沉钒时也可将VOCl3与氨水作用,生成NH4VO3(为避免反应过于剧烈,需先将一定量VOCl3溶解于水中配制成钒溶液)。沉钒率与钒溶液浓度、氨解温度的关系分别如图2、图3所示。
图3
图2
①钒溶液中会存在少量颗粒状沉淀,其可能成分为 ▲ (填化学式)。
②为确定较适宜的沉钒条件,请结合上图曲线,补充完整“探究氨水浓度对沉钒率的影响”的实验方案: ▲ ,使用专用仪器测定并计算沉钒率。
(实验中可供选择的试剂:50 g·L-1的钒溶液、10 g·L-1的钒溶液、25 %的优级纯氨水、高纯水)
20.(14分)废铅蓄电池的回收中产生大量的铅膏,回收利用铅膏能有效减少铅污染,充分利用铅资源。
(1)铅膏制备PbO。铅膏经过预处理后(主要成分为PbSO4)加入Na2CO3溶液,使之转化为PbCO3,然后充分灼烧得到PbO。
①PbCO3分解产生aPbCO3•bPbO中间产物。PbCO3和PbSO4加热升温过程中固体的质量变化见图1。PbCO3在300 ℃时分解的产物为 ▲ 。
剩余固体质量/g
200 400 400 600 800 1000 1200
温度/℃
PbSO4
909
801
757
735
713
669
PbCO3
图1
②工业上用PbCO3热分解制备的PbO而不直接热分解PbSO4制备的PbO的原因是
▲ 。
(2)沉淀除铅。铅膏经过转化后得到含铅的Na2SO4废液,需要进一步除去废水中的铅。
①常温下,该废液中SO浓度为0.01 mol·L−1,则该废液中Pb2+浓度最大为▲ 。
[Ksp(PbSO4)=1.8×10−8]
②随温度升高和SO浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液
中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着
pH的变化生成Pb(OH)2的质量如图2。
向含铅废液中投放NaHCO3发生的离子方程式为 ▲ 。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是 ▲ 。
阳离子交换膜
石墨
脉冲电源
铜片
NaNO3溶液
NO3
含铅废水
6 8 10 12 14
pH
Pb(OH)2的质量/g
图2 图3
(3)电化学除铅。利用脉冲电源(间歇性通入电流)电解法转化废液中的Pb2+实现铅资源化利用,可以提高除铅效率(除铅效率与Pb2+浓度有关),其原理示意图3。
①写出阳极的电极反应式: ▲ 。
②采用脉冲电解比普通电源电解的优点是 ▲ 。
21.黄铜矿是工业冶炼铜的原料,主要成分为CuFeS2。试回答下列问题:
(1)基态Cu原子的核外电子排布式为________;Cu、Zn的第二电离能大小I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(2)SO2分子中分子空间构型为________;与SO2互为等电子体的阴离子有________(写一种)。
(3)[Cr(H2O)4Br2]Br2H2O中心离子配位数为_______
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,
其晶胞结构如图所示。晶胞距离Mg原子最近Mg数目
为____________
参考答案
1-5 DCACA
6-10 BBACD
11-15 B AD BC CD B
16.(12分)每空2分
(1)除去炭和有机物
(2)Al2O3 + 2NaOH =2NaAlO2 + H2O
(3)2Co3+ + HSO3- + H2O = 2Co2+ + SO42- + 3H+
(4)除去Fe3+(或者使Fe3+完全转化为Fe(OH)3沉淀)
(5)1.05×10-6
(6)5:1
17.答案:(1) 酯基或酰胺键 (2)取代反应
(3)
(4)CH3CH2OH
(5)
HBr
△
NaCN
NaH
H2
雷尼镍
18.(12分)
(1)催化剂(2分)
(2)越长(2分)
(3)n(NH4+)=n(NH3)=0.224L/22.4L·mol-1=0.01mol(1分)
n(Mg2+)=n(EDTA)
=0.1000 mol·L-1×25.00 mL×10-3 L·mL-1 =0.01mol(2分)
n(PO43-)=0.01mol×+(0.005mol- mol)×4=0.01mol(1分)
n(H2O)=
=0.06mol(2分)
n(NH4+):n(Mg2+): n(PO43-):n(H2O)=0.01mol:0.01mol:0.01mol:0.06mol=1:1:1:6(1分)
化学式为MgNH4PO4·6H2O (1分)
19.答案:(1)①PbCO3·PbO ②PbSO4分解温度高,消耗能量多;产生硫的氧化物污染大
(2)①1.8×10−6 mol·L-1
②2HCO+ Pb2+=pb(OH)2↓+ 2CO2↑
NaOH碱性强容易与Pb(OH)2反应使其溶解,而Na2CO3溶液碱性弱容易控制pH,从而最大限度的使铅沉淀
(3)① 4OH− +4e−=O2↑+2H2O
②可以让阴阳离子充分的移到阳极和阴极附近,电极区相关离子浓度更大,有利于电解
20.【答案】(1)排除装置中的水蒸气 该温度下反应能发生,同时将生成的VOCl3及时蒸出分离,又避免AlCl3升华混入杂质
(2)6VOCl3 + 2NH + 10H2O = (NH4)2V6O16 + 18Cl- + 20H+
(3)在空气中进行,并不断搅拌
(4)①V2O5
②取数份等体积、50 g·L-1的钒溶液,分别加入不同体积25 %的优级纯氨水,再加入高纯水使各组溶液总体积相等,水浴加热控制反应温度均为35 ℃(或35-55 ℃),充分反应相同的时间(或1-2 h)
21.答案:(1)【Ar】3d104s1 >
(2) V型 NO2-
(3)6 (4) 12