- 2021-08-06 发布 |
- 37.5 KB |
- 7页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省泸县第四中学2020届高三下学期第二次月考
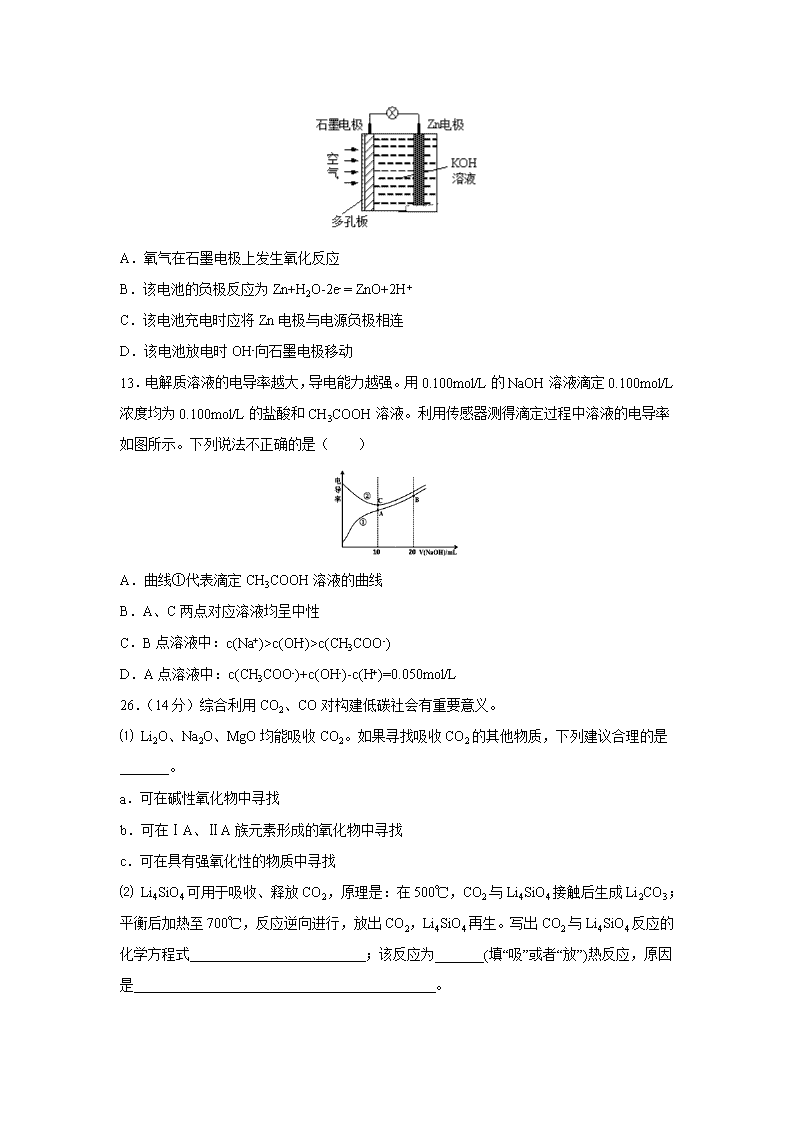
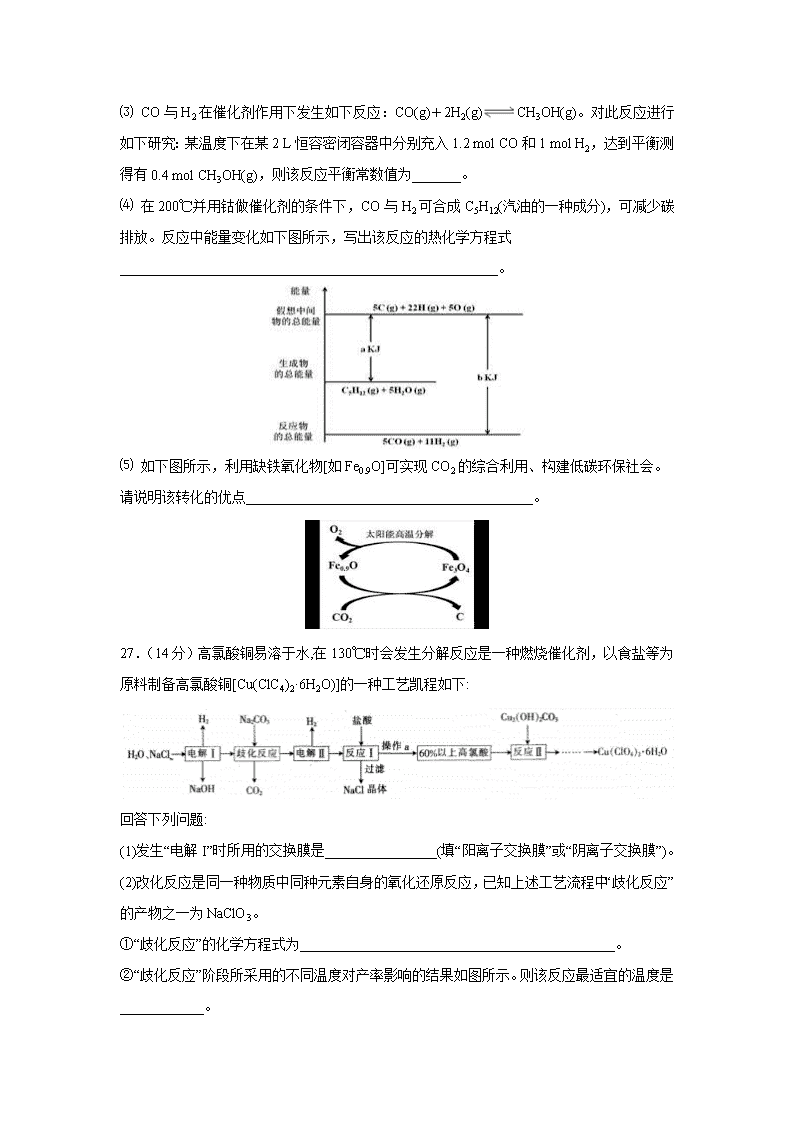
四川省泸县第四中学2020届高三下学期第二次月考 7.在加碘食盐中,碘以以下哪种形式存在( ) A.碘化钾 B.碘单质 C.碘酸钾 D.以上都不正确 8.共价化合物不可能( ) A.硬度很大 B.常温下为气态 C.由一种原子直接构成 D.溶于水产生阴阳离子 9.设nA为阿伏加德罗常数的数值,下列说法正确的是( ) A.14 g C2H4中含有2nA个C-H键 B.1 mol·L-1NH3·H2O溶液中含有nA个NH4+ C.1 mol Na2O2和足量CO2反应产生nA个O2分子 D.常温常压下,22.4 L 的SO2中含有nA个SO2分子 10.CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( ) A.相对于途径①③,途径②更好地体现了绿色化学思想 B.途径①发生的反应可能是3Cu+2HNO3+3H2SO4=3CuSO4+2NO+4H2O C.1mol CuSO4在1100℃所得混合气体X为SO3和O2,其中O2为0.5mo1 D.将CuSO4溶液蒸发浓缩、冷却结晶,可制得胆矾晶体(CuSO4·5H2O) 11.下列说法正确的是( ) A.乙烷与氯气在光照条件下发生加成反应 B.将石蜡油(液态烷烃混合物)加强热分解生成的气体都是烷烃 C.甲苯能够使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色 D.乙醇能够被酸性的高锰酸钾溶液直接氧化成乙酸 12.锌-空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时下列说法正确的是( ) A.氧气在石墨电极上发生氧化反应 B.该电池的负极反应为Zn+H2O-2e- = ZnO+2H+ C.该电池充电时应将Zn电极与电源负极相连 D.该电池放电时OH-向石墨电极移动 13.电解质溶液的电导率越大,导电能力越强。用0.100mol/L的NaOH溶液滴定0.100mol/L浓度均为0.100mol/L的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( ) A.曲线①代表滴定CH3COOH溶液的曲线 B.A、C两点对应溶液均呈中性 C.B点溶液中:c(Na+)>c(OH-)>c(CH3COO-) D.A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L 26.(14分)综合利用CO2、CO对构建低碳社会有重要意义。 ⑴ Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是_______。 a.可在碱性氧化物中寻找 b.可在ⅠA、ⅡA族元素形成的氧化物中寻找 c.可在具有强氧化性的物质中寻找 ⑵ Li4SiO4可用于吸收、释放CO2,原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生。写出CO2与Li4SiO4反应的化学方程式 ;该反应为_______(填“吸”或者“放”)热反应,原因是 。 ⑶ CO与H2在催化剂作用下发生如下反应:CO(g)+2H2(g)CH3OH(g)。对此反应进行如下研究:某温度下在某2 L恒容密闭容器中分别充入1.2 mol CO和1 mol H2,达到平衡测得有0.4 mol CH3OH(g),则该反应平衡常数值为_______。 ⑷ 在200℃并用钴做催化剂的条件下,CO与H2可合成C5H12(汽油的一种成分),可减少碳排放。反应中能量变化如下图所示,写出该反应的热化学方程式______________________________________________________。 ⑸ 如下图所示,利用缺铁氧化物[如Fe0.9O]可实现CO2的综合利用、构建低碳环保社会。请说明该转化的优点_________________________________________。 27.(14分)高氯酸铜易溶于水,在130℃时会发生分解反应是一种燃烧催化剂,以食盐等为原料制备高氯酸铜[Cu(ClC4)2·6H2O)]的一种工艺凯程如下: 回答下列问题: (1)发生“电解I”时所用的交换膜是________________(填“阳离子交换膜”或“阴离子交换膜”)。 (2)改化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。 ①“歧化反应”的化学方程式为_____________________________________________。 ②“歧化反应”阶段所采用的不同温度对产率影响的结果如图所示。则该反应最适宜的温度是____________。 (3)“电解Ⅱ”的阳极产物为________ (填离子符号)。 (4)操作a的名称是__________,该流程中可循环利用的物质是________(填化学式)。 (5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t。最终制得的Cu(ClO4)2·6H2O为bt,则产率为___________(用含a、b的代数式表示)。 (6)某温度下,高氯酸铜控制在A、B的种方式同时分解,分解过程中铜的化合价不发生改变。A方式为Cu(ClO4)2CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式为____________________________________________(用化学方程式表示)。 28(15分).1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g)2NH3(g)△H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示. 回答下列问题: (1)已知:①NH3(l)═NH3(g)△H1,②N2(g)+3H2(g)2NH3(l)△H2;则反应N2(g)+3H2(g)2NH3(g)的△H=_____________(用含△H1、△H2的代数式表示)。 (2)合成氨的平衡常数表达式为______________________,平衡时,M点NH3的体积分数为10%,则N2的转化率为____________(保留两位有效数字). (3)X轴上a点的数值比b点______(填“大”或“小”)。上图中,Y轴表示____________(填“温度”或“压强”),判断的理由是____________________________________________。 (4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如表所示: 容器编号 实验条件 平衡时反应中的能量变化 Ⅰ 恒温恒容 放热Q1kJ Ⅱ 恒温恒压 放热Q2kJ Ⅲ 恒容绝热 放热Q3kJ 下列判断正确的是____________ A.放出热量:Ql<Q2<△Hl B.N2的转化率:Ⅰ>Ⅲ C.平衡常数:Ⅱ>Ⅰ D.达平衡时氨气的体积分数:Ⅰ>Ⅱ (5)常温下,向VmL amoI.L-l的稀硫酸溶液中滴加等体积bmol.L-l的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)____________c(SO42-)(填“>”、“<”或“=”). (6)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-.写出负极的电极反应式________________________________________。 35.(15分)铜的相关化合物在化工、材料等领域有着广泛的应用。回答下列问题: (1)基态Cu原子中,核外电子占据的最高能层的符号是___________,占据该能层电子的电子云轮廓图形状为__________;Cu2+价层电子的轨道表达式(电子排布图)为___________。 (2)Cu2O熔点(1235℃)比Cu2S熔点(113℃)高,它们均属于___________晶体,前者熔点较高的原因是_________________________________________________。 (3)Cu可与N、S,O等元素形成化合物,N、S、O三种元素的第一电离能由大到小的顺序为__________________________;在Cu的催化作用下,乙醇可被氧化为乙醛,乙醛分子中碳原子的杂化方式是________________。 (4)1mo[Cu(NH3)4]SO4中含有σ键的数目为___________(用NA表示阿伏加德罗常数)。 (5)Cu与N所形成的某种晶体的立方晶胞如图所示,其晶胞参数为amm。该晶体的化学式为___________,晶体的密度为___________g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数)。 36.(15分)以芳香烃A(C7H8)为主要原料合成重要的医药中间体J的流程图如下: 己知:①(-NH2易于被强氧化剂氧化) ②③ 回答下列问题: (1)A的结构简式为__________,其分子中不同化学环境的氢原子的个数比为__________。 (2)B→C 的化学方程式为_____________________,反应④的反应类型为__________。 (3)反应⑧所需试剂和条件为___________;E中含氧官能团的名称为_____________。 (4)反应⑥和⑦的顺序是否可以交换过来?__________(选填“是”或“否”)。分析⑥→⑨步的反应,其中反应⑥的主要目的是_____________________________________。 (5)K是J的同分异构体,其苯环上的取代基与J的相同但位置不同,则K可能的结构有__________种。 (6)请参照题中所示合成路线,以苯和为原料(无机试剂任选),设计制备的合成路线____________________________________________________。 合成路线示例如下:CH3CH2OHCH2=CH2 【参考答案】 7.C 8.C 9.A 10.C 11.D 12.C 13.B 26.(14分,每空2分)(1)a b (2)2CO2+Li4SiO42Li2CO3+SiO2;放, 升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应。(3)50 (4)5CO(g)+11H2(g)=C5H12(g)+5H2O(g) ∆H=" +(b-a)" kJ/mol (5)将CO2转化为C和O2;利用了太阳能;Fe3O4可循环使用(写出一条给1分)。 27.阳离子交换膜 3Na2CO3+3Cl2=5NaCl+NaClO3+3CO2 60℃ ClO4- 蒸发浓缩 NaCl 702b/371a×100% 2Cu(C1O4)22CuO+7O2↑+2C12↑ 28.(1)2△H1+△H2; (2);18%; (3)小;温度;随Y值增大,φ(NH3)减小,平衡N2(g)+3H2(g)2NH3(g)△H<0向逆反应方向移动,故Y为温度; (4)AB; (5)>; (6)2NH3+3O2--6e-=N2+3H2O 35.N 球形 离子 Cu20与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu20的晶格能更大,熔点更高 N>O>S sp3 sp2 20NA Cu3N 206×1021/(NA×a3) 36. 1∶2∶2:3 + HNO3+ H2O 氧化反应 Fe粉+Cl2气(或Fe粉+FeCl3) 硝基、羧基 否 保护氨基 9 查看更多