- 2021-08-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江苏省扬州中学2019-2020学年高二下学期期中考试 化学
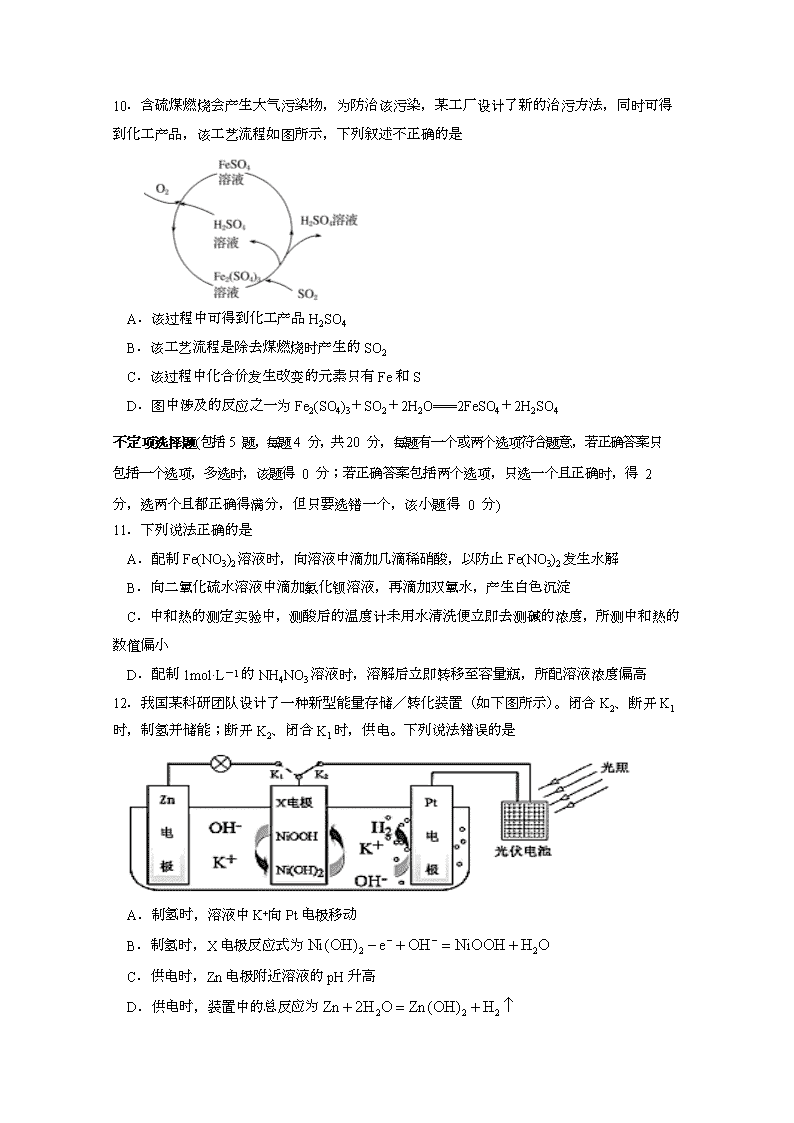
江苏省扬州中学高二年级下学期期中考试 化 学 2020.05 注意事项: 1.本试卷分选择题和非选择题,满分 100 分;考试用时 90 分钟。 2.答选择题必须用 2B 铅笔把答题卡相对应题目的答案标号涂黑,如需改动,请用橡皮擦干净后,再选涂其他答案;答非选择题必须用 0.5 毫米黑色墨水签字笔写在答题卡指定的位置上,不在答题区域内的答案一律无效,不得用其他笔答题。 可能用到的相对原子质量:H-1 N-14 O-16 S-32 Ag-108 选择题(共 40 分) 单项选择题(包括 10 题,每题 2 分,共 20 分,每题只有一个项符合题意) 1.在抗击新型冠状病毒肺炎的战役中,化学品发挥了重要作用。下列说法中错误的是 A.生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料 B.过氧化氢、过氧乙酸等消毒液均利用其强氧化性而达到消毒的目的 C.84消毒液的主要有效成分是NaClO,与医用酒精混合可以提升消毒效果 D.硝酸铵制成的医用速冷冰袋利用了硝酸铵溶于水吸热的性质 2.下列化学用语表达正确的是 A.硫原子结构示意图: B.KF的电子式:K+[]- C.氯化钙的分子式:CaCl2 D.甲酸甲酯的结构简式:C2H4O2 3.下列指定溶液中一定能大量共存的离子组是 A.由水电离出的 c(H+)=10-13mol·L-1 的溶液中:K+、Al3+、SO42﹣、NO3﹣ B. pH=7 的溶液中:K+、Fe3+、Cl﹣、NO3﹣ C.含有大量AlO2﹣的溶液中:Na+、K+、HCO3﹣、NO3﹣ D.Na2S 溶液中:SO42﹣、K+、NO3﹣、Cl﹣ 4.下列叙述正确的是 A.铜与过量的硫粉共热产物是Cu2S B. Fe(OH)3胶体无色、透明,能发生丁达尔现象 C.我国华为AI芯片已跻身于全球AI芯片榜单前列,该芯片的主要材料是二氧化硅 D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变 5.2020年2月以来,新型冠状病毒全球蔓延,外出最重要的防护措施是佩戴符合要求的口罩。下列图示操作中与戴口罩原理相同的是 A B C D 6.用NA表示阿伏加德罗常数的值,下列叙述正确的是 A.常温下,0.1 mol·L一1的碳酸钠溶液中含有的阴离子数大于0.1NA B.氢原子数为0.4NA的甲醇分子中含有的共价键数为0.4NA C.6.4gS6与S8的混合物中所含S原子数一定为0.2NA D.标准状况下,2.24LCl2与过量NaOH溶液反应转移电子数为0.2NA 7.在给定条件下,下列选项所示的物质间转化均能实现的是 A. Na(s)Na2O2(s)Na2CO3(s) B.Fe3O4(s)Fe(s)FeCl2(s) C.SiO2(s)SiCl4(g)Si(s) D. S(s)SO3(g)H2SO4(aq) 8.不能正确表示下列变化的离子方程式是 A.BaCO3溶于盐酸:BaCO3+2H+=Ba2++CO2↑+H2O B.FeCl3溶液腐蚀铜板:2Fe3++Cu=2Fe2++Cu2+ C.碳酸氢钠溶液和过量的澄清石灰水混合: 2HCO3-+ Ca2+ + 2OH-== CaCO3↓+ CO32- + 2H2O D.醋酸钠水解:CH3COO−+H2OCH3COOH+OH− 9.核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),原子核内质子数为(2n2-1)。下列关于元素X的说法中,不正确的是 A.可以形成化学式为KXO3的盐 B.其最高化合价为+3价 C.其最高价氧化物对应水化物是强酸 D.其氢化物可以用来做喷泉实验 10.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是 A.该过程中可得到化工产品H2SO4 B.该工艺流程是除去煤燃烧时产生的SO2 C.该过程中化合价发生改变的元素只有Fe和S D.图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O===2FeSO4+2H2SO4 不定项选择题(包括 5 题,每题 4 分,共 20 分,每题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该题得 0 分;若正确答案包括两个选项,只选一个且正确时,得 2 分,选两个且都正确得满分,但只要选错一个,该小题得 0 分) 11.下列说法正确的是 A.配制Fe(NO3)2溶液时,向溶液中滴加几滴稀硝酸,以防止Fe(NO3)2发生水解 B.向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀 C.中和热的测定实验中,测酸后的温度计未用水清洗便立即去测碱的浓度,所测中和热的数值偏小 D.配制1mol·L-1的NH4NO3溶液时,溶解后立即转移至容量瓶,所配溶液浓度偏高 12.我国某科研团队设计了一种新型能量存储/转化装置(如下图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法错误的是 A.制氢时,溶液中K+向Pt电极移动 B.制氢时,X电极反应式为 C.供电时,Zn电极附近溶液的pH升高 D.供电时,装置中的总反应为 13.常温下,分别向体积相同、浓度均为1mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lgC)间的关系如图。下列对该过程相关分析正确的是 A.HB的电离常数(Ka)数量级为10−3 B.其钠盐的水解常数(Kh)大小关系是:NaB>NaA C.a、b两点溶液中,水的电离程度bCo2+; 回答下列问题: (1)废旧电池初步处理为粉末状的目的是__________________________。 (2)从含铝废液得到Al(OH)3的离子方程式为_________________________。 (3)滤液A中的溶质除HCl、LiCl外还有FeCl3、CoCl2。写出LiCoO2和盐酸反应的化学方程式________________________________________________________。 (4)滤渣的主要成分为________________(填化学式)。 (5)已知Li2CO3的溶度积常数Ksp=8.64×10−4,将浓度为0.02mol·L−1的Li2SO4和浓度为0.02 mol·L−1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L−1。 (6)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是_________________________ ______________________________________________。 19.(12分)氮和硫的氧化物的综合利用是目前研究的热点之一。已知: i.N2(g)+O2(g) = 2NO(g) △H=+180.0 kJ·mol-1 ii.2SO2(g)+O2(g) = 2SO3(g) △H=-196.6 kJ·mol-1 iii.2NO(g)+O2(g) = 2NO2(g) △H=-113.0 kJ·mol-1 (1)反应iV:2NO2(g)+2SO2(g) = 2SO3(g)+N2(g)+O2(g)的 △H= ;该反应在密闭容器中达到平衡后,只改变下列条件,一定能使N2的平衡体积分数增大的是 (填选项字母)。 A.缩小容器容积 B.再充入SO2 C.降低温度 D.分离出SO3 (2)T1°C时,容积相等的密闭容器中分别充入NO2和SO2的混合气体4 mol,发生反应iV。NO2或SO2的平衡转化率(a)与起始充入的关系如图1所示。 ①图中能表示平衡时a(SO2)与起始充入的关系的曲线为 (填“L1”或“L2”)。 ②反应的平衡常数K= 。 (3)向密闭容器中充入一定量SO2和O2,发生反应ii。SO3的平衡体积分数(φ)与温度(T)和压强(p)的关系如图2所示。 ①P1、P2 、P3由大到小的顺序为 。 ②P、Q两点对应状态下,单位体积内反应物活化分子数目:P Q(填“>”、“<”或“=”)。 20.(12分)Al及其化合物在现代工业中有广泛的用途。回答下列问题: (1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____(填标号)。 A.[Ne]3s1 B.[Ne]3s2 C.[Ne]3s23p1 D.[Ne] 3s13p2 (2)熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为_____(标出配位键);其中Al的配位数为_________。二聚体A12C16中Al原子的轨道杂化类型是________。 (3) 实际上,偏铝酸钠在水溶液中都是以Na[Al(OH)4]和形式存在,1mol Na[Al(OH)4]中含有σ键的数目为_________。 (4)Ga(镓)和铝是同一主族元素,Ga原子的电子排布式是 。 (命题、校对:王辉林、张霞) 江苏省扬州中学高二年级下学期期中考试化学答案 1.C 2. B 3.D 4.A 5. C 6.C 7.A 8.C. 9.B 10.C 11.B.C 12.C.D 13.B 14.A.D 15. D 16.(每空2分)(1)水浴加热 (2)4Ag+4NaClO+2H2O===4AgCl+4NaOH+O2↑ 生成氮氧化物,污染空气 (3)向漏斗中加入蒸馏水至完全浸没沉淀,使洗涤液自然流下,重复2~3次 (4)[Ag(NH3)2]+ 氨水溶解AgCl的反应是可逆反应,不能进行到底 17.(1)Na2SO4 (1分) (2)NaHCO3或NaClO或CH3COONa (1分) (3)A (1分) 1.8×10−5或 (1分) 2×10−5-2×10−9 (2分) (4)100mL容量瓶、胶头滴管(2分) (5)滴入最后一滴NH4SCN标准液,溶液变为红色且半分钟内不褪色(2分) 85.0% (2分) 18.(1)增大接触面积,加快反应速率,提高浸出率(2分) (2)AlO+CO2+2H2O===Al(OH)3↓+HCO(2分) (3) 2LiCoO2+8HCl===2CoCl2+Cl2↑+4H2O+2LiCl(2分) (4)C(2分) (5)0.02(2分) (6)加入适量盐酸(或通入适量氯化氢气体)(2分) 19.(每空2分)(1)-263.6kJ•mol-1 CD (2) ①L2 ②81/64 (3) ①P1>P2>P3 ②> 20.(每空2分)(1)D (2) 4 sp3 (3)8NA (4)【Ar】 3d104s24p1 查看更多