- 2021-08-06 发布 |
- 37.5 KB |
- 28页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
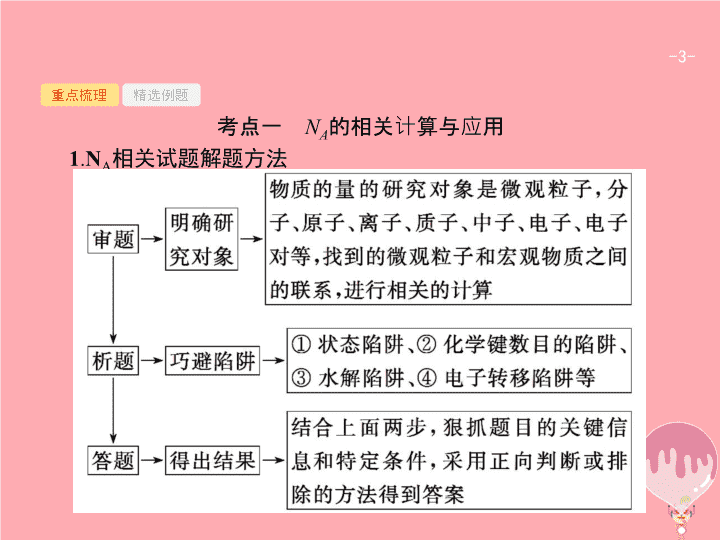
2018届高考二轮复习苏教版第23讲物质的量的相关计算课件(28张)
专题七 化学计算 第 23 讲 物质的量的相关计算 - 3 - 重点梳理 精选例题 考点一 N A 的相关计算与应用 1 . N A 相关试题解题方法 - 4 - 重点梳理 精选例题 2 . 已知物质的质量求物质所含的粒子数目 此类题型可采用以下解题思路求解物质所含的目标粒子数目 : (1) 若物质为纯净物 , 可先求物质的量 , 然后求解目标粒子数目。 (2) 若物质为混合物 , 先求混合物中各物质的最简式 , 若最简式相同 , 可先求最简式的物质的量 , 然后求解目标粒子数目。若最简式不同 , 可先计算两物质的摩尔质量是否相同 , 当摩尔质量相同时 , 可先求两物质的总物质的量 , 然后求解目标粒子的数目。 - 5 - 重点梳理 精选例题 3 . 已知物质 ( 气体 ) 的体积求所含的粒子数目 (1) 气体体积是否在标准状况下测得 当题干中设置 “ 常温常压 ”“ 室温 ” 等条件时 , 无法用标准状况下的气体摩尔体积求解粒子数目。 (2) 标准状况下物质的聚集状态 当题干中所给物质在标准状况下为非气态物质时 , 无法用标准状况下的气体摩尔体积求解粒子数目。 - 6 - 重点梳理 精选例题 4 . 溶液中所含的粒子数目的计算 此类题的解题思路如下 : - 7 - 重点梳理 精选例题 5 . 以物质的结构为依据求共价键 ( 或碳环 ) 数目 解此类题目要依据物质的结构先计算结构单元的共价键 ( 或碳环 ) 数 , 然后再求解目标共价键 ( 或碳环 ) 数目。其解题思路如下 : 掌握常考物质所含共价键数目 : - 8 - 重点梳理 精选例题 6 . 阿伏加德罗定律 在同温同压下 , 同体积的气体含有相同的分子数。同温、同压、同体积、同分子数 , 这 “ 四同 ” 相互制约 , 只要其中 “ 三同 ” 成立 , 第 “ 四同 ” 也成立 , 即 “ 三同 ” 定 “ 一同 ” 。即 : T 1 =T 2 、 P 1 =P 2 、 V 1 =V 2 ⇒ n 1 =n 2 。 7 . 阿伏加德罗定律的推论 : 气体状态方程 : PV=nRT ③ - 9 - 重点梳理 精选例题 - 10 - 重点梳理 精选例题 (3) 一连比 : 同温同压下 , 同体积的任何气体的质量比等于它们的摩尔质量之比 , 也等于它们的密度之比 : ( 注 : 以上用到的符号中 , ρ 为密度 , p 为压强 , n 为物质的量 , M 为摩尔质量 , m 为质量 , V 为体积 , T 为温度 ; 上述定律及其推论仅适用于气体 , 不适用于固体或液体。 ) - 11 - 重点梳理 精选例题 (2017·11· 浙江选考 ) 设 N A 为阿伏加德罗常数的值 , 下列说法不正确的是 ( ) A. 含 0.2 mol H 2 SO 4 的浓硫酸与足量的镁反应 , 转移电子数大于 0.2 N A B.25 ℃ 时 ,pH=3 的醋酸溶液 1 L, 溶液中含 H + 的数目小于 0.001 N A C. 任意条件下 ,1 mol 苯中含有 C—H 键的数目一定为 6 N A D. a mol 的 R 2+ (R 的核内中子数为 N , 质量数为 A ) 的核外电子数为 a ( A - N -2) N A 答案 解析 解析 关闭 浓硫酸与镁反应产物是水、二氧化硫和硫酸镁 , 浓硫酸变稀之后与镁反应产物是氢气和硫酸镁 , 若 0.2 mol H 2 SO 4 反应产物全为二氧化硫 , 转移电子数为 0.2 N A , 若产物全为氢气 , 转移电子数为 0.4 N A , 所以实际转移电子数应介于 0.2 N A 和 0.4 N A 之间 , 故 A 选项正确 ;pH=3 的醋酸溶液中 c (H + )=10 -3 mol · L -1 , 在 1 L 该溶液中含 H + 的数目等于 0.001 N A , 故 B 选项错误 ;1 个苯分子中含有 6 个 C—H 键 ,1 mol 苯中含有 C—H 键的数目一定为 6 N A , 故 C 选项正确 ;R 2+ 的核外电子数为 A - N -2, a mol 的 R 2+ 的核外电子数为 a ( A-N- 2) N A , 故 D 选项正确。 答案 解析 关闭 B - 12 - 重点梳理 精选例题 跟踪训练 1 .(2017· 宁波模拟 ) 设 N A 为阿伏加德罗常数的值 , 下列说法正确的是 ( ) A. 足量 Mg 与 2.8 g N 2 完全反应后失去 0.2 N A 电子 B.3.0 g 由葡萄糖和冰醋酸组成的混合物中含有的原子总数为 0.3 N A C. 常温常压下 ,2.8 g C 2 H 4 含有共用电子对的数目为 0.6 N A D.16 g 18 O 2 含有 N A 个 18 O 原子 答案 解析 解析 关闭 答案 解析 关闭 - 13 - 重点梳理 精选例题 2 . 设 N A 为阿伏加德罗常数的数值 , 下列说法正确的是 ( ) A. 常温下 ,23 g NO 2 含有 N A 个氧原子 B.1 L 0.1mol·L -1 的氨水含有 0.1 N A 个 OH - C. 常温常压下 ,22.4 L CCl 4 含有 N A 个 CCl 4 分子 D.1 mol Fe 2+ 与足量的 H 2 O 2 溶液反应 , 转移 2 N A 个电子 答案 解析 解析 关闭 NO 2 的摩尔质量是 46 g · mol -1 , 所以 23 g NO 2 的物质的量是 0.5 mol, 含有氧原子的物质的量是 0.5 mol×2=1 mol, 即含有 N A 个氧原子 ,A 正确 ;NH 3 · H 2 O 属于弱电解质 , 在溶液中部分电离 , 因此 1 L 0.1 mol · L -1 的氨水不可能电离出 0.1 mol OH - ,B 不正确 ; 常温常压下 ,CCl 4 是液体 , 因此不适用于气体摩尔体积 ,C 不正确 ;Fe 2+ 被氧化 , 产物是 Fe 3+ , 因此 1 mol Fe 2+ 与足量的 H 2 O 2 溶液反应 , 转移 N A 个电子 ,D 也不正确。 答案 解析 关闭 A - 14 - 重点梳理 精选例题 规律小结 1 . 氧化还原反应中电子转移数目的计算 - 15 - 重点梳理 精选例题 2 . 关于 N A 试题常设的 “ 陷阱 ” (1) 气体摩尔体积的运用条件 : 考查气体时经常给定非标准状况下 ( 如 25 ℃ 、 1.01×10 5 Pa) 气体体积 , 若用 22.4 L · mol -1 进行换算 , 则误入陷阱 ; 考查气体质量时 , 增加迷惑性信息 “ 常温常压 ”, 让很多学生判断错误。 (2) 忽视物质的聚集状态 :22.4 L · mol -1 适用对象是气体 ( 包括混合气体 ) 。考查时常用标准状况下非气态的物质来迷惑学生 , 如 H 2 O 、 CCl 4 等。 (3) 忽视单质的组成 : 气体单质的组成除常见的双原子分子外 , 还有单原子分子 ( 如 He 、 Ne 等 ) 、三原子分子 ( 如 O 3 ) 等。 - 16 - 重点梳理 精选例题 (4) 混淆某些氧化还原反应中电子转移的数目 : 考查时常用一些反应中转移电子的数目来迷惑学生 , 如 Na 2 O 2 与 H 2 O 反应、 Cl 2 与 NaOH 溶液反应、 Fe 与盐酸反应、 1 mol 氯气与过量铁反应、电解硫酸铜溶液等。 (5) 不理解物质的组成结构 : 如 Na 2 O 2 是由 Na + 和 构成 , 而不是 Na + 和 O 2- ;NaCl 为离子化合物 , 只有离子 , 没有分子 ; 苯中不含碳碳单键和碳碳双键。 (6) 忽视电离、水解对溶液中离子数目的影响 : 考查电解质溶液中离子数目或浓度时常设置弱电解质的电离、盐类水解方面的陷阱。 - 17 - 重点梳理 精选例题 考点二 物质的量浓度的相关计算 1 . 有关物质的量浓度的计算 - 18 - 重点梳理 精选例题 - 19 - 重点梳理 精选例题 2 . 物质的量浓度与溶质质量分数的比较 - 20 - 重点梳理 精选例题 把 200 mL NH 4 HCO 3 和 Na 2 CO 3 的混合溶液分成两等份 , 取一份加入含 a mol NaOH 的溶液恰好反应完全 ; 取另一份加入含 b mol HCl 的盐酸恰好反应完全。该混合溶液中 c (Na + ) 为 ( ) A.(10 b- 5 a )mol·L -1 B.(2 b-a )mol·L -1 答案 解析 解析 关闭 答案 解析 关闭 - 21 - 重点梳理 精选例题 跟踪训练 1 . 下列叙述不正确的是 ( ) A.10 mL 质量分数为 98% 的 H 2 SO 4 溶液用 10 mL 水稀释后 ,H 2 SO 4 的质量分数大于 49% B. 配制 0.1 mol·L -1 的 Na 2 CO 3 溶液 480 mL, 需用 500 mL 容量瓶 C. 在标准状况下 , 将 22.4 L 氨气溶于 1 L 水中 , 得到 1 mol·L -1 的氨水 D. 向 2 等份同浓度的不饱和烧碱溶液中分别加入一定量的 Na 2 O 2 和 Na 2 O, 使溶液均恰好饱和 , 则加入的 Na 2 O 2 与 Na 2 O 的物质的量之比等于 1 ∶ 1( 保持温度不变 ) 答案 解析 解析 关闭 答案 解析 关闭 - 22 - 重点梳理 精选例题 2 . 用 “ 偏大 ”“ 偏小 ” 或 “ 无影响 ” 填空。 (1) 配制 500 mL 1 mol·L -1 的硫酸铜溶液 , 用托盘天平称取胆矾 80.0 g: 。 (2) 用 Na 2 CO 3 ·10H 2 O 晶体配制 Na 2 CO 3 溶液 ,Na 2 CO 3 晶体已部分失去结晶水 , 用该晶体所配 Na 2 CO 3 溶液的物质的量浓度 : 。 (3) 配制 NaOH 溶液时 , 天平的两个托盘上放两张质量相等的纸片 , 其他操作均正确 : 。 (4) 配制 NaOH 溶液时 ,NaOH 固体放在烧杯中称量时间过长 : 。 (5) 配制一定物质的量浓度的 NaOH 溶液 , 需称量溶质 4.4 g, 称量时砝码和药品放置颠倒 (1 g 以下用游码 ): 。 - 23 - 重点梳理 精选例题 (6) 用量筒量取浓硫酸倒入小烧杯后 , 用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中 : 。 (7) 用量筒量取浓硫酸时 , 仰视读数 : 。 (8) 配制 NaOH 溶液时 , 将称量好的 NaOH 固体放入小烧杯中溶解 , 未经冷却立即转移到容量瓶中并定容 : 。 (9) 转移后 , 未洗涤小烧杯和玻璃棒 , 或者未将洗涤液一并转移至容量瓶中 : 。 (10) 定容时 , 加水超过刻度线 , 用胶头滴管吸取多余的液体至刻度线 : 。 - 24 - 重点梳理 精选例题 【答案】 (1) 偏小 (2) 偏大 (3) 偏小 (4) 偏小 (5) 偏小 (6) 偏大 (7) 偏大 (8) 偏大 (9) 偏小 (10) 偏小 【解析】 (1) 应称取胆矾质量为 125 g 。 (2) 相当于所取溶质 Na 2 CO 3 质量偏大。 (3)NaOH 腐蚀纸片 , 会有部分沾在纸片上。 (4) 称量时间过长 NaOH 会潮解。 (5) 相当于所称 NaOH 质量为 3.6 g 。 (6) 量筒不能用蒸馏水洗涤 , 否则会导致所取硫酸的量变大。 (7) 仰视量筒读数会使所取浓硫酸体积偏大。 (8) 相当于所配溶液体积减小。 (9) 溶质未全部转移到容量瓶中。 (10) 加水超过刻度线 , 则所配溶液体积偏大。 - 25 - 重点梳理 精选例题 - 26 - 重点梳理 精选例题 2 . 误差的分析根据 由 可知 , 一定物质的量浓度溶液配制的误差都是由溶质的物质的量 n B 和溶液的体积 V 引起的。误差分析时 , 关键要看溶液配制过程中引起了 n B 和 V 怎样的变化。在配制一定物质的量浓度溶液时 , 若 n B 比理论值小 , 或 V 比理论值大时 , 都会使所配溶液浓度偏小 ; 若 n B 比理论值大 , 或 V 比理论值小时 , 都会使所配溶液浓度偏大。 - 27 - 重点梳理 精选例题 - 28 - 重点梳理 精选例题查看更多