辽宁省实验中学分校2016-2017学年高二下学期期末考试化学试题
辽宁省实验中学分校2016-2017学年度下学期期末测试
化学学科 高二年级
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27
Fe-56 Cu-64 Zn-65
第I卷(选择题,共60分)
一、选择题。本大题共20小题,每小题3分,共60分。
1、设NA为阿伏加德罗常数的数值。下列说法正确的是( )
A.1 mol甲苯含有6NA个C—H键 B.18 g H2O含有10NA个质子
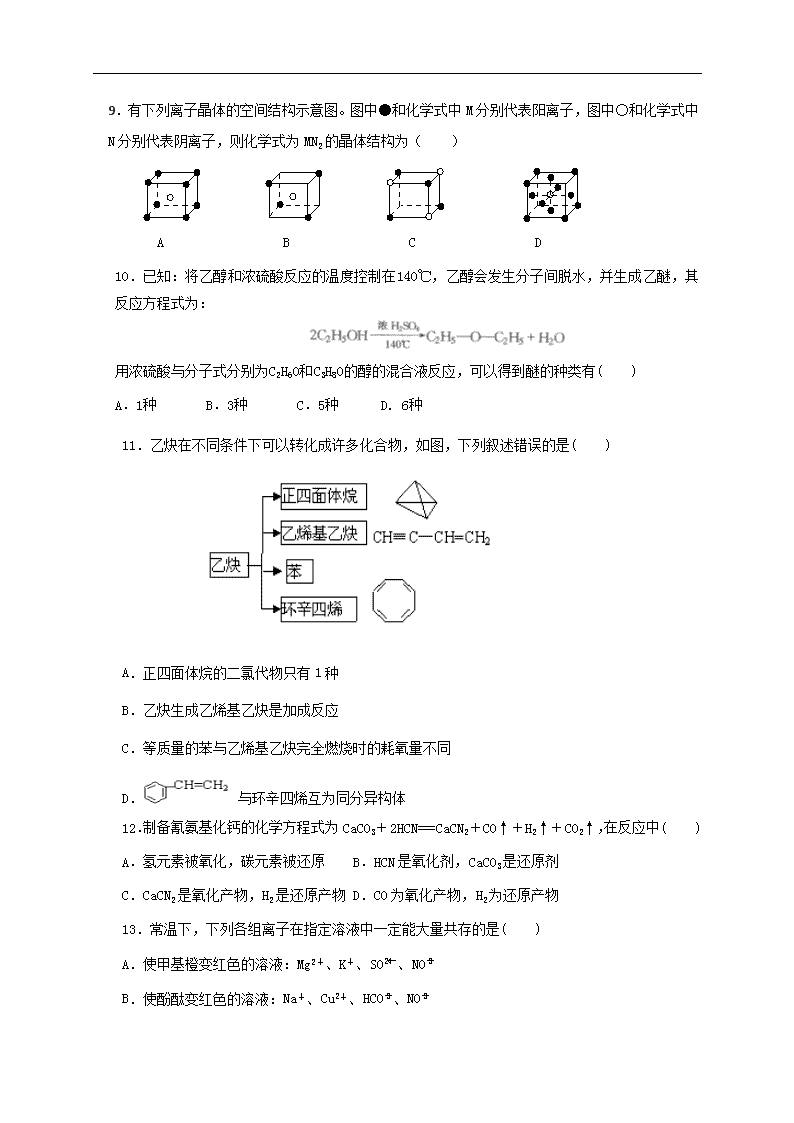
C.标准状况下,22.4 L氨水含有NA个NH3分子
D.56 g铁片投入足量浓H2SO4中生成NA个SO2分子
2.下列说法正确的是( )
A.硫酸钠溶液和醋酸铅溶液均能使蛋白质变性
B.油脂是高级脂肪酸的甘油酯,均不能发生氢化反应
C.H2N—CH2——COOH既能与盐酸反应,又能与氢氧化钠溶液反应
D.在蛋白质的渗析、盐析、变性过程中都发生了化学变化
3.下列各组原子中,化学性质一定相似的是( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅两个电子的Y原子
C.2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子
D.最外层都只有一个电子的X、Y原子
4、下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO
5.下列有关物质的分类或归类中正确的是( )
A.化合物:HT、CaCl2、NaOH、盐酸
B.纯净物:水玻璃、胆矾晶体、液氯、硫酸
C.天然高分子化合物:淀粉、纤维素、蛋白质、聚氯乙烯
D.同分异构体:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4
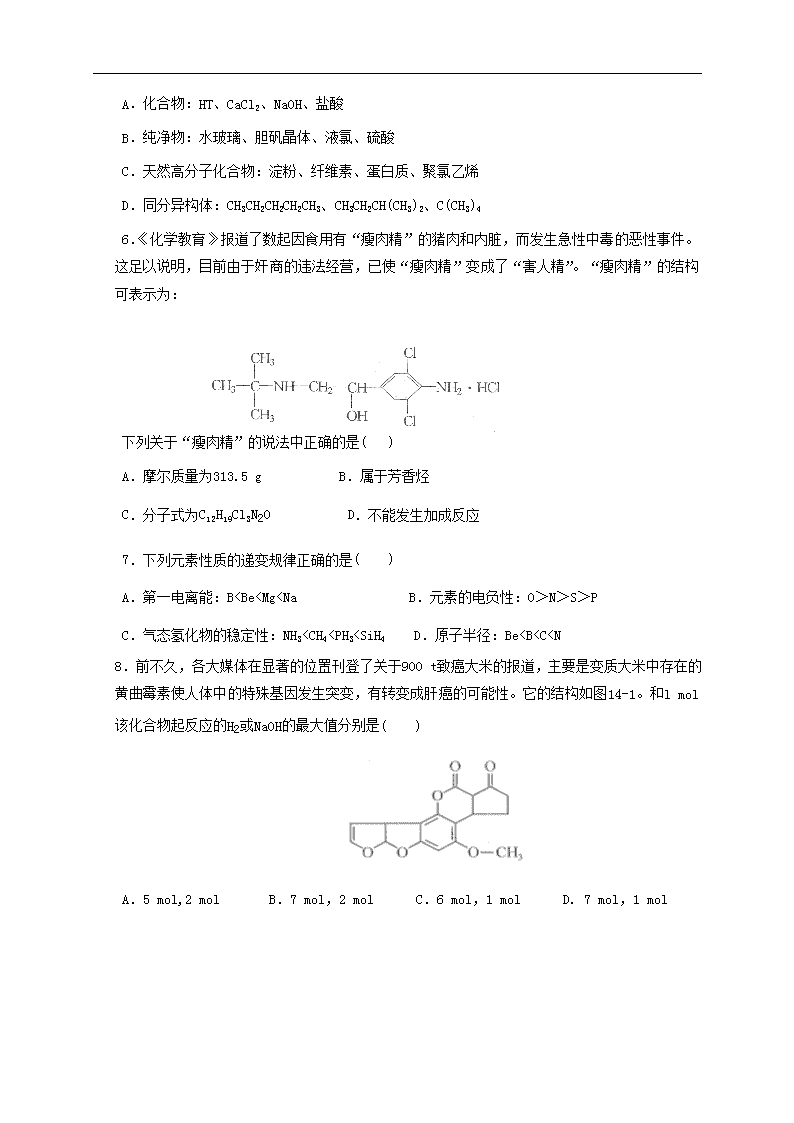
6.《化学教育》报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生急性中毒的恶性事件。这足以说明,目前由于奸商的违法经营,已使“瘦肉精”变成了“害人精”。“瘦肉精”的结构可表示为:
下列关于“瘦肉精”的说法中正确的是( )
A.摩尔质量为313.5 g B.属于芳香烃
C.分子式为C12H19Cl3N20 D.不能发生加成反应
7.下列元素性质的递变规律正确的是( )
A.第一电离能:B
Z2>B2>A3+ D.X2+是XO的还原产物
16.下表代表周期表中的几种短周期元素,下列说法中错误的是( )
A.ED4分子中各原子均达8电子结构 B.AD3和ED4两分子的中心原子均为sp3杂化
C.A、B、C第一电离能的大小顺序为C>B>A
D.C、D气态氢化物稳定性强弱和沸点高低均为C>D
17.24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3
C.+4 D.+5
18.下列说法中错误的是( )
A.根据对角线规则,铍和铝的性质具有相似性
B.[Cu(H2O)4]2+中Cu提供空轨道,H2O中O提供孤对电子形成配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.手性分子互为镜像,它们的性质没有区别
19.欲将混合液中Al3+、Cu2+、Ba2+、Ag+逐一沉淀出来加以分离,加入试剂①Cl- ②SO ③OH- ④CO2 ⑤CO的正确顺序是( )
A.①②③④ B.③⑤①②
C.②①③⑤ D.①⑤③②
20、取铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生0.896L NO2气体和0.672 L N2O4的气体(气体体积都已折算到标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为3.7g。则合金中铜与镁的物质的量之比等于
A.1 :1 B.2 :1 C.3 :2 D.2 :3
第Ⅱ卷(共40分)
二、填空题。本大题共3小题,共40分。
21、(共10分,每空2分)
(1)白色固体PCl5受热即挥发并发生分解:PCl5(g) PCl3(g)+Cl2(g)。现将5.84 g PCl5装入2.05 L真空密闭容器中,在277 ℃达到平衡,容器内压强为1.01×105 Pa,经计算可知平衡时容器内混合气体的物质的量为0.05 mol,平衡时PCl5的分解率为________。
(2)
下列微粒在溶液中的还原性和氧化性强弱顺序如下:还原性HSO>I-,氧化性IO>I2>SO。向含有x mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示,则x为________mol。
(3)甲醇对水质会造成一定的污染,可细菌的作用下,用氨(NH3)处理含甲醇(CH3OH)的工业废水,使其变成无毒的CO2和N2,从而消除对环境的污染,化学方程式为: ,该过程中被氧化的元素是 ,当产生标准状况下2.24L时,共转移电子 mol。
22.【化学—选修3:物质结构与性质】(15分,最后一空3分,其余各2分)
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道。请回答下列问题:
(1)R原子的基态电子排布式为 。
(2)X、Y原子的第一电离能大小顺序为 。(用元素符号表示)
(3)X的常见单质分子结构中σ键数目为 。
(4)Z的最高价氧化物对应水化物的酸根离子空间构型为 ,中心原子的杂化轨道类型为 。
(5)某矿物晶体由Y、W、R三种元素组成,其晶胞结构如图所示。
则该矿物的化学式为 ,若已知该晶胞的边长为a cm,则该晶胞的密度为 g/cm3。(用含a、NA的代数式表示)
23.(15分)1-萘酚用于制染料和香料等,也用于其他有机合成。下面是以1-萘酚为原料合成治疗心脏病的药物“心得安”的路线(具体反应条件和部分试剂略)。
回答下列问题:
(1)试剂b中官能团的名称是 。③的反应类型是 。
(2)由丙烷经三步反应制备试剂b的合成路线:
反应1的试剂与条件为 ,反应2的化学方程式为 ,反应3的反应类型是 。
(
3)芳香化合物D是1-萘酚的同分异构体,其分子中有两个官能团,能发生银镜反应,D能被KMnO4酸性溶液氧化成E( C2H4O2) 和芳香化合物F (C8H6O4),E和F与碳酸氢钠溶液反应均能放出CO2气体,F芳环上的一硝化产物只有一种。E的核磁共振氢谱峰面积比为 ;名称是 ;D的结构简式为 ;由F生成一硝化产物的化学方程式为 。
2016-2017学年度下学期期末测试答案:
1、答案: B 2、答案: C 3、答案: C 4、答案: C 5、答案: D 6、答案:C
7、答案: B 8、答案: A 9、答案: B 10、答案: D 11、答案:C 12、答案: C
13、答案: A 14、答案: B 15、答案: B 16、【答案】C 17、答案: B 18、【答案】D
19、答案: A 20、答案: D
21、(1)解析: 原n(PCl5)=≈0.028 mol
设分解的PCl5的物质的量为x mol
PCl5(g) PCl3(g)+Cl2(g) 物质的量增加(Δn)
1 1 1 1
x mol
0.05 mol-0.028 mol
=0.022 mol
所以x=0.022
PCl5的分解率=×100%≈78.6%。
答案: 78.6%
(2)、解析: 开始加入KIO3溶液时,最先与IO反应的微粒是HSO,还原产物为I-,氧化产物为SO;当HSO反应完后,b点到c点发生反应的离子方程式为IO+5I-+6H+===3I2+3H2O。所以0点到b点参加反应的HSO的物质的量可利用电子守恒求解:n(HSO)×2e-=n(IO)×6e-,即x mol×2=1 mol×6,所以x=3。
答案: 3
(3)6NH3+5CH3OH+12O2=3N2+5CO2+19H2O,(2分) C、N(2分) 0.96(2分)
23.答案:(1)[Ar]3d24s2 (2)N>O (3)1 (4)正四面体 sp3
(5)CaTiO3 136/a3NA (3分)
24.(15分)(1)氯原子、碳碳双键(2分) 氧化反应(1分)
(2)Cl2 / 光照(1分)CH3-CHCl-CH3+NaOHCH2=CH-CH3+NaCl+H2O(2分)
取代反应(1分)
(3)3:1(1:3) ;乙酸; (2分)
(2分)