- 2021-08-06 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届贵州省思南中学高二上学期期末考试(2017
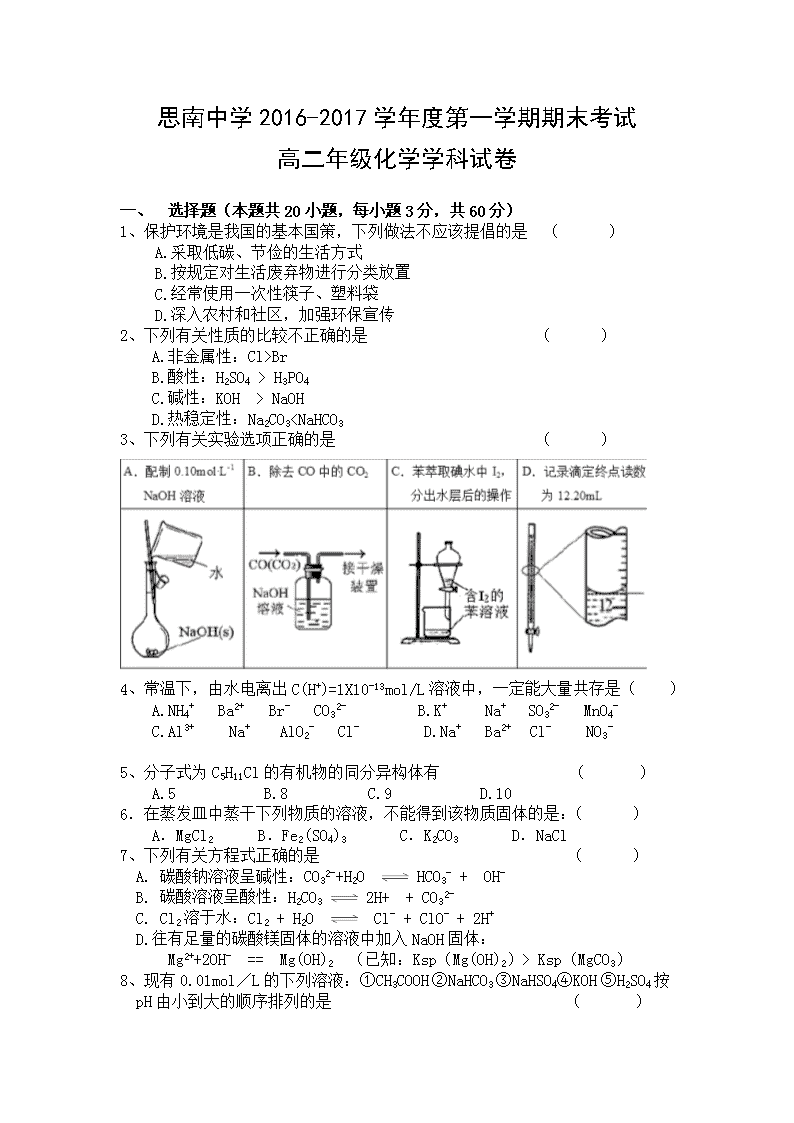
思南中学2016-2017学年度第一学期期末考试 高二年级化学学科试卷 一、 选择题(本题共20小题,每小题3分,共60分) 1、保护环境是我国的基本国策,下列做法不应该提倡的是 ( ) A.采取低碳、节俭的生活方式 B.按规定对生活废弃物进行分类放置 C.经常使用一次性筷子、塑料袋 D.深入农村和社区,加强环保宣传 2、下列有关性质的比较不正确的是 ( ) A.非金属性:Cl>Br B.酸性:H2SO4 > H3PO4 C.碱性:KOH > NaOH D.热稳定性:Na2CO3查看更多