2017-2018学年河南省平顶山市、许昌市、汝州高二上学期第二次(期中)联考化学试题
可能用到的相对原子质量: H-1 O-16 Na -23
第 I卷(选择题,共48分)
一、选择题:本题包括16小题,每小题2分,共48分。毎小题只有一个选项符合题意。
1、下列不属于新能源开发利用的是
A.太阳能热水器 B.天然气动力汽车 C.核能发电 D.风能发电
2、已知反应:H2(g)+I2(g)2HI(g) ΔH=-14.8 kJ • mol-1。则反应:HI(g)1/2 H2(g)+1/2 I2(g)的ΔH为
A.-7.4 kJ • mol-1 B. +7.4 kJ • mol-1 C. -14.8 kJ • mol-1 D. +14.8kJ • mol-1
3、下列电离方程式书写正确的是
A. H2OH++OH- B. H2S2H++S2-
C. NaHCO3Na++H++CO32- D. Fe(OH)3==Fe3++3OH-
4、25℃时,0.01 mol • L-1的盐酸中由水电离出的H+的浓度是
A. 1×10-14mol•L-1 B. 1×10-2mol•L-1 C. 1×10-7mol•L-1 D. 1×10-12mol•L-1
5、设反应:2NO2(g)N2O4(g) (△H <0)的正、逆反应速率分别为v1和v2,则温度升高时,v1和v2的变化情况为
A. v1增大, v2减小 B. v1减小,v2增大
C. v1和v2均增大 D. v1和v2减小
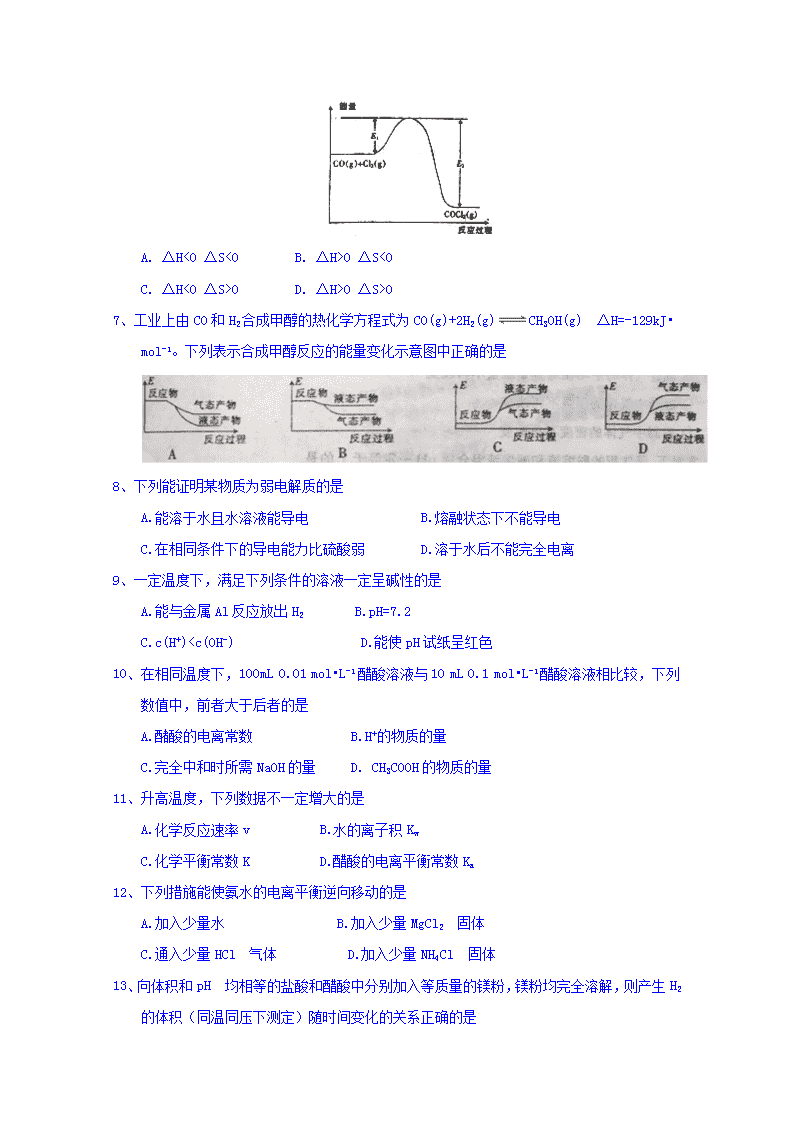
6、已知反应CO(g)+Cl2(g)COCl2(g),反应过程中能量的变化如图所示,下列有关该反应的ΔH、ΔS的说法中正确的是
A. ΔH<0 ΔS<0 B. ΔH>0 ΔS<0
C. ΔH<0 ΔS>0 D. ΔH>0 ΔS>0
7、工业上由CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g)CH3OH(g) △H=-129kJ•mol-1。下列表示合成甲醇反应的能量变化示意图中正确的是
8、下列能证明某物质为弱电解质的是
A.能溶于水且水溶液能导电 B.熔融状态下不能导电
C.在相同条件下的导电能力比硫酸弱 D.溶于水后不能完全电离
9、一定温度下,满足下列条件的溶液一定呈碱性的是
A.能与金属Al反应放出H2 B.pH=7.2
C.c(H+)
0。你认为该设想能否实现并说明理由:__________________________。
(2)用活性炭还原法可以处理汽车尾气中的氮氧化物。某研究小组在2 L的恒容密闭容器中加人0.100 mL NO 和2.030 mol固体活性炭,发生反应:C(s)+2NO(g) N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如下表:
T/℃
n(固体活性炭)/mol
N(NO)/mol
N(N2)/mol
N(CO2)/mol
200
2.000
0.040
0.030
0.030
350
2.005
0.050
0.025
0.025
①该反应的正反应为___________(填“吸热”或“放热”)反应。
②200℃时,反应达到平衡后向恒容容器中再充入0.100 mol NO,再次达到平衡后,混合气中NO的百分含量将__________(填“增大”“减小”或“不变”)。
③上述反应在350℃时的平衡常数K=_______________。
(3)在密闭容器中发生上述反,,达到平衡时,下列措施能提高NO转化率的是___________(填字母)。
A.选用更高效的催化剂 B.增加C(s)的量
C.降低反应体系的温度 D.缩小容器的体积
21、(6分)羰基硫(COS)能引起催化剂中毒,使化学产品质量下降并引发大气污染,因此工业排放COS前必须对其进行脱硫处理,发生的反应如下:COS(g)+H2(g)H2S(g)+CO(g) 。.
(1)在480 K 时,将0.l0mol COS(g) 与0.40mol H2(g)充入2.5 L 的空钢瓶中,反应达到平衡后H2S 的物质的量分数为2%。
①COS的平衡转化率a1=_________ %。
②在500 K 时重复实验,测得平衡后H2S的物质的量分数为3%,则COS的转化率a2____________(填“>”“<”或“=”,下同)a,该反应的△H________0。
(2)若分别向钢瓶中再充入下列气体,能使COS转化率增大的是___________(填字母)。
A.COS B.H2 C.H2S D.N2
22、(8分)某研究性学习小组用浓度为0.20 mol·L-1的盐酸标准液滴定含有一定量杂质的烧碱样品(杂质与酸不反应)溶于水形成的溶液。
(1)准确量取一定体积的待测液需要使用的仪器是______________。
(2)若滴定开始和结束时,滴定管中的液面如图所示,则消耗盐酸标准液的体积为________mL。
(3)滴定时,若以酚酞为指示剂,滴定达到终点的标志是______________________________。
(4)将准确称取的5.0g烧碱样品配制成250mL 待测液,并用盐酸标准液滴定。滴定前读数及滴定后读数如下表所示。
滴定次数
待测液体积(mL)
0.20 mol·L-1的盐酸体积(mL)
滴定前读数
滴定后读数
第一次
10.00
0.70
20. 60
第一次
10.00
4.00
24.10
第三次
10.00
1.10
21.10
由实验数据可知,烧碱的纯度为__________。
(5)下列操作会导致测得的待测液的浓度偏大的是________(填字母)。
a.部分标准液滴出锥形瓶外 b.用待测溶液润洗锥形瓶
C.锥形瓶洗净后还留有蒸馏水 d.放出碱液的滴定管开始有气泡,放出液体后气泡消失
1-5 BBADC 6-10 AADCB 11-16 CDBAAC
17、(1)放热(2分)
(2)减小(2分);不变(2分)
(3)2H2S(g)+3O2(g)==2SO2(g)+2H2O(g) △H=-1036.4kJ•mol-1 (2分)
18、(1)C(2 分);0.5 mol·L-1(2分)
(2)0.0375 mol·L-1·.min-1(2分);-94.4(2分)
(3)增大(1分);增大(1分)
19、(1)H2CO3(1分)
(2) (2分)
(3)HCO3-= CO32-+H+(2分)
(4)H2SO3+CH3COO-==HSO3-+CH3COOH(2分)
(5)大于(1分);pH 值相同的醋酸溶液和HX溶液稀释相同的倍数时,HX的PH 变化程度更大,则HX酸性更强,电离平衡常数更大(2分)
20、(1)不能实现。该反应是焓增、嫡减的反应,根据ΔG=ΔH-TΔS,ΔG>0,反应不能自发进行(2分,判断和理由各1分)
(2)①放热(2分)
②不变(2分)
③0.25(2分)
(3)C(2分)
21、(1)①10(2分)
②>(1分);> (1分)
(2)B(2分)
22、(1)碱式滴定管(或移液管) (1分)
(2)26.10(1分)
(3)滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不恢复红色(2分)
(4)80%(2分)
(5)ab(2分)