- 2021-08-06 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】陕西省西安中学2020届高三第三次模拟考试
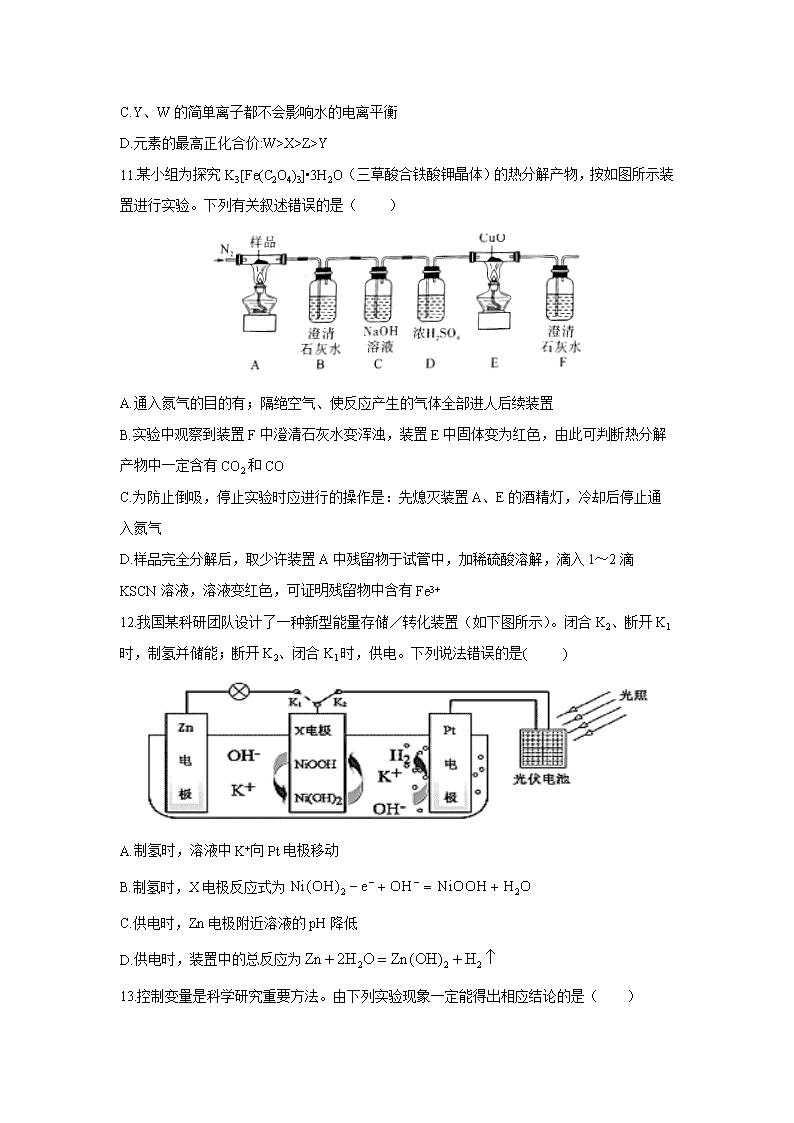
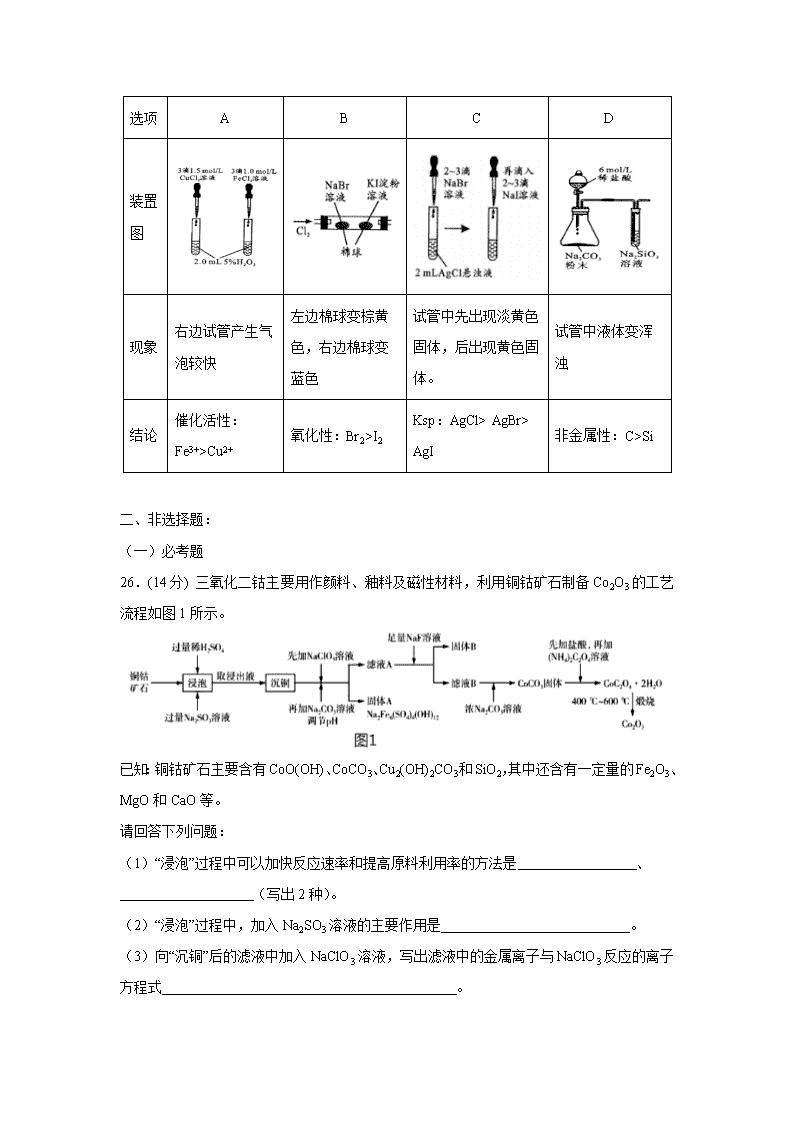
陕西省西安中学2020届高三第三次模拟考试 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Ca 40 Fe 56 Ni 59 一、选择题: 7.在2020年抗击新型冠状病毒肺炎的战役中,化学品发挥了重要作用。下列说法中错误的是( ) A.生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料 B.过氧化氢、过氧乙酸等消毒液均可以将病毒氧化而达到消毒的目的 C.84消毒液是以NaClO为主要有效成分的消毒液,与医用酒精混合可以提升消毒效果 D.硝酸铵制成的医用速冷冰袋利用了硝酸铵溶于水吸热的性质 8.设 NA 表示阿伏加德罗常数的值,下列说法中不正确的是( ) A.100 g 46%甲酸(HCOOH)水溶液所含的氧原子数为 5NA B.将 CO2 通过 Na2O2 使其质量增加 a g 时,反应转移的电子数为 NA C.用惰性电极电解 100 mL 0.1 mol•L﹣1 的 CuSO4 溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为 0.04NA D.常温下,含 0.5 mol NH4NO3 与 x mol NH3•H2O 的中性溶液中,含有 NH4+的数目为 0.5NA 9.下列说法正确的是( ) A.1mol萘()含有5mol碳碳双键 B.CH3CH=CHCH3分子中的所有原子处于同一平面 C.立方烷()的六氨基(—NH2)取代物有3种 D.可用溴水鉴别苯、四氯化碳、己烷 10.X、Y、Z、W是原子序数依次增大的短周期主族元素。Y原子在短周期主族元素中原子半径最大,X和Y能组成两种阴阳离子个数之比相同的离子化合物。常温下,0.1 mol·L-1 W的氢化物水溶液的pH为1。向ZW3的水溶液中逐滴加入Y的最高价氧化物对应的水化物,先产生白色沉淀,后沉淀逐渐溶解。下列推断正确的是( ) A.简单离子半径:W>Y>Z>X B.Y、Z分别与W形成的化合物均为离子化合物 C.Y、W的简单离子都不会影响水的电离平衡 D.元素的最高正化合价:W>X>Z>Y 11.某小组为探究K3[Fe(C2O4)3]•3H2O(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验。下列有关叙述错误的是( ) A.通入氮气的目的有;隔绝空气、使反应产生的气体全部进人后续装置 B.实验中观察到装置F中澄清石灰水变浑浊,装置E中固体变为红色,由此可判断热分解产物中一定含有CO2和CO C.为防止倒吸,停止实验时应进行的操作是:先熄灭装置A、E的酒精灯,冷却后停止通入氮气 D.样品完全分解后,取少许装置A中残留物于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,可证明残留物中含有Fe3+ 12.我国某科研团队设计了一种新型能量存储/转化装置(如下图所示)。闭合K2、断开K1时,制氢并储能;断开K2、闭合K1时,供电。下列说法错误的是( ) A.制氢时,溶液中K+向Pt电极移动 B.制氢时,X电极反应式为 C.供电时,Zn电极附近溶液的pH降低 D.供电时,装置中的总反应为 13.控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是( ) 选项 A B C D 装置图 现象 右边试管产生气泡较快 左边棉球变棕黄色,右边棉球变蓝色 试管中先出现淡黄色固体,后出现黄色固体。 试管中液体变浑浊 结论 催化活性:Fe3+>Cu2+ 氧化性:Br2>I2 Ksp:AgCl> AgBr> AgI 非金属性:C>Si 二、非选择题: (一)必考题 26.(14分) 三氧化二钴主要用作颜料、釉料及磁性材料,利用铜钴矿石制备Co2O3的工艺流程如图1所示。 已知:铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。 请回答下列问题: (1)“浸泡”过程中可以加快反应速率和提高原料利用率的方法是 、 (写出2种)。 (2)“浸泡”过程中,加入Na2SO3溶液的主要作用是 。 (3)向“沉铜”后的滤液中加入NaClO3溶液,写出滤液中的金属离子与NaClO3反应的离子方程式 。 (4)温度、pH对铜、钴浸出率的影响如图2、图3所示: ①“浸泡”铜钴矿石的适宜条件为 。 ②图2中pH增大时铜、钴浸出率下降的原因可能是 。 (5)CoC2O4•2H2O在空气中高温煅烧得到Co2O3的化学方程式是 。 (6)一定温度下,向滤液A中加入足量的NaF溶液可将Ca2+、Mg2+沉淀而除去,若所得滤液B中c(Mg2+)=1.0×10﹣5 mol•L﹣1,则滤液B中c(Ca2+)为 。[已知该温度下Ksp(CaF2)=3.4×10﹣11,Ksp(MgF2)=7.1×10﹣11] 27.(14分) 1,2﹣二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为 3﹣氯丙烯(CH2=CHCH2Cl),反应原理为: Ⅰ. CH2=CHCH3(g)+Cl2(g)⇌ CH2ClCHClCH3(g)△H1=﹣134 kJ/mol﹣1 Ⅱ. CH2=CHCH3(g)+Cl2(g)⇌ CH2=CHCH2Cl(g)+HCl(g)△H2=﹣102 kJ/mol﹣1 请回答下列问题: (1)已知CH2=CHCH2C1(g)+HCl(g) ⇌ CH2C1CHClCH3(g)的活化能 Ea(正)为 132 kJ/mol﹣1,则该反应的活化能 Ea(逆)为 kJ/mol﹣1。 (2)一定温度下,密闭容器中发生反应Ⅰ和反应Ⅱ,达到平衡后增大压强,CH2C1CHC1CH3的产率____________(填“增大”“减小”或“不变”),理由是__________________________。 (3)一定温度下,向恒容密闭容器中充入等物质的量的 CH2=CHCH3(g)和 Cl2(g),在催化剂作用下发生反应Ⅰ、Ⅱ,容器内气体的压强随时间的变化如表所示。 时间/min 0 60 120 180 240 300 360 压强/kPa 80 74.2 69.4 65.2 61.6 57.6 57.6 ①若用单位时间内气体分压的变化来表示反应速率,即v=,则前 120 min 内平均反应速率v(CH2ClCHClCH3)= kPa•min﹣1 (保留小数点后 2 位)。 ②该温度下,若平衡时 HCl 的体积分数为,则丙烯的平衡总转化率 α= ;反应Ⅰ的平衡常数Kp= kPa﹣1(Kp 为以分压表示的平衡常数,保留小数点后 2 位 )。 (4)某研究小组向密闭容器中充入一定量的 CH2=CHCH3(g)和 Cl2(g),分别在 A、B 两种不同催化剂作用下发生反应,一段时间后测得 CH2ClCHClCH3(g)的产率与温度的关系如图所示。下列说法错误的是 (填代号) a.使用催化剂 A 的最佳温度约为 250℃ b.相同条件下,改变压强会影响 CH2ClCHClCH3(g)的产率 c.P点是对应温度下 CH2ClCHClCH3(g)的平衡产率 d.提高 CH2ClCHClCH3(g)反应选择性的关键因素就是控制温度 28. (15分)乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O ,相对分子质量为288)易溶于水,是一种很好的补铁剂,可由乳酸[CH3CH(OH)COOH]与FeCO3反应制得。 I.碳酸亚铁的制备(装置如图所示) (1)仪器A的名称是 ;实验操作如下:打开k1、k2,加入适量稀硫酸,关闭k1,使反应进行一段时间,其目的是 。 (2)接下来要使仪器C中的制备反应发生,需要进行的操作是 ,其反应的离子方程式为 。 (3)仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是 。 Ⅱ.乳酸亚铁的制备及铁元素含量测定 向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在隔绝空气的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。 (4)两位同学分别用不同的方案进行铁元素含量测定: ①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于100%,其原因可能是 。 ②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成100mL溶液。吸取 25.00mL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液 ,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为______ %保留1位小数 。 (二)选考题: 35. [化学—选修3:物质结构与性质](15分) 2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF﹣3IA洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题: (1)基态铁原子的价电子排布式为 。 (2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的 区。 (3)实验室常用KSCN溶液、苯酚检验Fe3+.其中N、O、S的第一电离能由大到小的顺序为 (用元素符号表示),苯酚中碳原子的杂化轨道类型为 。 (4)铁元素能与CO形成Fe( CO)5.羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol Fe( CO)5分子中含 mol σ键,与CO互为等电子体的一种离子的化学式为 。 (5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的 空隙和 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(,0,),C(1,1,1)等,则距离A 位置最近的阳离子的原子坐标参数为 。 (6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为 ,晶胞参数为428 pm,则晶体密度为 g/cm3(NA表示阿伏伽德罗常数的值,列出表达式)。 36. [化学—选修5:有机化学基础](15分) 一种合成聚碳酸酯塑料(PC塑料)的路线如下: 已知:①酯与含羟基的化合物可发生如下酯交换反应RCOOR'+R"OH RCOO R"+ R'OH ②PC塑料结构简式为: (1)C中的官能团名称是_________,检验C中所含官能团的必要试剂有_________。 (2)D的系统命名为___________________。 (3)反应II的反应类型为______________。 (4)反应IV的化学方程式为____________________________________________。 (5)1molPC塑料与足量NaOH溶液反应,最多消耗_________molNaOH。 (6)反应I生成E时会生成副产物F(C9H12O2),其苯环上一氯代物有两种,则F的结构简式为_____________________________;写出满足下列条件的F的同分异构体的结构简式________________________(任写一种) ①分子中含有苯环,与NaOH溶液反应时物质的量为1:2 ②核磁共振氢谱显示有5种不同化学环境的氢,且峰面积之比为6:2:2:1:1 【参考答案】 一、选择题(本题共7小题,每小题6分,共42分。每小题只有一项符合题目要求。) 题号 7 8 9 10 11 12 13 答案 C B C C B D A 二、非选择题(包括必考题和选考题两部分,共58分) (一)必考题 (共43分) 26、(共14分,除标注问题外,每空两分) (1)升温、粉碎矿石、适当增加稀硫酸浓度(答案合理均给分)(两空,每空1分) (2)将Co3+、Fe3+还原为Co2+、Fe2+ (3)ClO3﹣+6Fe2++6H+═Cl﹣+6Fe3++3H2O (4)①温度:65℃~75℃、pH:0.5~1.5 ②pH升高后溶液中c(H+)浓度下降,使得溶解CoO(OH)、CoCO3、Cu2(OH)2CO3的能力下降 (5)4CoC2O4•2H2O+3O22Co2O3+8CO2+8H2O (6)4.8×10﹣6mol/L 27、(每空两分,共计14分) (1)164 (2)增大 增大压强,反应ii的平衡不移动,反应i的平衡正向移动。所以CH2C1CHC1CH3的产率增大 (3)0.09 74% 0.21 (4)cd 28、(15分,除标注问题外,每空两分) (1)分液漏斗(1分)生成溶液,且用产生的排尽装置内的空气,防止二价铁被氧化 (2)关闭 (3)取最后一次水洗液于试管中,加入过量稀盐酸酸化,滴加一定量的溶液,若无白色浑浊出现,则洗涤干净。 (4)①乳酸根中羟基能被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾溶液偏多 ②蓝色褪去且半分钟不恢复 (二)选考题 (共15分) 35. (15分,除标注试题外每空1分) (1)3d64s2(2)s、ds(2分)(3)N>O>S sp2杂化 (4)10 CN﹣ (5)正四面体正八面体(,,)(2分) (6)8:3(2分)*(2分) 36. (15分,除标注外每空两分) 溴原子(1分) NaOH溶液、稀硝酸、硝酸银溶液 2-丙醇氧化反应 4n 等查看更多