- 2021-08-06 发布 |
- 37.5 KB |
- 6页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年安徽省合肥九中高二上学期第二次月考化学试题(Word版)
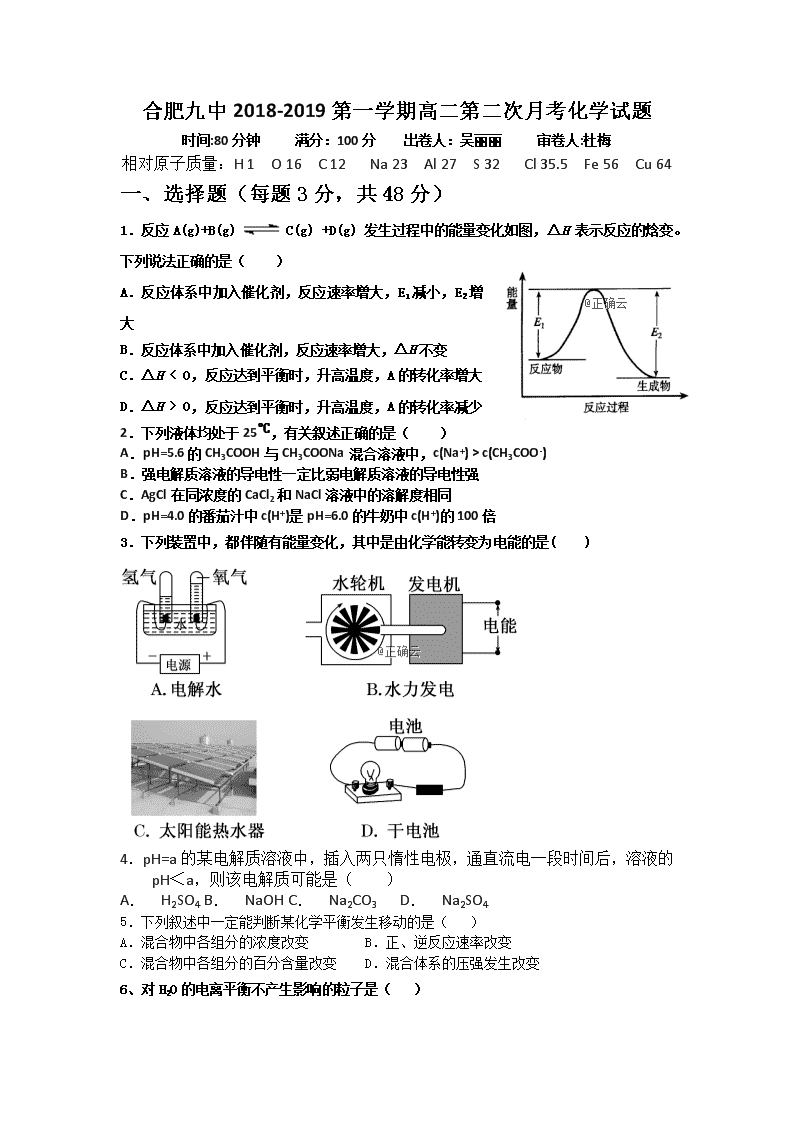
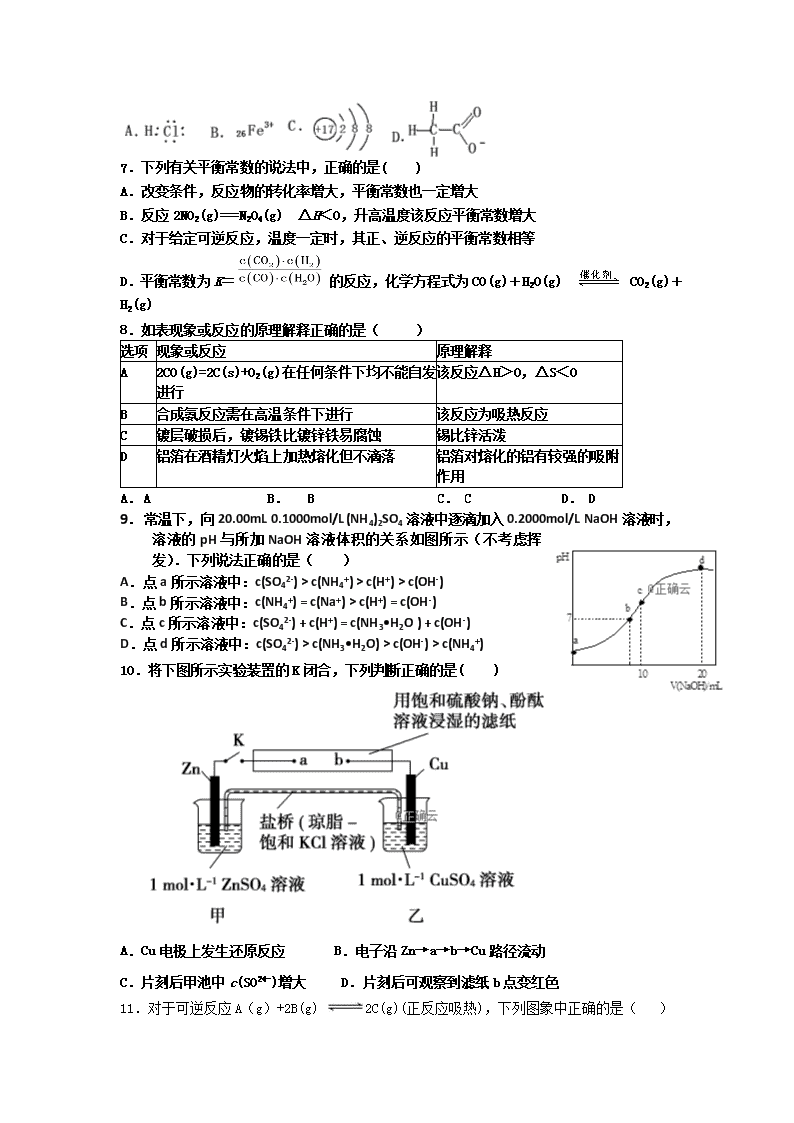
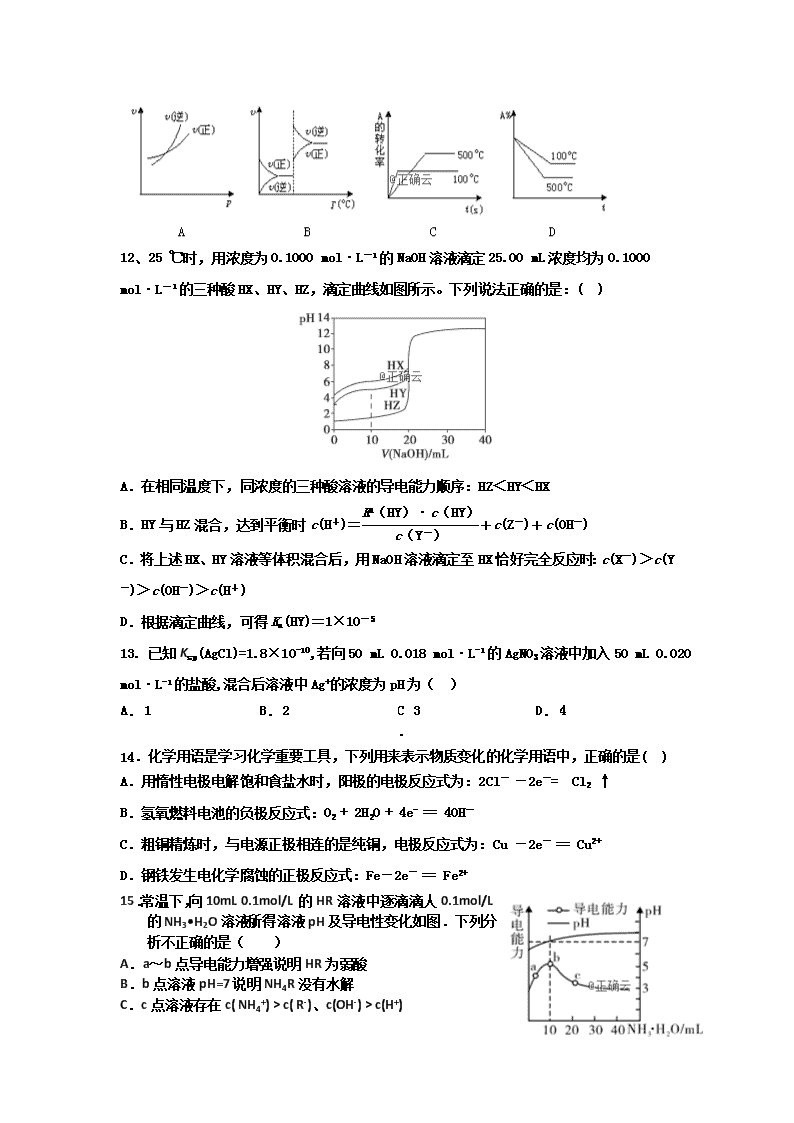
合肥九中2018-2019第一学期高二第二次月考化学试题 时间:80分钟 满分:100分 出卷人:吴丽丽 审卷人:杜梅 相对原子质量:H 1 O 16 C 12 Na 23 Al 27 S 32 Cl 35.5 Fe 56 Cu 64 一、选择题(每题3分,共48分) 1.反应A(g)+B(g) C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是( ) A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大 B.反应体系中加入催化剂,反应速率增大,△H不变 C.△H < 0,反应达到平衡时,升高温度,A的转化率增大 D.△H > 0,反应达到平衡时,升高温度,A的转化率减少 2.下列液体均处于25℃,有关叙述正确的是( ) A.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-) B.强电解质溶液的导电性一定比弱电解质溶液的导电性强 C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 D.pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍 3.下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( ) 4.pH=a的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,溶液的pH<a,则该电解质可能是( ) A. H2SO4 B. NaOH C. Na2CO3 D. Na2SO4 5.下列叙述中一定能判断某化学平衡发生移动的是( ) A.混合物中各组分的浓度改变 B.正、逆反应速率改变 C.混合物中各组分的百分含量改变 D.混合体系的压强发生改变 6、对H2O的电离平衡不产生影响的粒子是( ) 7.下列有关平衡常数的说法中,正确的是( ) A.改变条件,反应物的转化率增大,平衡常数也一定增大 B.反应2NO2(g)===N2O4(g) ΔH<0,升高温度该反应平衡常数增大 C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等 D.平衡常数为K= 的反应,化学方程式为CO(g)+H2O(g) 催化剂 CO2(g)+H2(g) 8.如表现象或反应的原理解释正确的是( ) 选项 现象或反应 原理解释 A 2CO (g)=2C(s)+O2(g)在任何条件下均不能自发进行 该反应△H>0,△S<0 B 合成氨反应需在高温条件下进行 该反应为吸热反应 C 镀层破损后,镀锡铁比镀锌铁易腐蚀 锡比锌活泼 D 铝箔在酒精灯火焰上加热熔化但不滴落 铝箔对熔化的铝有较强的吸附作用 A. A B. B C. C D. D 9.常温下,向20.00mL 0.1000mol/L (NH4)2SO4溶液中逐滴加入0.2000mol/L NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( ) A.点a所示溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-) B.点b所示溶液中:c(NH4+) = c(Na+) > c(H+) = c(OH-) C.点c所示溶液中:c(SO42-) + c(H+) = c(NH3•H2O ) + c(OH-) D.点d所示溶液中:c(SO42-) > c(NH3•H2O) > c(OH-) > c(NH4+) 10.将下图所示实验装置的K闭合,下列判断正确的是( ) A.Cu电极上发生还原反应 B.电子沿Zn→a→b→Cu路径流动 C.片刻后甲池中c(SO)增大 D.片刻后可观察到滤纸b点变红色 11.对于可逆反应A(g)+2B(g) 2C(g)(正反应吸热),下列图象中正确的是( ) 12、25 ℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定25.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是:( ) A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX B.HY与HZ混合,达到平衡时c(H+)=+c(Z-)+c(OH-) C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) D.根据滴定曲线,可得Ka(HY)=1×10-5 13. 已知Ksp(AgCl)=1.8×10-10,若向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,混合后溶液中Ag+的浓度为pH为( ) A. 1 B. 2 C. 3 D. 4 14.化学用语是学习化学重要工具,下列用来表示物质变化的化学用语中,正确的是( ) A.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑ B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH- C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+ D.钢铁发生电化学腐蚀的正极反应式:Fe-2e- == Fe2+ 15.常温下,向10mL 0.1mol/L的HR溶液中逐滴滴人0.1mol/L的NH3•H2O溶液,所得溶液pH及导电性变化如图.下列分析不正确的是( ) A.a~b点导电能力增强说明HR为弱酸 B.b点溶液pH=7说明NH4R没有水解 C.c点溶液存在c( NH4+) > c( R-)、c(OH-) > c(H+) D.b~c任意点溶液均有c(H+) × c(OH-)=Kw=l.0×l0-14 16.一定温度下,下列溶液的离子浓度关系式正确的是( ) A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10 -5 mol·L-1 B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 C.pH=2的H2CO3溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HCO3-) D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ 二、非选择题(52分) 17.(6分)依据氧化还原反应:2Fe3+(aq)+Fe(s)=3Fe2+(aq),请设计成一个能产生持续稳定电流的原电池装置。并写出电极反应式: (1)请画出你所设计出的原电池的装置图 (2)正极发生的电极反应式___________; 负极发生的电极反应式________________ 18.(14分)合肥市某工厂废水中含游离态氯(即含有氯分子Cl2),通过下列实验测定其浓度: ①取废水样10.0 mL于锥形瓶,加入10.0 mL KI溶液(足量),滴入指示剂2~3滴。 ②取一滴定管依次用自来水,蒸馏水洗净,然后就注入0.01 mol·L-1的Na2S2O3标准液,调整液面,记下读数。 ③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6 (Na2S4O6溶液为无色)。试回答下列问题: (1)步骤①加入的指示剂是________。 (2)步骤①反应的离子方程式是___________________________________。 (3)步骤③当待测液由________色变为________色且30 s不再变化即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为________。 (4)按照上述实验操作,最后会导致所测得的Cl2的物质的量浓度会比实际浓度________(填“偏大”、“偏小”或“相等”)。 (5)若读Na2S2O3溶液的体积不规范,没有平视,滴定前仰视,滴定后又俯视,最后会导致所测得的Cl2的物质的量浓度会比实际浓度________(填“偏大”、“偏小”或“相等”)。 19(16分).已知金属活动性相差越大,形成原电池时越容易放电.请根据如图装置回答问题: (1)A、B、C三个装置中作为原电池的是 ______ . (2)写出下列电极上发生的反应: ②极 ____________ , ⑥极 ____________ . (3)当电路上有1mol电子流过时:①极上质量变化 ______ g,⑥极上质量变化 ______ g. (4)一段时间后溶液中pH值的变化:A ______ ,B ______ ,C ______ .(填增大、减小或不变) 20( 16分)现有25 ℃时0.1 mol·L-1的氨水,请回答以下问题: (1)若向氨水中加入少量硫酸铵固体,此时溶液中____(填“增大”、“减小”或“不变”)。 (2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:__________________ ; 所得溶液的pH________7(填“>”、“<”或“=”),用离子方程式表示其原因:_______________; 所得溶液中各离子物质的量浓度由大到小的顺序是____________________。 (3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH)=a moL.L-1,则c(SO42-)为________。 (4) 已知25℃时,CH3COONH4溶液呈中性. 将0.1mol•L-1的CH3COOH溶液与0.1mol•L-1的NaOH溶液等体积混合(混合溶液的体积变化忽略不计),测得混合溶液的pH=9.回答下列问题: ①用离子方程式表示混合溶液的pH=9的原因 ______________ . ②混合后溶液中c(CH3COOH) = ______ mol•L-1(填写精确值) 合肥九中2018-2019第一学期高二第二次月考试题答案 一、选择题(每题3分,共48分) 1 2 3 4 5 6 7 8 B D B A C C D A 9 10 11 12 13 14 15 16 C A D D B A B D 17.(每空2分,共6分) (1)装置图省略 (2)2Fe3++2e- =2Fe2+ ; Fe - 2e- = Fe2+ 18 (每空2分,共14 分) (1)淀粉溶液 ; (2)Cl2+2I-===I2+2Cl- ; (3)蓝 ; 无 ; 0.01 mol·L-1 ; (4)偏大 ; (5)偏小 ; 19(每空2分,共16 分) (1) C; (2) Ag+ + e- = Ag; Zn-2e- = Zn2+; (3) 增加108; 减少32.5; (4) 不变; 增大; 增大。 20(每空2分,共16分)、 (1) 减小 (2) NH3·H2O+H+===NH+H2O ; < ; NH+H2ONH3·H2O+H+ ; c(NH)>c(SO)>c(H+)>c(OH-) ; (3) a/2 mol·L-1 (4) CH3COO- + H2O ⇋ CH3COOH +OH-; (1×10-5 - 1×10-9);查看更多