- 2021-08-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年山东省淄博第一中学高二1月月考化学试题(Word版)
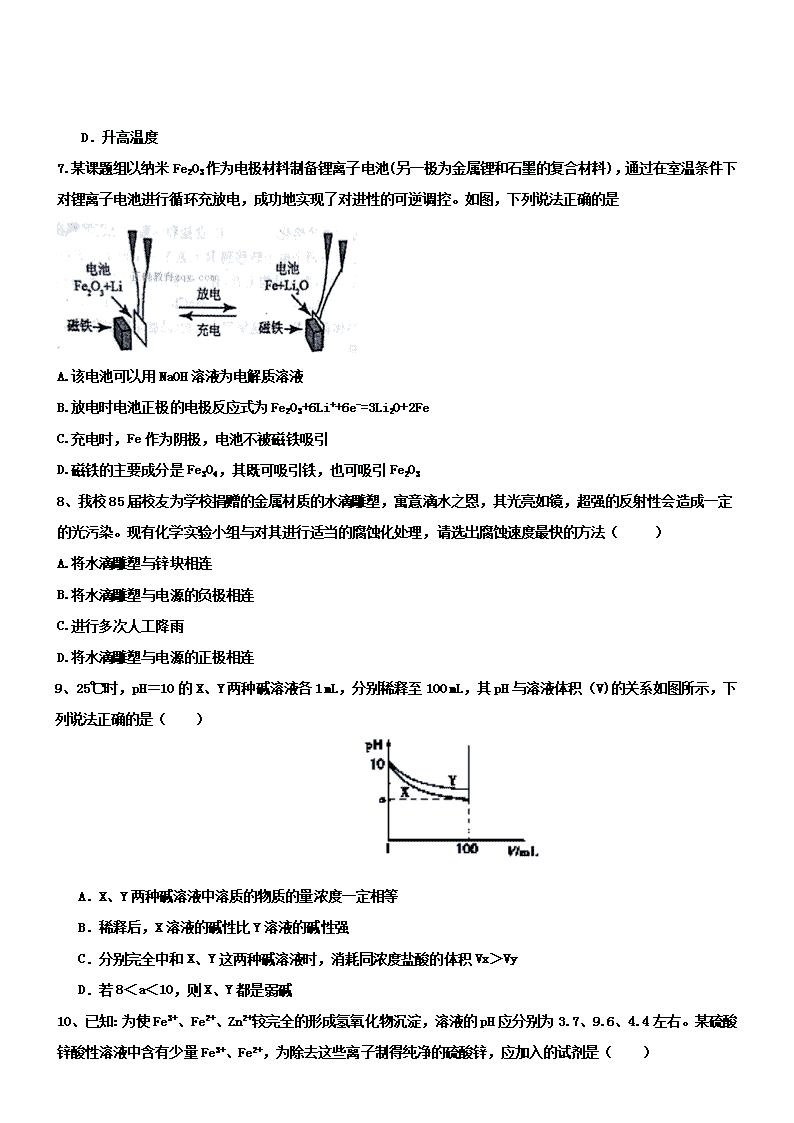
2017-2018学年山东省淄博第一中学高二1月月考 化学试题 2018年1月 第Ⅰ卷(选择题60分) 相对原子质量: Ag: 108 S: 32 C: 12 N: 14 Na: 23 Cu: 64 Cl: 35.5 一、选择题(每小题只有一个选项正确,每小题3分,共20小题) 1、将pH试纸测定某无色溶液的pH时,规范的操作是( ) A.用pH试纸放入溶液中,观察其颜色变化,跟标准比色卡比较 B.将溶液倒在pH试纸上跟标准比色卡比较 C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 2、下列说法中,正确的是( ) A.泡沫灭火器的内桶盛硫酸铝溶液,外桶和内桶之间装有碳酸氢钠溶液。 B.易潮解的试剂都要用带磨口玻璃塞的广口瓶保存 C.电解精炼铜时,粗铜中的金、银、锌等形成阳极泥而与铜分离 D.对一个吸热反应来说,加入催化剂,该化学反应的反应热减少 3、下列有关化学用语表示正确的是 A.NH4I的电子式: B.含78 个中子的碘原子: C.二氧化硅的分子式:SiO2 D.HClO 的结构式: H-Cl-O 4、下列溶液加热蒸干、灼烧后,能得到溶质固体的是( ) A.AlCl3 B.KHCO3 C.Fe2(SO4)3 D.NH4HCO3 5、相同温度下等物质的量浓度的下列溶液中,pH值最小的是( ) A.NH4C1 B.NH4HC03 C.NH4HS04 D.(NH4)2S04 6、已知0.1 mol/L的醋酸溶液中存在电离平衡: CH3COOHCH3COO-+H+ 要使溶液中 c(H+)/c(CH3COOH)比值增大,可以采取的措施是( ) A.加少量CH3COONH4固体 B.加少量冰醋酸 C.加少量NaOH固体 D.升高温度 7.某课题组以纳米Fe203作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对进性的可逆调控。如图,下列说法正确的是 A.该电池可以用NaOH溶液为电解质溶液 B.放电时电池正极的电极反应式为Fe2O3+6Li++6e-=3Li2O+2Fe C.充电时,Fe作为阴极,电池不被磁铁吸引 D.磁铁的主要成分是Fe3O4,其既可吸引铁,也可吸引Fe2O3 8、我校85届校友为学校捐赠的金属材质的水滴雕塑,寓意滴水之恩,其光亮如镜,超强的反射性会造成一定的光污染。现有化学实验小组与对其进行适当的腐蚀化处理,请选出腐蚀速度最快的方法( ) A.将水滴雕塑与锌块相连 B.将水滴雕塑与电源的负极相连 C.进行多次人工降雨 D.将水滴雕塑与电源的正极相连 9、25℃时,pH=10的X、Y两种碱溶液各1 mL,分别稀释至100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( ) A.X、Y两种碱溶液中溶质的物质的量浓度一定相等 B.稀释后,X溶液的碱性比Y溶液的碱性强 C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积Vx>Vy D.若8<a<10,则X、Y都是弱碱 10、已知:为使Fe3+、Fe2+、Zn2+较完全的形成氢氧化物沉淀,溶液的pH应分别为3.7、9.6、4.4左右。某硫酸锌酸性溶液中含有少量Fe3+、Fe2+,为除去这些离子制得纯净的硫酸锌,应加入的试剂是( ) A.NaOH溶液 B.氨水 C.KMnO4、ZnCO 3 D.H2O2、ZnO 11、据报道,以NaBH4和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法错误的是( ) A. 该电池的总反应为NaBH4 + 4H2O2=NaBO2 + 6H2O B. 电池放电时Na+从b极区移向a极区 C. 每消耗1mol H2O2,转移的Na+的物质的量为2mol D. 纳米MnO2层的作用是提高原电池的工作效率 12、一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应式为:2C2H6+7O2+8KOH == 4K2CO3+10H2O,有关此电池的推断正确的是( ) A.每消耗1mol C2H6,则电路上转移的电子为14 mol B.负极反应为7O2+14 H2O+28e— == 28OH— C.放电一段时间后,负极周围的pH升高 D.放电过程中KOH的物质的量浓度不变 13、现有 ① Na2CO3溶液 ② CH3COONa溶液 ③ NaOH溶液各25mL,物质的量浓度均为0.1mol·L-1,下列说法正确的是( ) A.3种溶液pH的大小顺序是 ③>②>① B.若将3种溶液稀释相同倍数,pH变化最大的是② C.若分别加入25mL0.1mol·L-1盐酸后,pH最大的是① D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② 14、已知25℃时,下列酸的电离常数:醋酸(CH3COOH):、氢氰酸(HCN):、 氢氟酸(HF):、甲酸(HCOOH):。下列说法不正确的是( ) A.物质的量浓度均为0.1mol·L-1的上述溶液酸性最强的是:氢氟酸 B.物质的量浓度均为0.1mol·L-1的CH3COONa和NaF溶液中,CH3 COOH的浓度大于HF的浓度,NaF溶液的pH比CH3COONa溶液大。 C.0.1mol·L-1的HCN和NaCN溶液等体积混合的溶液显碱性,则溶液中的c(CN-)查看更多