2019-2020学年云南省玉溪一中高二上学期第二次月考化学试题 word版
玉溪一中2019-2020学年高二上学期第二次月考
化学试卷
时间:100分钟 满分100分
可能用到的相对原子质量: O 16 Na 23 I 127
一、选择题:本题共21个小题,每小题2分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质
实际应用
A.
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B.
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C.
次氯酸盐具有氧化性
漂白粉漂白织物
D.
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
2.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
A.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA
B.在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA
C. 1.0 L的0.1 mol.L-1Na2S溶液中含有的S2-离子数为0.1NA
D.标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA
3.a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和C+离子的电子层结构相同,d与b同族。下列叙述错误的是( )
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d和a形成的化合物的溶液呈弱酸性
4.下列说法正确的是( )
A.用广泛PH试纸测量某溶液PH值为5.6
B.用已知浓度的KOH溶液滴定未知浓度的CH3COOH溶液,用甲基橙做指示剂
C.配制FeCl3溶液时,先将FeCl3固体溶解在少量浓盐酸中,再加水稀释至刻度
D.草木灰(K2CO3)和NH4NO3混合使用效果更好
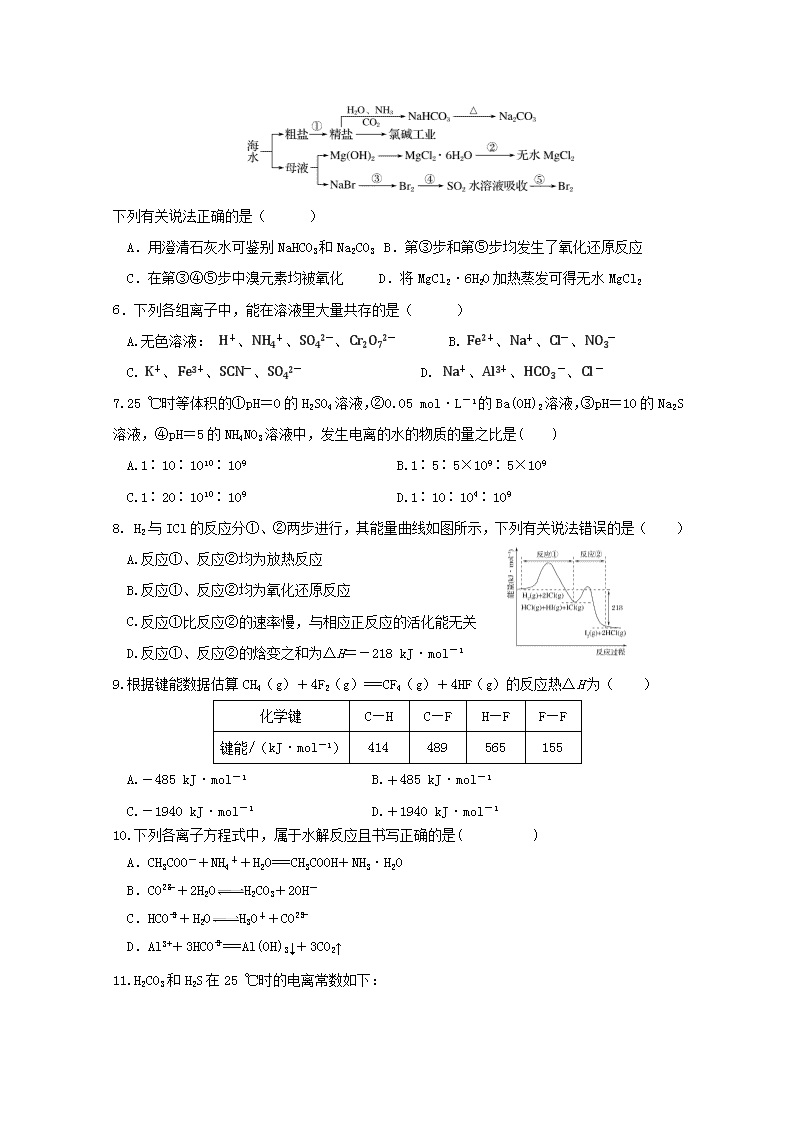
5.海洋中有丰富的资源,下图为海水资源利用的部分过程。
下列有关说法正确的是( )
A.用澄清石灰水可鉴别NaHCO3和Na2CO3 B.第③步和第⑤步均发生了氧化还原反应
C.在第③④⑤步中溴元素均被氧化 D.将MgCl2·6H2O加热蒸发可得无水MgCl2
6.下列各组离子中,能在溶液里大量共存的是( )
A.无色溶液: H+、NH4+、SO42-、Cr2O72- B. Fe2+、Na+、Cl-、NO3-
C. K+、Fe3+、SCN-、SO42- D. Na+、Al3+、HCO3一、Cl一
7.25 ℃时等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1∶10∶1010∶109 B.1∶5∶5×109∶5×109
C.1∶20∶1010∶109 D.1∶10∶104∶109
8. H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是( )
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能无关
D.反应①、反应②的焓变之和为ΔH=-218 kJ·mol-1
9.根据键能数据估算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为( )
化学键
C—H
C—F
H—F
F—F
键能/(kJ·mol-1)
414
489
565
155
A.-485 kJ·mol-1 B.+485 kJ·mol-1
C.-1940 kJ·mol-1 D.+1940 kJ·mol-1
10.下列各离子方程式中,属于水解反应且书写正确的是( )
A.CH3COO-+NH4++H2O===CH3COOH+NH3·H2O
B.CO+2H2OH2CO3+2OH-
C.HCO+H2OH3O++CO
D.Al3++3HCO===Al(OH)3↓+3CO2↑
11.H2CO3和H2S在25 ℃时的电离常数如下:
电离常数
K1
K2
H2CO3
4.2×10-7
5.6×10-11
H2S
5.7×10-8
1.2×10-15
则下列反应可能发生的是( )
A.NaHCO3+NaHS===Na2CO3+H2S B.H2S+Na2CO3===NaHS+NaHCO3
C.Na2S+H2O+CO2===H2S+Na2CO3 D.H2S+NaHCO3===NaHS+H2CO3
12.室温下,下列溶液中微粒浓度关系一定正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中,加水稀释,的值减小
B.pH=7的氨水与氯化铵的混合溶液中:c(Cl-)>c(NH)
C.0.1 mol·L-1的硫酸铝溶液中:c(SO)>c(Al3+)>c(H+)>c(OH-)
D.pH=2的醋酸溶液和pH=12的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH)
13. 室温时,M(OH)2(s)M2+(aq)+2OH-(aq) Ksp=a ,c(M2+)=b mol·L-1时,溶液的pH等于( )
A.14-lg B.14-lg C.14+lg D.14+lg
14.把晶体N2O4放入一固定容积的密闭容器中气化并建立N2O4(g)2NO2(g)平衡后,保持温度不变,再通入与起始时等量的N2O4气体,反应再次达平衡,则新平衡N2O4的转化率与原平衡比( )
A.变小 B.变大 C.不变 D.无法确定
15.N2O5是一种新型硝化剂,一定温度下发生反应2N2O5(g)4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为:
t/s
0
500
1 000
1 500
c(N2O5)/(mol·L-1)
5.00
3.52
2.50
2.50
下列说法不正确的是( )
A.500 s内,N2O5的分解速率为2.96×10-3 mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,1 000 s时N2O5的转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol·L-1,则有T1
T2,则有K1>K2
16.在一定条件下,固定容积的密闭容器中反应2NO2(g) O2(g)+2NO(g)Δ
H>0,达到平衡。当改变其中一个条件X时,Y随X的变化符合图中曲线的是( )
A.当X表示压强时,Y表示NO2的转化率
B.当X表示温度时,Y表示O2的物质的量
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
17.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
起始浓度/mol·L-1
反应后溶
液的pH
c(HA)
c(KOH)
①
0.1
0.1
9
②
x
0.2
7
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
18.某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB-H++B2-在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是( )
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
19.为研究沉淀的生成及其转化,玉溪一中某化学兴趣小组进行如下实验。关于该实验的分析不正确的是( )
A.①浊液中存在平衡:AgSCN(s)Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
20.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lg c(Ba2+),p(SO)=-lg c(SO)。下列说法正确的是( )
A.该温度下,Ksp(BaSO4)=1.0×10-24
B.a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C.d点表示的是该温度下BaSO4的不饱和溶液
D.加入BaCl2可以使溶液由 c点变到a点
21.柠檬酸(用H3R表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化曲线如图所示。下列说法中正确的是( )
A.H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B.pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
C.Na2HR溶液中HR2-的水解程度大于电离程度
D.pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
二、非选择题(本题共4个大题,共58分)
22.(14分)滴定法是一种重要的定量分析方法,应用范围很广。
(1)下图是用0.100 0 mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
请回答下列问题:
①仪器A的名称是____________。
②盐酸的体积读数:滴定后读数为________mL。
(2)玉溪市场上销售的“白象牌”食用精制盐包装袋上有如下部分说明:
产品等级
一级
配料
食盐、碘酸钾、抗结剂
碘含量(以I计)
20~50 mg·kg-1
某学生拟测定食用精制盐的碘(KIO3)含量,其步骤:
a.准确称取W g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全(I2+2S2O===2I-+S4O)。
①c中指示剂是 ,判断c中恰好完全反应所依据的现象是________________________________________________________________________。
②写出步骤b的离子方程式 。
③b中反应所产生的I2的物质的量是________ mol。
④根据以上实验和包装袋说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)_______mg·kg-1。
⑤若滴定前滴定管尖嘴处有气泡,滴定后消失,则测定结果________(填“偏高”“偏低”或“不变”)。
23.(16分)请根据要求填空。
(1)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________。
②同体积、同PH的三种酸,中和NaOH的能力由大到小的顺序是________。
③将PH相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是________。
(2) 已知:Ksp(AgBr)=7.7×10-13,Ksp(AgSCN)=1×10-12;
AgBr(s)+SCN-(aq)AgSCN(s)+Br-(aq)的平衡常数 。
(3)已知NH4A溶液为中性,又知将HA溶液加入Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序是 (填序号)。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(4)在室温下,有下列四种溶液:①NH4Cl②CH3COONH4③NH4HSO4④NH3·H2O,若c(NH)相等,则四种溶液的浓度由大到小的排列顺序是 (填序号)。
(5)某二元弱酸H2A,已知:Ka1=1.54×10-2,Ka2=1.02×10-7;NaHA溶液显 性,原因是 。
24.(14分)玉溪一中某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如下。
已知:298 K时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Mn(OH)2]=1.9×10-13 ,回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ为________,固体A为________(填化学式)。
(2)加入过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式_________________。
(3)调节pH至2.9~3.2的目的是分离________(填离子符号)。
(4)向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_____________________。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后生成的沉淀为____________(填化学式)。
(6)红棕色固体C的用途 (答一条即可)。
25.(14分)(1)在微生物作用的条件下,NH经过两步反应被氧化成NO。两步反应的能量变化示意图如下:
1 mol NH(aq)全部氧化成NO(aq)的热化学方程式是______________________________。
(2)工业上常用CO和H2合成甲醇,反应方程式为:CO(g) +2H2(g)CH3OH (g) ΔH,在T1时,体积为2 L的恒容容器中充入物质的量之和为3 mol的H2和CO,达到平衡时CH3OH的体积分数(V %)与的关系如图1所示。
①当起始=2,经过5 min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5 min内平均反应速率v(H2)=________。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH(g),达新平衡时H2的转化率将________(填“增大”“减小”或“不变”)。
②当起始=3.5时,达到平衡状态后,CH3OH的体积分数可能是图像中的________点(填“D”“E”或“F”)。
③由图2可知该反应的ΔH________0(填“>”“<”或“=”),理由是
;当压强为p2时,在y点:v正________v逆(填“>”“<”或“=”)。
答案
1B 2A 3A 4C 5B 6B 7A 8C 9C 10D 11B 12C 13C 14A 15C 16A 17B 18D 19D 20D 21B
22.(14分)除标注外,其它均2分。
(1) ①酸式滴定管(1分)②22.80
(2) ①淀粉(1分)溶液由蓝色变为无色,且半分钟不褪色
②IO+5I-+6H+===3I2+3H2O
(3)1.0×10-5 (4)1270/3W (5)偏高
23.(16分)除标注外,其它均2分。
(1)①b>a>c ②c>a=b③c>a=b
(2)0.77 (3) >(1分) c>a>b>d (4)④>②>①>③
(5)酸性(1分) HA-的电离程度大于HA-的水解程度
24.(14分)每空2分。
(1)过滤 Si (2)2Fe3++Cu===2Fe2++Cu2+ (3)Fe3+
(4)MnO+5Fe2+ +8H+===Mn2++5Fe3++4H2O (5)Mn(OH)2
(6)涂料等(其它答案合理即可)
25.(14分)每空2分。
(1)NH(aq)+2O2(g)===NO(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1
(2)①0.09 mol·L-1·min-1 增大 ②F
③> 温度升高,CO转化率增大,平衡正移 >