四川省内江市2019-2020学年高二上学期期末检测 化学
内江市2019-2020学年度第-学期高二期末检测题
化 学
本试卷共6页。全卷满分100分,考试时间为90分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考号、班级用签字笔填写在答题卡相应位置。
2.选择题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案。不能答在试题卷上。
3.非选择题用签字笔将答案直接答在答题卡相应位置上。
4.考试结束后,监考人员将答题卡收回。
可能用到的相对原子质量:H1 C12 N14 O16
一、选择题(本题共21小题,每小题2分,共42分)
1.化学与生活密切相关。下列说法错误的是
A.铁水打花是一种古老的烟花,操作是“将生铁装进坩泥锅,并化成沸腾的铁汁”,其中坩泥锅的主要成分是硅酸盐
B.在人体内水解酶的作用下,纤维素可以发生反应生成葡萄糖
C.《梦溪笔谈》中“取精铁锻之百余火……则纯钢也,虽百炼。不耗矣。”百炼钢熔点比纯铁低
D.华为最新一代旗舰芯片麒麟9905G中半导体材料为硅
2.下列表示物质的化学用语正确的是
A.CO2的结构式:O=C=O B.HF的电子式:H+[:F:]-
C.Cl-离子的结构示意图: D.8个中子的碳原子的核素符号:12C
3.下列说法不正确的是
A.原子中的第四能层有4s、4p、4d、4f四个能级
B.现代化学中,常利用光谱分析法来鉴定元素
C.电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述
D.元素周期表共分为s、p、d、ds四个区
4.下列说法正确的是
A.活化分子间的碰撞一定能发生化学反应
B.升高温度时,化学反应速率加快,主要原因是反应物分子的能量增加,活化分子百分数增大,
单位时间内有效碰撞次数增多
C.自发进行的反应一定迅速
D.凡是熵增加的过程都是自发过程
5.下列关于2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l) △H=-5800 kJ· mol-1叙述中,正确的是
A.该反应的反应热为△H=-5800 kJ· mol-1,是吸热反应
B.该反应的△H与各物质的状态有关,与化学计量数无关
C.该式的含义为25℃、101kPa下,2 mol C4H10气体完全燃烧生成CO2气体和液态水时放出热量5800kJ
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800 kJ· mol-1
6.下列关于实验现象或原理的叙述中,不正确的是
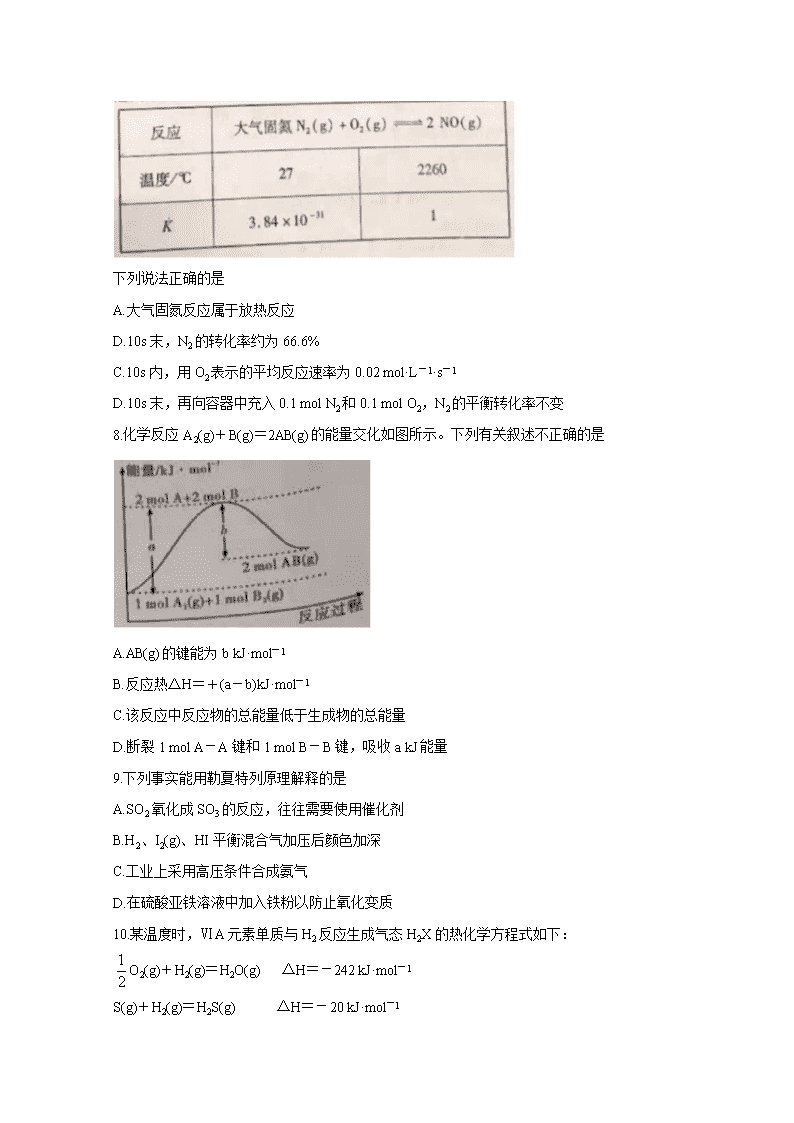
7.固氮作用有3种途径:生物固氮、人工固氮和大气固氮。下表列举了不同温度下大气固氮的部分平衡常数K值。2260℃时,向0.5L的恒容密闭容器中充入0.15 mol N2和0.15 mol O2,10s时反应达到平衡。
下列说法正确的是
A.大气固氮反应属于放热反应
D.10s末,N2的转化率约为66.6%
C.10s内,用O2表示的平均反应速率为0.02 mol·L-1·s-1
D.10s末,再向容器中充入0.1 mol N2和0.1 mol O2,N2的平衡转化率不变
8.化学反应A2(g)+B(g)=2AB(g)的能量交化如图所示。下列有关叙述不正确的是
A.AB(g)的键能为b kJ·mol-1
B.反应热△H=+(a-b)kJ·mol-1
C.该反应中反应物的总能量低于生成物的总能量
D.断裂1 mol A-A键和1 mol B-B键,吸收a kJ能量
9.下列事实能用勒夏特列原理解释的是
A.SO2氧化成SO3的反应,往往需要使用催化剂
B.H2、I2(g)、HI平衡混合气加压后颜色加深
C.工业上采用高压条件合成氨气
D.在硫酸亚铁溶液中加入铁粉以防止氧化变质
10.某温度时,ⅥA元素单质与H2反应生成气态H2X的热化学方程式如下:
O2(g)+H2(g)=H2O(g) △H=-242 kJ·mol-1
S(g)+H2(g)=H2S(g) △H=-20 kJ·mol-1
Se(g)+H2(g)H2Se(g) △H=+81 kJ·mol-1
下列说法正确的是
A.稳定性:H2O>H2S>H2Se
B.降温有利于Se与H2反应生成H2Se
C.O2(g)+2H2S(g)=2H2O(g)+2S(g) △H=+444 kJ·mol-1
D.随着核电荷数的增加,ⅥA族元素单质与H2的化合反应越容易发生
11.一定温度下,一定体积的容器中发生反应:A(s)+3B(g)2C(g)+2D(g),下列描述中能说明该反应达到平衡的是
①A的质量不发生变化 ②单位时间内生成a mol A,同时消耗2a mol C
③容器中的压强不再变化 ④混合气体的密度不再变化
⑤n(A):n(B):n(C):n(D)=1:3:2:2 ⑥B的浓度不变
A.①③⑤⑥ B.①③④⑥ C.②④⑤ D.②③④
12.某温度下,体积一定的密闭容器中进行如下反应:
X(g)+Y(g)Z(g)+W(s) △H>0,下列叙述不正确的是
A.在容器中加入氩气,反应速率不变
B.加入少量W,逆反应速率不变
C.升高温度,正反应速率增大,逆反应速率减小
D.将容器的体积压缩,可增大单位体积内活化分子数,有效碰撞次数增大
13.下列比较中,错误的是
A.原子半径:K>Ga>Se>S B.第-电离能:Si>Al>Mg>Na
C.电负性:O>N>P>As D.非金属性:P>Si>Ge>Ga
14.下列比较中,错误的是
A.范德华力:He>HBr>HCl
B.键角:CO2>CH2O(甲醛)>NH3
C.键能:HF>HCl>HBr 键长:C-H>N-H
D.晶格能:MgO>CaO>BaO 熔点:金刚石>晶体硅
15.已知NA是柯伙加德,常数的值,下列说法正确的是
A.18 g 18O含有的中子数为8NA
B.0.1 mol H2C2O4被氧化为CO2转移的电子数为0.1NA
C.标准状况下,a L氧气和氮气的脱合物中含有的原子总数约为NA
D.常温下、含1 mol H2SO4的浓硫酸与足量铜反应,转移的电子数为NA
16.在下列各溶液中,一定能大量共存的离子组是
A.强酸性溶液中:Fe3+、Fe2+、Ba2+、SCN-、NO3-
B.能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3-
C.饱和氯水中:Cl-、NO3-、Na+、SO32-
D.磷酸溶液中:K+、NH+、Cl-、SO42-
17.X、Y、Z、W为四种短周期主族元素,X与Z同族,Y与Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.Y的最高价氧化物对应的水化物是二元强酸
B.原子半径:X
p2,则此反应的△S>0
C.在图象反应II中,说明该正反应为吸热反应
D.在图象反应III中,若T1>T2,则该反应能自发进行
20.在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)cQ(g)。气体M、N、Q的物质的量随时间的变化如右图所示,则下列叙述正确的是
A.体系平衡时与反应起始时的压强之比为3:2
B.平衡时,M的转化率为50%,若条件改为恒温恒压,则达平衡时M的转化率小于50%
C.若开始时向容器中充入2 mol M和1 mol N,达到平衡时,M的体积分数小于50%
D.在5 min时,再向体系中充入少量He,重新达到平衡前v正>v逆
21.将等物质的量的A、B混合于2L的密闭容器中,发生下列反应2A(g)+B(g)xC(g)+2D(g),经4 min后达平衡,测得D的浓度为1.0 mol·L-1,c(A):c(B)=2:3,以C表示的平均速率v(C)=0.125 mol·L-1·min-1,下列说法不正确的是
A.反应速率v(A)=0.25 mol·L-1·min-1 B.该反应方程式中,x=1
C.4min时,B的物质的最为2 mol D.该反应的平衡常数K=
二、填空题(包括四个大题,共58分)
22.(16分)
I.(1)用甲同学用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液测定计算中和反应的反应热。回答下列向题:
从实验装置上看,图中缺少的一种玻璃用品是 。如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”或“无影响”)。已知稀盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73kJ的热量,则表示该反应中和热的热化学方程式为 。
(2)乙同学用另一装置将V1 mL 1.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。回答下列问题:
做该实验时,环境温度 (填“高于”、“低于”或“等于”)22℃。根据图计算该NaOH溶液的浓度约是 mol·L-1。
II.某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
【初步探究】
(1)为探究量度对反应速率的影响,实验②中试剂A应为 。
(2)写出实验③中I-反应的离子方程式 。
(3)对比实验②③④,可以得出的结论是 。
【继续探究】溶液pH对反应速率的影响
查阅资料:
i.pH<11.7时,I-能被O2氧化为I�2。
ii.pH>9.28时,I�2发生歧化反应:3I�2+6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快
(4)小组同学用4支试管在装有O2储气瓶中进行实验,装置如图所示。
pH为10、11时,试管⑦和⑧中颜色无明显变化的原因是 (填序号)。
A.既发生氧化反应又发生歧化反应,歧化反应速率大于氧化反应速率和淀粉变色速率
B.既发生氧化反应又发生歧化反应,歧化反应速率小于氧化反应速率和淀粉变色速率
C.只发生了氧化反应,但没有发生歧化反应
D.只发生了歧化反应,但没有发生氧化反应
23.(14分)
十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
汽车的排气管上安装“催化转化器”,发生反应①:2NO(g)+2CO(g)2CO2(g)+N2(g) △H=-746.5 kJ·mol-1。
(1)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min)NO的物质的量随时间变化如图。
①图中a,b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是 。(填“a”或“b”)
②T℃时,该反应的化学平衡常数K= ;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将 移动。(填“向左”、“向右”或“不”)
③15min时,若改变外界反应条件,导致n(NO)发生图中所示变化,则改变的条件可能是
(任答一条即可)。
④又已知:反应②N2(g)+O2(g)2NO(g) △H2=+180.5 kJ·mol-1,则CO的燃烧热△H= 。
(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应①,右图为平衡时NO的体积分数与温度、压强的关系。
①温度:T1 T2(填“<”或“>”)。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的 点。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝原理,其脱硝率(脱硝率即NO的转化率)与温度、负载率(分子筛中催化剂的质量分数)的关系如右图所示。
为达到最佳脱硝效果,应采取的条件是 。
24.(16分)
(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为 。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是 。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,,原因是 。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是 。
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
①B2A2的电子式是 ,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是 (填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为 。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式 。
(3)金属镓有“电子工业脊梁“的美誉,镓及其化合物应用广泛。砷化镓是半导体材料属立方晶系,其晶胞结构如图所示。
①晶胞中,与Ga原子等距离且最近的As原子形成的空间构型为 。
②原子坐标参数是晶胞的基本要素之-,表示晶胞内部各原子的相对位置,图中a(0,0,0)、b(1,,),则c原子的坐标参数为 。
25.(12分)
继密胺树脂/石墨烯量子点复合微球新型白光发光材料后,2019年8月13日中国科学院福建物质结构研究所合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2并获得了该化合物的LED器件。
(1)基态O原子能量最高的电子,其电子云在空间有 个延展方向;硼
原子的基态电子排布图为 。
(2)NO3-与SO3互为等电子体,构型为 ;
苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为 、 。
(3)Fe3+可用SCN-检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是 ,试分析其原因 。
(4)微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也应用广泛。
①三价B易形成配离子,如[BH4]-等。写出[BH4]-的一种阳离子等电子体 。
②右图1表示多硼酸根的一种无限长的链式结构,其化学式可表示为 (以n表示硼原子的个数)。
③硼酸晶体是片层结构,右图2表示的是其中一层的结构。每一层内存在的作用力有 。