2018-2019学年山西省祁县中学高二上学期期末模拟一考试化学试题 word版
山西省祁县中学校2018~2019学年第二学期期末检测(一)
高二化学试题
命题人: 考试用时:90分钟 试卷满分:100分
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Fe 56 Cu 64 Br 80
第Ⅰ卷 选择题
一、选择题(共17小题,每小题只有一个选项符合题意,每小题3分,共51分)
1. 化学与生活密切相关,下列应用中利用了物质氧化性的是
A.漂白粉漂白织物 B.纯碱去油污 C.饱和碳酸钠和稀硫酸除锅炉水垢 D.明矾净化水
2.下列说法正确的是 ( )
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式为 NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.4 kJ/mol
B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C.已知2C(s)+2O2(g)===2CO2(g) ΔH1,2C(s)+O2(g)===2CO(g) ΔH2;则ΔH1<ΔH2
D.乙炔的燃烧热为1 299.6 kJ·mol-1,则2C2H2(g)+5O2(g)===4CO2(g)+2H2O(g)反应的ΔH=-2 599.2 kJ·mol-1
3.下列图示不能说明某反应(或某可逆反应的正反应)一定是放热反应的是( )
A. A B. B C. C D. D
O=O
H—H
H—O(g)
1mol化学键断裂时需吸收的能量/kJ
496
436
x
4.已知2g氢气完全燃烧生成液态水时放出热量286kJ,18g水蒸气变成液态水放出44kJ的热量。则x为
A.920 B.463 C. 557 D.188
5.已知反应:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,可以用溶液变浑浊时间的长短来研究影响化学反应速率的因素,下列各组实验中化学反应速率最大的是( )
组号
反应温
度(℃)
参加反应的物质
Na2S2O3
H2SO4
H2O的体积(ml)
体积
(mL)
浓度
(mol·L-1)
体积
(mL)
浓度
(mol·L-1)
A
10
5.0
0.10
10.0
0.10
5.0
B
30
5.0
0.10
5.0
0.10
10.0
C
30
5.0
0.20
5.0
0.10
10.0
D
10
5.0
0.10
5.0
0.10
10.0
A. A B.B C.C D.D
6.一定温度下,在2L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是( )
时间(min)
0
t1
t2
t3
NH3物质的量(mol)
0
0.2
0.3
0.3
A. 0〜t1min,v(NH3)=0.1/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.425mol·L-1
C. 升高温度,平衡逆移,正反应速率减小,逆反应速率增大
D. N2(g)+3H2(g) 2NH3(g)的活化能小于2NH3(g) N2(g)+3H2(g)的活化能
7. 向甲、乙两个容积均为1L的恒容容器中,分别充入2moLA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)xC(g)ΔH<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是
A. A的转化率相同 B.X可能等于2也可能等于3
C向平衡后的乙容器中充入氦气可使c(A)增大
D
. 向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol·L-1<c(A)<1.56mol·L-1
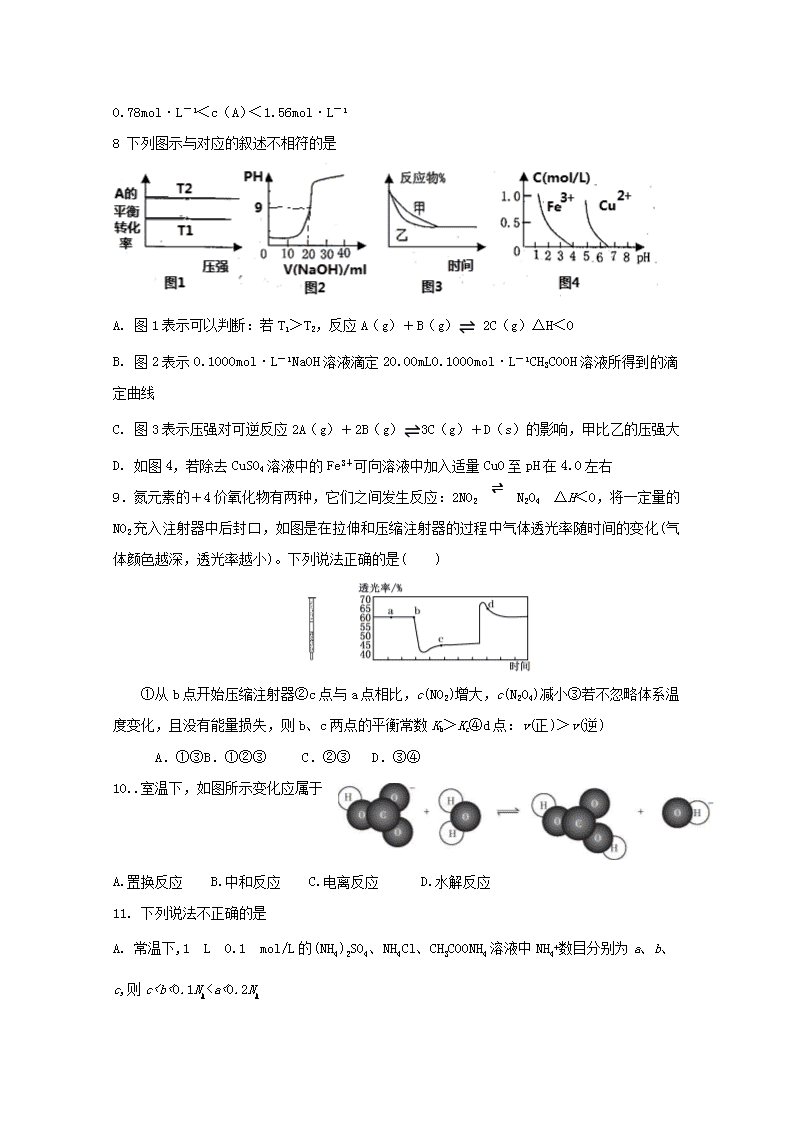
8 下列图示与对应的叙述不相符的是
A. 图1表示可以判断:若T1>T2,反应A(g)+B(g) 2C(g)ΔH<0
B. 图2表示0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液所得到的滴定曲线
C. 图3表示压强对可逆反应2A(g)+2B(g)3C(g)+D(s)的影响,甲比乙的压强大
D. 如图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4.0左右
9.氮元素的+4价氧化物有两种,它们之间发生反应:2NO2⇌N2O4 ΔH<0,将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
①从b点开始压缩注射器②c点与a点相比,c(NO2)增大,c(N2O4)减小③若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc④d点:v(正)>v(逆)
A.①③B.①②③ C.②③ D.③④
10..室温下,如图所示变化应属于
A.置换反应 B.中和反应 C.电离反应 D.水解反应
11. 下列说法不正确的是
A. 常温下,1 L 0.1 mol/L的(NH4)2SO4、NH4Cl、CH3COONH4溶液中NH4+数目分别为a、b、c,则c
0,下列叙述一定正确的是
A.向水中加入KHSO4溶液,平衡逆向移动,KW减小
B.将水加热,KW增大,pH减小
C.向水中加入少量固体CH3COONa平衡逆向移动,c(H+)降低
D.加水稀释NaOH溶液 、FeCl3溶液,溶液中每种离子的浓度都不会增加
13.下列实验操作、现象和结论均正确的是
实验操作
实验现象
实验结论
A
向盛有1 mL浓硫酸的试管中加人5 mL 0 .1 mol/L的K2 Cr2 O7溶液
溶液橙色变深
增大生成物浓度,平衡Cr2O+H2O
2CrO+2H+逆向移动
B
在2mL0.01mol/L的Na2S溶液中先滴入几滴0.01mol/LZnSO4溶液,再滴入几滴CuSO4溶液
先产生白色沉淀后转化为黑色沉淀
Ksp(CuS)CH3COOH
A. A B. B C. C D. D
14. 下列说法正确的是
①常温下,将pH=a的强酸溶液体积稀释到原来的10n倍,则pH=a+n,而pH=b的氨水溶液,稀释10n倍后,pH=b-n
②含有AgCl和AgI固体的悬浊液;c(Ag+)>c(Cl-)=c(I-)
③将0.1 mol·L-1的NaHS和0.1 mol·L-1 Na2S溶液等体积混合,所得溶液中有 c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S)
④在0.1 mol·L-1氨水中滴加0.1 mol·L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-a mol·L-1
⑤0.1 mol/LNH4Cl溶液与0.1 mol/L氨水等体积混(pH>7)则c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
.含等物质的量的NaHC2O4和Na2C2O4的溶液: 2c(Na+)=3[c(HC2O4—)+c(C2O42—)+c(H2C2O4)]
A. ①④ B.① ②③ C. ③④ D. ①②
15. 已知NaHA溶液显酸性,溶液中存在以下平衡: ①HA- +H2OH2A+OH- ②HA-H++A2-
向0.1 mol·L-1的NaHA溶液中分别加入以下物质,下列有关说法正确的是 ( )
A. 加入等物质的量的Na2A固体,则2c(OH-)=2c(H+)+c(HA- )+3c(H2A)-c(A2-)
B. 加入少量NaoH溶液,、的值均增大
C. 加入氨水至中性,则2c(Na+)=c(A2-)>c(H+)=c(OH-)
D. 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HA-)增大
16.某同学想了解食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液(浓度有0.100 0 mol/L和0.0100 mol/L两种)对其进行滴定。下列说法正确的是
A. 用0.100 0 mol/L标准NaOH溶液滴定时误差更小
B. 该实验应选用甲基橙作指示剂
C. 滴定时,眼睛一直注视着刻度线,以防止液面下降到滴定管最大刻度以下
D. 准确量取一定体积的白醋放人洗净的锥形瓶中后,可以再加少量蒸馏水后开始滴定
17.某小组同学想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。下列说法正确的是
A. E处加入的是含少量KOH的蒸馏水,生成的KOH溶液由A口流出
B. H处是阴离子交换膜
C. 当阴、阳两极上一共得到33.6L(标准状况下)气体时,有2mol离子通过H膜
D. 通过G、H交换膜的离子数目相等
第II卷 非选择题
二、非选择题(共49分)
18.碳及其化合物在工业上应用广泛,请回答下列问题。
I.CH4及碳单质均可以应用于工业尾气中SO2的消除。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3 kJ /mol和-297.2 kJ /mol,则CH4和SO2反应的热化学方程式为 _________________________________________________。
(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)S2(g)+2CO2(g),恒容容器中, 1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
①该反应的△H _________ 0 (填“>”或“<”)
②计算700℃该反应的平衡常数为________
II.工业上可用CO2和H2制备甲醇,其反应方程式为CO2 ( g) + 3H2 (g)CH3OH(g)+ H2O(g)。
(1)某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
①用H2表示的前2h的平均反应速率v(H2)=_________
②该温度下,CO2的平衡转化率为____________
(2)下列各项能说明该反应已达到平衡状态的是________(填字母).
a.v(CO2)正=3v(H2)逆
b.混合气体的密度保持不变
c.容器内压强保持不变
d.容器内CO2、H2、CH3OH、H2O的浓度之比为1︰3︰1︰1
e.CO2和H2的转化率相等 f.体系中气体的平均摩尔质量不再改变
(3)在300℃、8 MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生上述反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
III.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。 在不同温度下催化剂的催化效率与乙酸的生成速率如上图所示。250~300 ℃时,温度升高而乙酸的 生成速率降低的原因是_____________________________________________。
19.研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃在0.10 mol·L-1 H2
S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
①pH=11时,溶液中的c(H2S)+c(HS-)= mol·L-1(保留3位有效数字)。
②某溶液含0.010 mol·L-1 Fe2+、未知浓度的Mn2+和0.10 mol·L-1 H2S,当溶液pH= 时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中= 。
[知:Ksp(FeS)=1.4×10-19,Ksp(MnS)=2.8×10-13]
(2) 硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。其中一种是将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。(假设无其他副反应发生)
①请写出阳极的电极反应式 ,
②钠离子的移动方向是 (填写选项)
A. 从阳极室向阴极室移动B.从阴极室向阳极室移动
③总反应的离子方程式:
(3)利用催化剂氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g)+O2(g)= SO3(g) △H=-99kJ/mol。某温度下该反应的平衡常数K=3.33。反应过程的能量变化如图所示。
①图中△H= kJ/mol;该反应通常用V2O5会使图中A点降低,原因是 。
②该温度下,向100L的恒容密闭容器中,充入3.0molSO2(g)、16.0molO2(g)和3.0molSO3(g),则反应开始时 (填“>”“<”或“=”)
(4)25 ℃两种酸的电离平衡常数如下表。
Ka1
Ka2
H2SO3
1.3×10-2
6.3×10-8
H2CO3
4.2×10-7
5.6×10-11
实验室常用饱和NaHCO3溶液除去CO2中少量的SO2,请写出SO2和NaHCO3溶液反应的主要离子方程式: 。
20.溶液中的离子平衡问题,与日常生产生活密切相关。请回答下列问题
(1)将1.00 mol·L-1 NaOH溶液滴人20.00 mL 1.00 mol·L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积的变化曲线如图所示。
①室温时,HA的电离度约为
②图中B点时,溶液的KW 1×10-14 (填>,=,<)
③图中C点时,溶液中各离子浓度从大到小的顺序是
(2)某温度T℃下,将打磨后的镁条放人盛有50 mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中的pH和浊度随时间的变化(如图所示,实线表示溶液pH随时间的变化)。
①该温度下水的离子积常数为
②T℃ 常温(填高于、等于、低于)
③该温度下Mg(OH)2的KSP的数量级约为
④ 50 s时向溶液中滴人酚酞试液,溶液 变红(填会或不会)
21. 电化学在工业上应用十分广泛,请回答下列问题。
I..以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备 Fe(OH)2,装置如图所示,其中电解池两极材料分别为铁和石墨,通电一段时间后,右侧玻璃管中产生大量的白色沉淀。
(1)石墨电极Ⅱ处的电极反应式为
(2) X是 电极(填石墨、铁)
(3) 电解池中有1mol Fe溶解,石墨Ⅰ耗H2 的体积为 L(标准状况下)
II.人工肾脏可采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2),原理如图所示。
(1)电源的负极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为__________、
______ ___。
(2) 电解结束后,阴极室溶液的pH与电解前相比将
__________;
(填变或者不变)
(4) 若两极共收集到气体13.44 L(标准状况),
则除去的尿素为________ g(忽略气体的溶解)。
山西省祁县中学校2018~2019学年第二学期期末检测(一)
高二化学答案
1.A2.C3.B4.B5.C6.C7.D8.C9.A10.D11.C12.B13.C14.C15.A16.D17.C
18. (除特殊标注外,每空1分,共10分)
I.(1). CH4(g) + 2SO2(g)= CO2(g) +2S(s) +2H2O(l) △H=-295.9 kJ/mol (2分) (2) < 36.45
II. (1).① 0.225 mol·L-1·h-1(或13.5 mol·L-1·minL-1) ②40% (2) cf (2分) (3)
III.从图像上看出100~250 ℃,温度升高,催化效率提高,而250~300 ℃,升高温度,催化效率下降,因而乙酸的生成速率下降。
19. (每空1分,共10分)(1) ①9.87×10-2 ② 2 , 2×106(2)①S2—-2e-=S ② A ③S2—+H2O=H2↑+2OH-+S↓
(3)① -198;因为催化剂改变了反应历程,使活化能E降低 ② >(4)SO2+HCHS+CO2
20.(每空2分,共14分)(1)①0.1% ② > ③ c(Na+)>c(A-)>c(OH-)>c(H+)
(2)①10-13 ②高于 ③10-10 ④ 不会
21.(除特殊标注外,每空2分,共15分)I.(1)O2+4e-+2CO2=2CO32- (2)石墨 (3)22.4
II.(1)B (2)2Cl--2e-===Cl2↑ CO(NH2)2+3Cl2+H2O===N2+CO2+6HCl(1分) (3)不变(4)7.2
【解析】18.II.(1)①恒温恒容时,气体的压强之比等于其物质的量之比,2h时=0.85,设消耗CO2的物质的量为xmol,
CO2 ( g) + 3H2 (g)CH3OH(g)+ H2O(g) V
1 3 1 1 2
xmol 2x mol
则有=0.85,解得x=0.3,故前2h的平均反应速率v(H2)==0.225 mol·L-1·h-1。
②该温度下,反应进行5h时达到平衡状态,此时=0.80,设消耗CO2的物质的量为ymol,则有=0.85,解得y=0.4,故CO2的平衡转化率为×100%=40%,故答案为:0.225 mol·L-1·h-1(或13.5 mol·L-1·minL-1 ;40%;
(3)设开始时投入CO2和H2的物质的量分别为1mol、3mol,CO2的平衡转化率为50%,则有:
CO2 ( g) + 3H2 (g)CH3OH(g)+ H2O(g)。
起始量/mol 1 3 0 0
转化量/mol 0.5 1.5 0.5 0.5
平衡量/mol 0.5 1.5 0.5 0.5
平衡时p(CO2)=8 MPa×= MPa, p(H2)=8 MPa×=4 MPa,p(CH3OH)=8 MPa×= MPa,p(H2O)=8 MPa×= MPa,故该反应条件下的平衡常数为Kp===。