- 2021-08-06 发布 |
- 37.5 KB |
- 62页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习晶体结构与性质课件(62张)(全国通用)
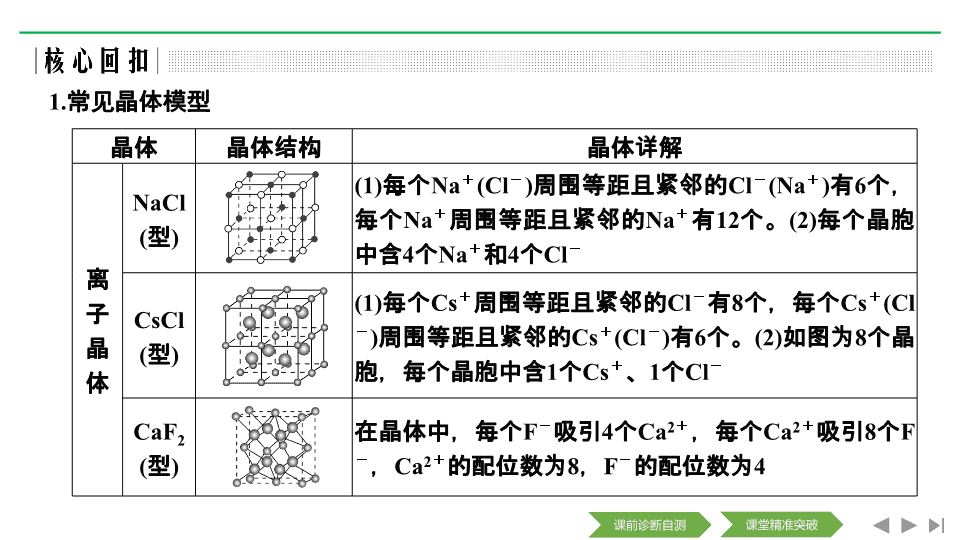
第 3 讲 晶体结构与性质 【考纲点击】 (1) 了解晶体的类型,了解不同类型晶体中构成微粒及微粒间作用力的区别; (2) 了解晶格能的概念,了解晶格能对离子晶体性质的影响; (3) 了解分子晶体结构与性质的关系; (4) 了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系; (5) 理解金属键的含义,能用金属键理论解释金属的一些物理性质,了解金属晶体常见的堆积方式; (6) 了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。 1. 常见晶体模型 晶体 晶体结构 晶体详解 离子晶体 NaCl ( 型 ) (1) 每个 Na + ( Cl - ) 周围等距且紧邻的 Cl - (Na + ) 有 6 个,每个 Na + 周围等距且紧邻的 Na + 有 12 个。 (2) 每个晶胞中含 4 个 Na + 和 4 个 Cl - CsCl ( 型 ) (1) 每个 Cs + 周围等距且紧邻的 Cl - 有 8 个,每个 Cs + ( Cl - ) 周围等距且紧邻的 Cs + ( Cl - ) 有 6 个。 (2) 如图为 8 个晶胞,每个晶胞中含 1 个 Cs + 、 1 个 Cl - CaF 2 ( 型 ) 在晶体中,每个 F - 吸引 4 个 Ca 2 + ,每个 Ca 2 + 吸引 8 个 F - , Ca 2 + 的配位数为 8 , F - 的配位数为 4 金属晶体 简单立 方堆积 典型代表 Po ,空间利用率 52% ,配位数为 6 体心立 方堆积 典型代表 Na 、 K 、 Fe ,空间利用率 68% ,配位数为 8 六方最 密堆积 典型代表 Mg 、 Zn 、 Ti ,空间利用率 74% ,配位数为 12 面心立 方最密 堆积 典型代表 Cu 、 Ag 、 Au ,空间利用率 74% ,配位数为 12 分子 晶体 干冰 (1)8 个 CO 2 分子构成立方体且在 6 个面心又各占据 1 个 CO 2 分子。 (2) 每个 CO 2 分子周围等距紧邻的 CO 2 分子有 12 个 混合型晶体 石墨 晶体 层与层之间的作用力是分子间作用力,平均每个正六边形拥有的碳原子个数是 2 , C 采取的杂化方式是 sp 2 杂化 2. 物质熔沸点高低比较规律 (1) 不同类型晶体熔沸点高低的比较 一般情况下,不同类型晶体的熔沸点高低规律:原子晶体 > 离子晶体 > 分子晶体,如:金刚石 > NaCl >Cl 2 ;金属晶体 > 分子晶体,如: Na>Cl 2 ( 金属晶体熔沸点有的很高,如钨、铂等,有的则很低,如汞等 ) 。 (2) 同种类型晶体熔沸点高低的比较 ① 原子晶体: 如:金刚石 > 石英 > 碳化硅 > 晶体硅。 ② 离子晶体: a. 衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。 b. 一般地说,阴阳离子的电荷数越多,离子半径越小,离子键越强,晶格能越大,熔沸点就越高,如: MgO >MgCl 2 , NaCl > CsCl 。 ③ 金属晶体:金属离子半径越小,离子所带电荷数越多,其形成的金属键越强,金属单质的熔沸点就越高,如 Al>Mg>Na 。 ④ 分子晶体 a. 分子间作用力越大,物质的熔沸点越高;具有分子间氢键的分子晶体熔沸点反常地高。如 H 2 O>H 2 Te>H 2 Se>H 2 S 。 b. 组成和结构相似的分子晶体,相对分子质量越大,熔沸点越高,如 SnH 4 >GeH 4 >SiH 4 >CH 4 。 c. 组成和结构不相似的物质 ( 相对分子质量接近 ) ,分子的极性越大,其熔沸点越高,如 CO>N 2 。 d. 在同分异构体中,一般支链越多,熔沸点越低,如正戊烷 > 异戊烷 > 新戊烷。 3. 晶胞求算 晶胞中微粒数目的计算方法 —— 均摊法 1.(1) [2019· 课标全国 Ⅰ , 35(3)(4)] ① 一些氧化物的熔点如表所示: 解释表中氧化物之间熔点差异的原因 ___________________________ _____________________________________________________ 。 氧化物 Li 2 O MgO P 4 O 6 SO 2 熔点 / ℃ 1 570 2 800 23.8 - 75.5 ② 图 (a) 是 MgCu 2 的拉维斯结构, Mg 以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的 Cu 。图 (b) 是沿立方格子对角面取得的截图。可见, Cu 原子之间最短距离 x = ________pm , Mg 原子之间最短距离 y = ________pm 。设阿伏加德罗常数的值为 N A ,则 MgCu 2 的密度是 ________ g·cm - 3 ( 列出计算表达式 ) 。 (2) [2019· 课标全国 Ⅱ , 35(3)(4)] ① 比较离子半径: F - ________O 2 - ( 填 “ 大于 ”“ 等于 ” 或 “ 小于 ” ) 。 ② 一种四方结构的超导化合物的晶胞如图 1 所示。晶胞中 Sm 和 As 原子的投影位置如图 2 所示。 2. [2018· 课标全国 Ⅰ , 35(4)(5)] (1)Li 2 O 是离子晶体,其晶格能可通过图 (a) 的 Born - Haber 循环计算得到。 可知, Li 原子的第一电离能为 ________ kJ·mol - 1 , O===O 键键能为 ________ kJ·mol - 1 , Li 2 O 晶格能为 ________ kJ·mol - 1 。 (2)Li 2 O 具有反萤石结构,晶胞如图 (b) 所示。已知晶胞参数为 0.466 5 nm ,阿伏加德罗常数的值为 N A ,则 Li 2 O 的密度为 ________ g·cm - 3 ( 列出计算式 ) 。 3. [2018· 课标全国 Ⅱ , 35 节选 ] 硫及其化合物有许多用途,相关物质的物理常数如下表所示: ① 图 (a) 为 S 8 的结构,其熔点和沸点要比二氧化硫的熔点和沸点高 很多,主要原因为 ________________________________________ _____________________________________________________ 。 H 2 S S 8 FeS 2 SO 2 SO 3 H 2 SO 4 熔点 / ℃ - 85.5 115.2 > 600 ( 分解 ) - 75.5 16.8 10.3 沸点 / ℃ - 60.3 444.6 - 10.0 45.0 337.0 4. [2017· 课标全国 Ⅰ , 35(2)(4)(5)] (1)K 和 Cr 属于同一周期,且核外最外层电子构型相同,但金属 K 的熔点、沸点等都比金属 Cr 低,原因是 _____________________________________________________ _____________________________________________________ 。 (2)KIO 3 晶体是一种性能良好的非线性光学材料,具有钙钛 矿型的立体结构,边长为 a = 0.446 nm ,晶胞中 K 、 I 、 O 分 别处于顶角、体心、面心位置,如图所示。 K 与 O 间的最短 距离为 ________ nm ,与 K 紧邻的 O 个数为 ________ 。 (3) 在 KIO 3 晶胞结构的另一种表示中, I 处于各顶角位置,则 K 处于 ________ 位置, O 处于 ________ 位置。 5. [2016· 课标全国 Ⅲ , 37(4)(5)] (1)GaF 3 的熔点高于 1 000 ℃ , GaCl 3 的熔点为 77.9 ℃ ,其原因是 _____________________________________________ 。 (2)GaAs 的熔点为 1 238 ℃ ,密度为 ρ g·cm - 3 ,其晶胞结构如图所示。该晶体的类型为 ________ , Ga 与 As 以 ________ 键键合。 Ga 和 As 的摩尔质量分别为 M Ga g·mol - 1 和 M As g·mol - 1 ,原子半径分别为 r Ga pm 和 r As pm ,阿伏加德罗常数值为 N A ,则 GaAs 晶胞中原子的体积占晶胞体积的百分率为 ___________________________ 。 6. [2017· 江苏化学, 21(A)—5] 某 Fe x N y 的晶胞如图 1 所示, Cu 可以完全替代该晶体中 a 位置 Fe 或者 b 位置 Fe ,形成 Cu 替代型产物 Fe ( x - n ) Cu n N y 。 Fe x N y 转化为两种 Cu 替代型产物的能量变化如图 2 所示,其中更稳定的 Cu 替代型产物的化学式为 ________ 。 答案 Fe 3 CuN 题组一 晶体类型与物理性质 1. 下列排序不正确的是 ( ) A. 晶体熔点:对羟基苯甲醛 > 邻羟基苯甲醛 B. 硬度:金刚石 > 碳化硅 > 晶体硅 C. 熔点: Na>Mg>Al D. 晶格能: NaF > NaCl > NaBr > NaI 解析 A 项,能形成分子间氢键的对羟基苯甲醛的熔、沸点大于能形成分子内氢键的邻羟基苯甲醛的熔、沸点; B 项,对于原子晶体,原子半径越小,键长越短,共价键越牢固,硬度越大,键长: C—C 键查看更多