2017-2018学年湖北省宜昌市第一中学高二下学期期末考试化学试题 解析版
湖北省宜昌市第一中学2017-2018学年高二下学期期末考试化学试题
1. 下列说法中正确的是
A. 吸热、熵增的非自发反应在高温条件下也可能转变为自发进行的反应
B. 熵增反应都是自发的,熵减反应都是非自发的
C. 放热反应都是自发的,吸热反应都是非自发的
D. 放热、熵增的自发反应在一定的条件下也可能转变为非自发反应
【答案】A
【解析】分析:本题考查的是判断反应能否自发进行的方法,掌握判断反应能否自发进行的方法是关键,用复合判据。
详解:根据复合判据分析△G=△H-T△S。当的反应能够自发进行。A.当△H>0,△S>0,高温时△G可能小于0,可能自发进行,故正确;B. 熵增或熵减的反应,需要考虑反应是放热还是吸热,故错误;C.放热反应中△H<0,若△S>0,反应能自发进行,若△S<0反应可能不自发进行,故错误;D.放热、熵增的自发反应的△H<0,△S>0,则△G<0,则反应为自发进行,温度高低都为自发进行,故错误。故选A。
2. 已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g) === 2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq) === H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. H2(g)的燃烧热为 -571.6 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. H2SO4(aq)+Ba(OH)2(aq) === BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g) === CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
【答案】B
【解析】分析:本题考查的是燃烧热和中和热的定义,注意燃烧热和中和热对物质状态和物质的量的要求即可解决问题。
详解:A.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1中是2mol氢气完全燃烧放出的热量,所以氢气的燃烧热为285.8 kJ·mol-1,故错误;B.根据已知分析,4g氢气燃烧放出571.6 kJ的热量,
64克甲醇完全燃烧放出1452 kJ的热量,所以等质量的氢气和甲醇燃烧,氢气燃烧放出的热量多,故正确;C.硫酸和氢氧化钡反应生成硫酸钡沉淀和水,因为生成硫酸钡沉淀,所以此反应的反应热不是中和热,故错误;D.根据盖斯定律分析,将前两个反应标记为①、②,则有①×3-②得热化学方程式3H2(g)+CO2(g) === CH3OH(l)+H2O(l) ΔH=-571.6×3+1452=-262.8kJ·mol-1,故错误。故选B。
点睛:注意燃烧热和中和热的定义,燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,注意稳定的氧化物是指液态水,二氧化硫,二氧化碳等。中和热是指稀的强酸和强碱反应生成可溶性的盐和1mol水是放出的热量,若有弱酸或弱碱参与或有沉淀生成,则其反应热不等于中和热。
3. NH3·H2O(aq)与H2SO4(aq)反应生成1 mol (NH4)2SO4的ΔH=-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于
A. +45.2 kJ·mol-1 B. -45.2 kJ·mol-1
C. +69.4 kJ·mol-1 D. -69.4 kJ·mol-1
【答案】A
【解析】分析:本题考查的是盖斯定律在热化学方程式计算中的应用,明确中和热是指强酸和强碱反应生成1mol水时放出的热量,弱酸或弱碱电离吸热是解题的关键。
详解:NH3·H2O(aq)与H2SO4(aq)反应生成1 mol (NH4)2SO4的ΔH=-24.2 kJ·mol-1,则
2NH3·H2O(aq)+ H2SO4(aq)= (NH4)2SO4(aq)+2H2O(l) ΔH=-24.2 kJ·mol-1,即:2NH3·H2O(aq)+ 2H+ (aq)= 2NH4+(aq)+2H2O(l) ΔH=-24.2 kJ·mol-1,整理可得:①NH3·H2O(aq)+ H+ (aq)= H2O(l) ΔH=-12.1 kJ·mol-1,②H+ (aq)+OH-(aq)= H2O(l) ΔH=-57.3kJ·mol-1,①-②可得NH3·H2O(aq)= NH4+(aq)+OH-(aq) ΔH=+45.2kJ·mol-1,所以氨水在水溶液中电离的ΔH为+45.2 kJ·mol-1。故选A。
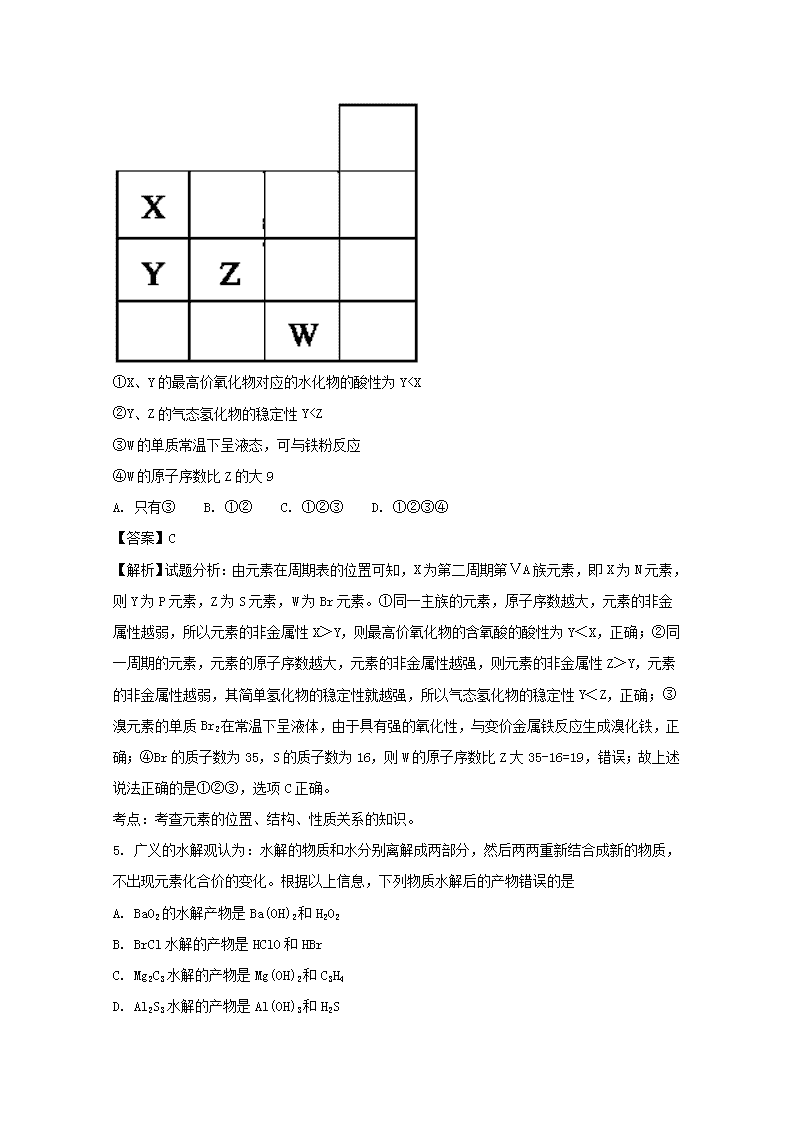
4. 如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是
①X、Y的最高价氧化物对应的水化物的酸性为Y
n且X、Y、Z三种原子的M层电子数均为奇数。下列说法中不正确的是
A. 三种离子中,Ym+的离子半径最小
B. Z的最高价氧化物对应水化物的分子式为HnZO4
C. X、Y、Z一定在同一周期,且原子半径Z>X>Y
D. 三种元素相应的最高价氧化物对应水化物之间两两会发生反应
【答案】C
【解析】因为M层电子数为奇数,所以可能为1、3、5、7,Y形成阳离子,m>n,则m应为3,n为1,则X为钠,Y为铝,Z为氯。A、钠离子和铝离子为2层,氯离子3层,电子层结构相同的离子,核电荷数越大,半径越小,所以铝离子半径最小,A正确;B、氯元素的最高价为+7价,最高价氧化物的水化物的分子式为HClO4,B正确;C、三种元素都在第三周期,原子半径大小为钠>铝>氯,C错误;D、氢氧化铝是两性氢氧化物,和氢氧化钠反应,和高氯酸也反应,D正确,答案选C。
9. 下列叙述不正确的是
A. 氨水中:c(OH-)-c(H+)=c(NH)
B. 饱和H2S溶液中:c(H2S)>c(H+)>c(HS-)>c(S2-)
C. 0.1mol/LCH3COOH溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)
D. Ca(OH)2溶液中:c(H+)+2c(Ca2+)=c(OH-)
【答案】C
【解析】分析:本题考查的是弱电解质的电离和溶液中的守恒规律,关键为三大守恒。
详解:A.氨水中的电荷守恒有c(OH-) =c(H+)+ c(NH),故正确;B.饱和硫化氢溶液中,因为硫化氢存在两步电离,且第一步电离程度大于第二步,所以微粒浓度关系为c(H2S)>c(H+)>c(HS-)>c(S2-),故正确;C.在醋酸溶液中,醋酸电离出等量的氢离子和醋酸根离子,水也能电离出氢离子,所以氢离子浓度大于醋酸根离子浓度,故错误;D.氢氧化钙溶液中的电荷守恒有c(H+)+2c(Ca2+)=c(OH-),故正确。故选C。
点睛:弱电解质存在电离平衡,需要注意多元弱酸的电离是分步进行的,因为电离出的氢离子对后面的电离有影响,所以电离程度依次减弱。
10. 某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2 mol电子时停止电解,析出Na2SO4·10H2O晶体m g,所有数据都在相同温度下测得,下列叙述不正确的是
A. 电解后溶液质量减少(m+18)g
B. 原溶液中Na2SO4的质量分数为
C. 若其他条件不变,将石墨替换为铜电极,则阴极析出1mol H2
D. 若其他条件不变,将石墨替换为铜电极,则析出Na2SO4·10H2O晶体仍为m g
【答案】D
【解析】分析:本题考查的是电解原理,饱和溶液有关计算等知识点,为高频考点。侧重考查学生分析能力和计算能力,明确饱和溶液的特点,电解时阳极上铜失去电子而不是溶液中的阴离子失去电子是易错点。
详解:A.电解后溶液质量减少量=电解水的质量+析出晶体的质量=(18+m)g,故正确;B.析出硫酸钠的质量为=71/161mg,溶液质量=(18+m)g,溶液质量分数=溶质质量/溶液质量= ,故正确;C. 若气体条件不变,将石墨电极替换为铜电极,阴极上仍然是氢离子放电生成氢气,但是阳极上铜失去电子生成铜离子,阴极上析出1mol氢气,故错误;D若其它条件不变,将石墨电极替换为铜电极,阳极上生成铜离子,阴极上生成氢气同时还有氢氧根离子生成,铜离子和氢氧根离子反应生成氢氧化铜沉淀,其电池反应为Cu+2H2OCu(OH)2+H2↑,根据方程式可知,转移2mol电子,消耗2mol水,则析出Na2SO4·10H2O晶体为2mg,故错误。故选D。
11. 已知常温下,HCOOH比NH3·H2O电离常数大。向10mL0.1mol/L HCOOH中滴加同浓度的氨水,有关叙述正确的是
A. 滴加过程中水的电离程度始终增大
B. 当加入10mL NH3·H2O时,c(NH)>c(HCOO-)
C. 当两者恰好中和时,溶液pH=7
D. 滴加过程中n(HCOOH)与n(HCOO-)之和保持不变
【答案】D
【解析】分析:本题考查了弱电解质的电离和盐类的水解的相关知识,掌握平衡移动是关键。
详解:A.甲酸能够抑制水的电离,滴加氨水过程中,水的电离程度增大,氨水过量时,抑制水的电离,所以滴加过程中水的电离程度先增大,恰好中和后再减小,故错误;B.加入当加入10mL NH3·H2O时,恰好生成甲酸铵,甲酸根水解程度不如铵根离子水解程度大,溶液显酸性,c(NH)丙>乙,故错误。故选D。
17. 某兴趣小组设计了如图所示装置(部分夹持装置已略去)进行实验探究。
【实验一】探究影响化学反应速率的因素。
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2。
序号
V(H2SO4)/mL
c(H2SO4)/mol·L-1
t/s
I
40
1
t1
II
40
3
t2
序号
V(H2SO4)/mL
c(H2SO4)/mol·L-1
t/s
I
40
1
t1
II
40
3
t2
检查该装置气密性的方法是_______________________________________________。
比较实验I和Ⅱ可以得出的结论是____________________________________________。
【实验二】探究铁的电化学腐蚀。
①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面_________右侧液面_________(选填“上升”、“下降”)。
②圆底烧瓶中装与①相同量的铁粉但不加入碳粉,其他试剂和操作相同,发现左、右侧液面变化较_______(选填“快”、“慢”,下同),说明原电池反应比一般化学反应_______。
③圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:___________________________________,正极的电极反应是___________________________。
【答案】 (1). 从量气管右侧管口加水至左右两管出现液面高度差时停止加水,若能保持液面高度差不变,则说明装置气密性好 (2). 增大反应物浓度能加快化学反应速率 (3). 下降 (4). 上升 (5). 慢 (6). 快 (7). 左侧液面上升右侧液面下降 (8). O2 + 4e- + 2H2O = 4OH-
【解析】分析:本题考查了化学反应的速率的影响因素,钢铁的电化学腐蚀等,注意知识的归纳和梳理是关键。
详解:【实验一】由实验装置分析得检验气密性的方法是从量气管右侧管口加水至左右两管出现液面高度差时停止加水,若较长时间能保持液面高度差不变,则说明装置气密性好; t1>t2,说明实验Ⅱ反应速率较大,二者浓度不同,说明在气体条件一定时,反应收益率随着反应物浓度的增大而增大;【实验二】①铁和硫酸反应生成硫酸亚铁和氢气,有气体生成,而且放热,所以压强增大,所以左侧液面下降,右侧液面上升;②圆底烧瓶中装与①相同量的铁粉但不加入碳粉,其他试剂和操作相同,因为①中形成的原电池 ,反应快,所以不加碳粉的反应慢;③圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,铁发生吸氧腐蚀,左侧空气量减少,左侧液面上升,右侧液面下降;空气中的氧气在正极得到电子发生反应,电极反应为: O2 + 4e- + 2H2O = 4OH-。
18. (1)已知在常温常压下:
①CH3OH(l)+O2(g)===CO(g)+2H2O(g) ΔH=-354.8 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1
则表示CH3OH(l)燃烧热的热化学方程式为______________________________________。
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,充电一次可使手机连续使用一个月。
①该电池负极的电极反应式为________________________________________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子
Cu2+
H+
Cl-
SO42-
c/(mol·L-1)
0.5
2
2
0.5
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)。阳极上最先发生的反应为___________________________;从各阶段的电解总反应方程式来看,最初是电解__________(填写化学式,下同)溶液,然后是电解________溶液,最后是电解H2O。
【答案】 (1). CH3OH(l)+O2(g)===CO2 (g)+2H2O(l) ΔH=-725.8 kJ·mol-1 (2). CH3OH-6e- +8OH-=CO32-+6H2O (3). 2Cl--2e-=Cl2↑ (4). CuCl2 (5). HCl
【解析】分析:本题考查的是盖斯定律和原电池与电解池的电极反应的书写和计算等,关键为掌握电解池中的离子放电顺序。
详解:(1)根据盖斯定律分析,将方程式进行按照①+②÷2+③×2运算得热化学方程式为:CH3OH(l)+O2(g)===CO2 (g)+2H2O(l) ΔH=-354.8-566/2-44×2=-725.8 kJ·mol-1 ;(2) ①原电池中负极发生氧化反应,甲醇在负极放电,碱性条件下生成碳酸根离子和水,电极反应为:CH3OH-6e- +8OH-=CO32-+6H2O;②电解时开始为阳极氯离子放电,电极反应为:2Cl--2e-=Cl2↑,阴极为铜离子放电,即开始电解氯化铜。电解一段时间后,当两极收集到相同体积的气体,说明阴极铜离子完全反应后,氢离子放电, 根据表格中氯离子和铜的数目分析,氢离子放电时阳极为氯离子放电,则电解的为HCl。
点睛:在考查电解池的工作原理的习题中,掌握离子的放电顺序,且要根据电路中转移的电子数目相等进行计算,如开始电解氯化铜,生成等物质的量的铜和氯气,然后是电解氯化氢,生成等物质的量的氢气和氯气,此时两极收集到的气体不可能体积相等,所以还要继续电解水,生成氢气和氧气。
19. 在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生如下反应:N2(g)+3H2(g)2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____(选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________(选填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线_____。
【答案】 (1). 0.0125mol·L-1·min-1 (2). ac (3). 大于 (4). 不变 (5).
【解析】分析:本题考查了化学反应速率的定量表示方法和化学平衡常数、化学平衡的影响因素等知识点,同一化学反应中化学平衡常数只与温度有关,与反应物、生成物的浓度无关。
详解:(1)4分钟内氨气的反应速率为0.10/4=0.025 mol·L-1·min-1,根据化学计量数关系计算氮气的速率为 0.0125mol·L-1·min-1; (2)该反应是可逆反应,所以反应物不能完全转化我生成物,所以氨气的浓度不可能为0.20 mol·L-1,反应放热,升高温度,平衡向逆向移动,降低温度,平衡向正向移动,所以氨气的浓度不可能为0.10 mol·L-1,故选ac;(3)
达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,平衡向逆向移动,新平衡时NH3的浓度恰好为原来的2倍,则由于物质的量增加,所以容器的体积大于二分之一倍的原体积,但是由于没有改变温度,所以平衡常数不变; (4) 在第5分钟末将容器的体积缩小一半,则浓度变为原来的2倍,平衡正向移动,氨气的浓度逐渐增大,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),则NH3浓度的变化曲线如图:。
20. 阅读下列信息:
Ⅰ.表中①~⑥为短周期元素主要化合价及最简单氢化物沸点的数据:
元素性质
元素编号
①
②
③
④
⑤
⑥
氢化物沸点(℃)
-33.4
100
19.54
-87.7
-60.7
-84.9
主要化合价
+5
-3
-2
-1
+5
-3
+6
-2
+7
-1
A、B、C均为上表中的元素;
Ⅱ.A与B可形成化合物AB、AB2,AB2与水反应生成强酸甲;
Ⅲ.C与B可形成化合物CB2、CB3,CB3与水反应生成强酸乙。
请回答:
(1)表中两种同族元素的氢化物所含电子数相同,这两种氢化物之间能发生氧化还原反应生成一种单质和一种化合物,写出该反应的化学方程式_________________________。
(2)测定元素③的氢化物的相对分子质量时常常偏大,原因是___________。为了尽可能减小偏差,通常选择______温度______压强条件(选填“高”、“低”)。
(3)甲、乙分别与元素①的氢化物反应生成丙、丁、戊三种盐。0.1 mol/L的甲、乙、丙、丁、戊五种溶液,pH由小到大排列的顺序是(填写化学式)_____________。
(4)一种断路器的气体绝缘介质是③、⑤两种元素的原子形成的正八面体分子,⑤原子位于中心,其分子式为__________,该分子属于________(选填“极性”、“非极性”)分子,该气体不能燃烧,原因是(指出两种元素的化合价并做简单分析)____________________________。
【答案】 (1). H2O2+H2S = S↓ + 2H2O (2). HF分子间通过氢键形成缔合分子 (3). 高 (4). 低 (5). H2SO4、NH4HSO4、HNO3、(NH4)2SO4、NH4NO3 (6). SF6 (7). 非极性 (8). SF6中S+6价,为S的最高化合价,不可能再被氧化,F是最活泼的非金属,-1价F不可被O2氧化
【解析】分析:本题考查无极推断,推断元素及各物质名称为解答关键,注意掌握原子结构与元素周期律之间的关系。
详解:Ⅰ.表中①的主要化合价都是+5、-3,则二者都是第ⅤA族元素,应该为氮和磷元素,氢化物为氨气和磷化氢,由于氨气分子之间存在氢键,则氨气的沸点较高,故①为氮元素,④为磷元素,③⑥都有-1价,为卤素,⑥有+7价,,且③的氢化物沸点较高,所以③为氟,⑥为氯,②只有-2价,氢化物沸点为100℃,则②为氧元素,⑤的主要化合价为-2和+6,则⑤为硫元素。(1) 表中两种同族元素的氢化物所含电子数相同,这两种氢化物之间能发生氧化还原反应生成一种单质和一种化合物,方程式为H2O2+H2S = S↓+2H2O; (2) 测定元素③的氢化物的相对分子质量时常常偏大,因为HF分子间通过氢键形成缔合分子,所以为了减少误差,尽量使平衡逆向移动,则选择温度高,压强低的条件。(5) A、B、C均为上表中的元素,A与B可形成化合物AB、AB2,AB2与水反应生成强酸甲,说明A为氮元素,B为氧元素,AB为一氧化氮,AB2为二氧化氮,甲为硝酸,C与B可形成化合物CB2、CB3,则C为硫,则CB2为二氧化硫,CB3为三氧化硫,CB3与水反应生成强酸乙,为硫酸。甲、乙分别与元素①的氢化物反应生成丙、丁、戊三种盐,为硝酸铵,硫酸铵,硫酸氢铵,五种物质,pH由小到大排列的顺序是:H2SO4、NH4HSO4、HNO3、(NH4)2SO4、NH4NO3 ;(4) 一种断路器的气体绝缘介质是③、⑤两种元素的原子形成的正八面体分子,⑤原子位于中心,其分子式为SF6;该分子有对称性,是非极性分子,其中SF6中S+6价,为S的最高化合价,不可能再被氧化,F是最活泼的非金属,-1价F不可被O2氧化,所以该物质不能燃烧。
21. 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a
b
c
e
f
试回答下列问题:
(1)写出元素e的基态原子电子排布式________________,其未成对电子数为________。
(2)c在空气中燃烧产物的分子构型为_____,中心原子的杂化形式为______杂化。c能形成一种八元环状形同王冠的单质分子,原子的杂化形式为______杂化。
(3)b单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
若已知b的原子半径为d厘米,NA代表阿伏加德罗常数,b的相对原子质量为M,请回答:
①晶胞中b原子的配位数为_____,表示原子空间占有率的代数式为_____________。
②该晶体的密度为_____________g/cm3(用含有关字母的代数式表示)。a、f中,与单质b晶体中原子的堆积方式相同的是__________(填元素符号)。
【答案】 (1). [Ar]3d54s1 或1s22s22p63s23p63d54s1 (2). 6 (3). V形 (4). sp2 (5). sp3 (6). 12 (7). (8). (9). Cu
【解析】分析:本题考查的原子电子排布和杂化类型以及晶胞的计算等,难度中等,关键为晶胞的计算。
详解:(1) 结合元素周期表分析,a为镁,b为铝,c为硫,e为铬,f为铜。元素e为铬,是24号元素,其基态电子排布式为 [Ar]3d54s1 或1s22s22p63s23p63d54s1;其中3d和4s能级上的电子都未成对,所以未成对的电子有6个; (2)硫燃烧从二氧化硫,分子构型为V形 ;中心原子硫σ键电子对数为2,价层电子对数=(6-2×2)/2+1=3,硫采用sp2 杂化;硫能形成一种八元环状形同王冠的单质分子,每个硫原子形成2个硫硫键,且含有2对孤对电子对,则采用sp3杂化; (3).
①由晶胞结构图可知,以顶点原子为研究对象,与之最近的原子处于面心上,,每个顶点原子为12面共用,所以晶胞中该原子的配位数为12;②晶胞中铝原子数目为,晶胞质量为4M/NA,铝原子半径为d厘米,则晶胞棱长为cm,每个晶胞中含有4个原子,则铝原子总体积为,晶胞体积为,故空间利用率为,故晶胞的密度为;镁、锌、钛属于六方最密堆积型,而铝属于面心立方最密堆积型,所以与铝单质晶体中原子的堆积方式相同的是铜。