- 2021-08-06 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学考点36 金属的电化学腐蚀与防护
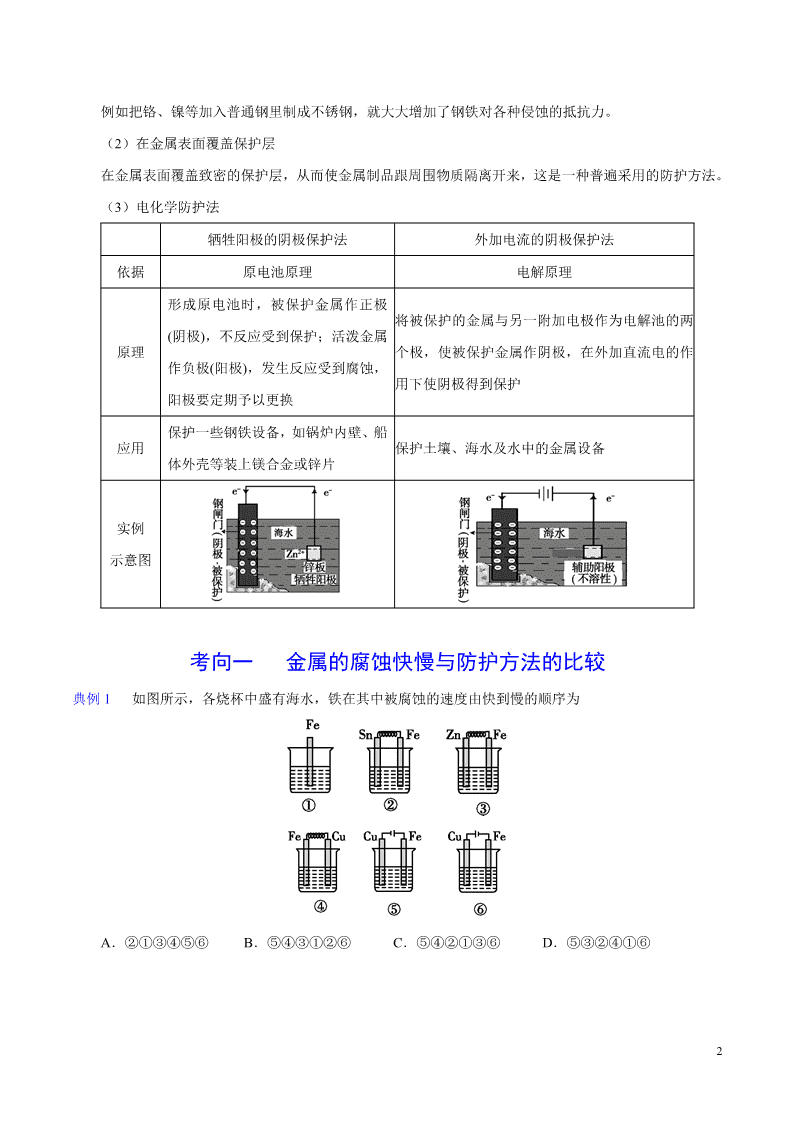
1 1.金属腐蚀的本质 金属原子失去电子变为金属阳离子,金属发生氧化反应。 2.金属腐蚀的类型 (1)化学腐蚀与电化学腐蚀 类型 化学腐蚀 电化学腐蚀 条件 金属跟非金属单质直接接触 不纯金属或合金跟电解质溶液接触 现象 无电流产生 有微弱电流产生 本质 金属被氧化 较活泼金属被氧化 联系 两者往往同时发生,电化学腐蚀更普遍 (2)析氢腐蚀与吸氧腐蚀 以钢铁的腐蚀为例进行分析: 类型 析氢腐蚀 吸氧腐蚀 图示 条件 水膜酸性较强(pH≤4.3) 水膜酸性很弱或呈中性[来源:学_科 _网 Z_X_X_K] 负极 Fe−2e− Fe2+电极反 应 正极 2H++2e− H2↑ O2+2H2O+4e− 4OH− 总反应式 Fe+2H+ Fe2++H2↑ 2Fe+O2+2H2O 2Fe(OH)2 联系 吸氧腐蚀更普遍 铁锈的形成:4Fe(OH)2+O2+2H2O 4Fe(OH)3,2Fe(OH)3 Fe2O3·xH2O(铁锈)+(3−x)H2O。 3.金属腐蚀的防护方法 (1)改变金属的内部组织结构 2 例如把铬、镍等加入普通钢里制成不锈钢,就大大增加了钢铁对各种侵蚀的抵抗力。 (2)在金属表面覆盖保护层 在金属表面覆盖致密的保护层,从而使金属制品跟周围物质隔离开来,这是一种普遍采用的防护方法。 (3)电化学防护法 牺牲阳极的阴极保护法 外加电流的阴极保护法 依据 原电池原理 电解原理 原理 形成原电池时,被保护金属作正极 (阴极),不反应受到保护;活泼金属 作负极(阳极),发生反应受到腐蚀, 阳极要定期予以更换 将被保护的金属与另一附加电极作为电解池的两 个极,使被保护金属作阴极,在外加直流电的作 用下使阴极得到保护 应用 保护一些钢铁设备,如锅炉内壁、船 体外壳等装上镁合金或锌片 保护土壤、海水及水中的金属设备 实例 示意图 考向一 金属的腐蚀快慢与防护方法的比较 典例 1 如图所示,各烧杯中盛有海水,铁在其中被腐蚀的速度由快到慢的顺序为 A.②①③④⑤⑥ B.⑤④③①②⑥ C.⑤④②①③⑥ D.⑤③②④①⑥ 3 【答案】C 1.利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是 A.若 X 为锌棒,开关 K 置于 M 处,可减缓铁的腐蚀 B.若 X 为锌棒,开关 K 置于 M 处,铁电极的反应:Fe−2e− Fe2+ C.若 X 为碳棒,开关 K 置于 N 处,可减缓铁的腐蚀 D.若 X 为碳棒,开关 K 置于 N 处,铁电极的反应:2H++2e− H2↑ 过关秘籍 (1)判断金属腐蚀快慢的规律 ①对同一电解质溶液来说,腐蚀速率的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐 蚀>有防腐措施的腐蚀。 ②对同一金属来说,在不同溶液中腐蚀速率的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶 液中。 ③活动性不同的两种金属,活动性差别越大,腐蚀速率越快。 ④对同一种电解质溶液来说,电解质浓度越大,金属腐蚀越快。 (2)两种保护方法的比较 外加电流的阴极保护法保护效果大于牺牲阳极的阴极保护法。 4 考向二 析氢腐蚀和吸氧腐蚀 典例 1 一定条件下,碳钢腐蚀与溶液 pH 的关系如下: pH 2 4 6 6.5 8 13.5 14 腐蚀快慢 较快 慢 较快 主要产物 Fe2+ Fe3O4 Fe2O3 下列说法不正确的是 A.在 pH<4 溶液中,碳钢主要发生析氢腐蚀 B.在 pH>6 溶液中,碳钢主要发生吸氧腐蚀 C.在 pH>14 溶液中,碳钢腐蚀的正极反应为 O2+4H++4e- 2H2O D.在煮沸除氧气的碱性溶液中,碳钢腐蚀速率会减缓 【答案】C 2.铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图所示。下列 说法不正确的是 A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 B.若水膜中溶解了 SO2,则铁铆钉腐蚀的速率变小 C.铜极上的反应是 2H++2e− H2↑、O2+4e−+4H+ 2H2O D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀 2FeO 5 1.下列有关金属腐蚀与防护的说法正确的是 A.铜铁接触处,在潮湿的空气中直接发生反应:Fe-3e- Fe3+,继而形成铁锈 B.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法 C.金属腐蚀的实质是金属失去电子被还原的过程 D.在酸性环境下,钢铁只能发生析氢腐蚀 2.图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门,下列说法不正确的是 A.图Ⅰ中 a 为纯铜 B.图Ⅰ中 向 b 极移动 C.图Ⅱ中如果 a、b 间连接电源,则 a 连接负极 D.图Ⅱ中如果 a、b 间用导线连接,则 X 可以是铜 3.如图是自来水表的常见安装方式。下列有关说法不正确的是 A.该安装方式的水表更容易被腐蚀 B.发生腐蚀过程中,电子从接头流向水表 C.腐蚀时水表发生的电极反应为 2H2O+O2+4e− 4OH− D.腐蚀过程还涉及反应:4Fe(OH)2+2H2O+O2 4Fe(OH)3 4.某同学利用下图所示装置探究金属的腐蚀与防护条件。 下列说法不合理的是 A.①区 Cu 电极上产生气泡,Fe 电极附近滴加 K3Fe(CN)6 溶液后出现蓝色,Fe 被腐蚀 B.②区 Cu 电极附近滴加酚酞后变成红色,Fe 电极附近滴加 K3[Fe(CN)6]溶液出现蓝色,Fe 被腐蚀 2 4SO 6 C.③区 Zn 电极的电极反应式为 Zn-2e- Zn2+,Fe 电极附近滴加 K3[Fe(CN)6]溶液未出现蓝色,Fe 被保 护 D.④区 Zn 电极的电极反应式为 2H2O+2e- H2↑+2OH-,Fe 电极附近滴加 K3[Fe(CN)6]溶液出现蓝色,Fe 被腐蚀 5.在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等金属腐蚀现象。下列说法不正确的是 A.图 1 中,铁钉不易被腐蚀 B.图 2 中,滴加少量 K3[Fe(CN)6]溶液,有蓝色沉淀生成 C.铝制品表面出现白斑可以通过图 3 装置进行探究,Cl-由活性炭区向铝箔表面区迁移,负极反应式: 2Cl--2e- Cl2↑ D.图 3 装置的总反应为 4Al+3O2+6H2O 4Al(OH)3,生成的 Al(OH)3 进一步脱水形成白斑 6.青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐 蚀。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。环境中的 Cl−扩散到孔口,并与各电极产 物作用生成多孔粉状锈 Cu2(OH)3Cl 下列说法不正确的是 A.腐蚀过程中,负极 c 被氧化 B.环境中的 Cl−扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈 Cu2(OH)3Cl,其离 子方程式为 2Cu2++3OH−+Cl− Cu2(OH)3Cl↓ C.若生成 2.145 g Cu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448 L D.正极的电极反应式为:正极反应是 O2+ 4e−+2H2O 4OH− 7.某同学做了如下实验: 7 装置 现象 电流计指针未发生偏转 电流计指针发生偏转 下列说法中正确的是 A.加热铁片Ⅰ所在烧杯,电流表指针会发生偏转 B.用 KSCN 溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极 C.铁片Ⅰ、Ⅲ的腐蚀速率相等 D.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 8.在生产生活中,金属腐蚀所带来的损失非常严重,所以防止金属腐蚀已经成为科学研究和技术领域的重 大问题。某化学兴趣小组的同学在实验室对金属腐蚀进行了探究。 (1)分别在三个洁净干燥的试管中各加入一个洁净无锈的铁钉,再向Ⅰ、Ⅱ号两个试管中分别加入经煮 沸迅速冷却的蒸馏水,然后向Ⅱ号试管中加入少量植物油,将Ⅲ号试管塞上木塞。请判断:________号 试管中的铁钉最容易生锈。由此可见,铁制品生锈需要的条件是________________。 (2)如图 2 所示,处于 A、B、C 三种不同环境中的铁片,被腐蚀的速率由大到小的顺序是________(用 字母表示)。 (3)据报道,全世界每年因为金属腐蚀造成的直接经济损失约达 7 000 亿美元,我国因金属腐蚀造成的 损失约占国民生产总值的 4%。 ①钢铁在发生电化学腐蚀时,负极反应为__________________。 ②请写出用稀硫酸除去铁锈的化学方程式:________________。 ③请根据不同的原理,提出防止钢铁腐蚀的两条合理措施:_______________、_______________。 8 1.[2017 江苏][双选]下列说法正确的是 A.反应 N2(g)+3H2(g) 2NH3(g)的 ΔH < 0,ΔS >0 B.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 C.常温下,Ksp[Mg(OH)2]=5.6×10−12,pH=10 的含 Mg2+溶液中,c(Mg2+)≤5.6×10−4 mol·L−1 D.常温常压下,锌与稀 H2SO4 反应生成 11.2 L H2,反应中转移的电子数为 6.02×1023 2.[2017 新课标Ⅰ]支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示, 其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 3.[2015 上海]研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是 A.d 为石墨,铁片腐蚀加快 B.d 为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH– C.d 为锌块,铁片不易被腐蚀 D.d 为锌块,铁片上电极反应为:2H+ + 2e → H2↑ 9 1.【答案】B 【解析】若 X 为锌棒,开关 K 置于 M 处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被 保护,可减缓铁的腐蚀,故 A 正确;若 X 为锌棒,开关 K 置于 M 处,形成原电池,此时金属锌为负极, 金属铁为正极,氧气在该极发生还原反应,故 B 不正确;若 X 为碳棒,开关 K 置于 N 处,形成电解池, 此时金属铁为阴极,铁被保护,可减缓铁的腐蚀,故 C 正确;若 X 为碳棒,开关 K 置于 N 处,形成电 解池,X 极为阳极,发生氧化反应,铁电极为阴极,发生还原反应,故 D 正确。 2.【答案】B 【解析】铁、铜和水膜形成原电池,因为铁的金属性比铜强,所以铁为负极,铁铆钉被氧化而腐蚀,A 正确;若水膜中溶解了 SO2,则发生析氢腐蚀,铁铆钉腐蚀的速率加快,B 不正确;铜极发生还原反应, 根据题图知铜电极吸收了氧气且生成氢气,所以发生两个电极反应:2H++2e− H2↑、O2+4e−+4H+ 2H2O,C 正确;在金属表面涂一层油脂,可隔绝空气和水,能防止铁铆钉被腐蚀,D 正确。 1.【答案】B 【解析】Cu、Fe 和电解质溶液构成原电池,发生吸氧腐蚀,Fe 作负极、Cu 作正极,负极反应式为 Fe-2e- Fe2+,故 A 错误;Zn、Fe 和海水构成原电池,Zn 易失电子作负极而被腐蚀,Fe 作正极被保护,所以 轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法,故 B 正确;金属腐蚀的实质是 金属失去电子发生氧化反应,所以属于被氧化的过程,故 C 错误;强酸性环境下,钢铁发生析氢腐蚀,弱 酸性或中性条件下,钢铁发生吸氧腐蚀,所以酸性条件下钢铁不一定发生析氢腐蚀,故 D 错误。 3.【答案】A 【解析】构成原电池,腐蚀铁,保护铜,所以该安装方式的水表不易被腐蚀,故 A 不正确;电子由铁流 向铜,即电子从接头流向水表,故 B 正确;水表发生了吸氧腐蚀,氧气在水表的表面得电子,电极反应 式为 2H2O+O2+4e− 4OH−,故 C 正确;负极放电产生的 Fe2+与正极产生的 OH−结合成 Fe(OH)2, Fe(OH)2 被空气中的氧气氧化生成氢氧化铁,所以腐蚀过程还涉及反应: 4Fe(OH)2+2H2O+O2 4Fe(OH)3,故 D 正确。 10 4.【答案】A 【解析】①区发生吸氧腐蚀,Cu 为正极,电极反应式为 O2+2H2O+4e- 4OH-,Cu 电极上不产生气泡, A 项错误;②区 Cu 为阴极,电极反应式为 2H2O+2e- H2↑+2OH-,Cu 电极附近溶液碱性增强,滴加酚 酞后变成红色,Fe 为阳极,被腐蚀,电极反应式为 Fe-2e- Fe2+,Fe 电极附近滴加 K3[Fe(CN)6]溶液出 现蓝色,B 项正确;③区 Zn 为负极,电极反应式为 Zn-2e- Zn2+,Fe 为正极,得到保护,C 项正确;④ 区 Zn 为阴极,电极反应式为 2H2O+2e- H2↑+2OH-,Fe 作阳极,被腐蚀,电极反应式为 Fe-2e- Fe2+,Fe 电极附近滴加 K3[Fe(CN)6]溶液出现蓝色,D 项正确。 6.【答案】C 【解析】A、根据图知,氧气得电子生成氢氧根离子、Cu 失电子生成铜离子,发生吸氧腐蚀,则 Cu 作 负极被氧化,腐蚀过程中,负极是 a,A 正确;B、Cl−扩散到孔口,并与正极反应产物和负极反应产物 作用生成多孔粉状锈 Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离 子、铜离子和氢氧根离子反应生成 Cu2(OH)3Cl 沉淀,离子方程式为 2Cu2++3OH−+Cl− Cu2(OH)3Cl↓, B 正确;C、n[Cu2(OH)3Cl]=2.145 g÷214.5 g/mol=0.01 mol,根据转移电子相等可得 n(O2)=0.01 mol×2×2/4=0.01 mol,故在标准状态体积为 V=0.01 mol×22.4 L/mol=0.224 L,C 错误;D、氧气在正极得 电子生成氢氧根离子,电极反应式为:O2+ 4e−+2H2O 4OH−,D 正确,答案选 C。 【名师点睛】掌握电化学原理是解题的关键。电化学知识包括原电池和电解池,首先要确定装置是原电 池还是电解池。确定方法是观察图示是否有电源,若有就是电解池,否则就是原电池。电解池工作时, 阳极发生氧化反应,阴极发生还原反应。结合电解质溶液的酸碱性书写电极反应式、总反应方程式,并 根据电性作用原理:同种电荷相互排斥,异种电荷相互吸引确定电解质溶液中离子移动的方向。原电池 工作时,活动性强的电极为负极,发生氧化反应,活动性弱的电极为正极,正极上发生还原反应。要掌 握电化学反应原理,结合电极及电解质溶液的酸碱性正确书写电极反应式,利用好图示及题干提供的信 息,是本题解决的关键。尤其要注意电解质溶液的性质。 7.【答案】A 11 【解析】A.温度不同,反应速率不等,能够产生电流,电流表指针会发生偏转,故 A 正确;B.两烧杯中溶 液的浓度不同,发生离子的定向移动,产生电流,铁失去电子发生氧化反应,生成亚铁离子,与 KSCN 溶液无明显现象,不能判断电池的正、负极,故 B 错误;C.铁片Ⅰ中未构成原电池、铁片Ⅲ构成了原电池, 腐蚀速率一定不相等,故 C 错误;D.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ未构成原电池,但铁 片表面均发生吸氧腐蚀,故 D 错误;故选 A。 8.【答案】(1)Ⅰ 有水和氧气 (2)A>C>B (3)①Fe-2e- Fe2+ ②Fe2O3+3H2SO4 Fe2(SO4)3+3H2O ③改变金属内部结构 刷漆(合理即可) 1.【答案】BC 【解析】A.该反应气体的分子数减少了,所以是熵减的反应,ΔS<0,A 错误;B.锌比铁活泼,形成原 电池时锌做负极,所以可以减缓钢铁管道的腐蚀,B 正确;C.常温下,在 pH=10 的溶液中, c(OH−)=1 mol/L,溶液中含 Mg2+浓度最大值为 =5.6 mol/L,C 正确; D.在锌和稀硫酸的反应中每生成 1 mol H2,电子转移的数目为 2 mol e−,在常温常压下,11.2 L H2 的物 质的量不是 0.5 mol,所以反应中转移的电子数不是 6.02 ,D 不正确。 2.【答案】C 【解析】本题使用的是外加电流的阴极保护法,钢管柱与电源的负极相连,被保护。A.外加强大的电 流可以抑制金属电化学腐蚀产生的电流,从而保护钢管柱,A 正确;B.通电后,被保护的钢管柱作阴 极,高硅铸铁作阳极,因此外电路电子被强制从高硅铸铁流向钢管桩,B 正确;C.高硅铸铁为惰性辅助 阳极,所以高硅铸铁不损耗,C 错误;D.通过外加电流抑制金属电化学腐蚀产生的电流,因此通入的 保护电流应该根据环境条件变化进行调整,D 正确。答案选 C。 【名师点睛】该题难度较大,明确电化学原理是以及金属的防腐蚀原理是解答的关键,钢管桩表面腐蚀 410 12 sp 22 4 5.6 10 OH 1 10 K c 410 2310 12 电流的理解是难点,注意题干信息的挖掘,即高硅铸铁为惰性辅助阳极,性质不活泼,不会被损耗。查看更多