- 2021-08-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届河南省南阳一中高二下学期第二次月考(5月)(2017
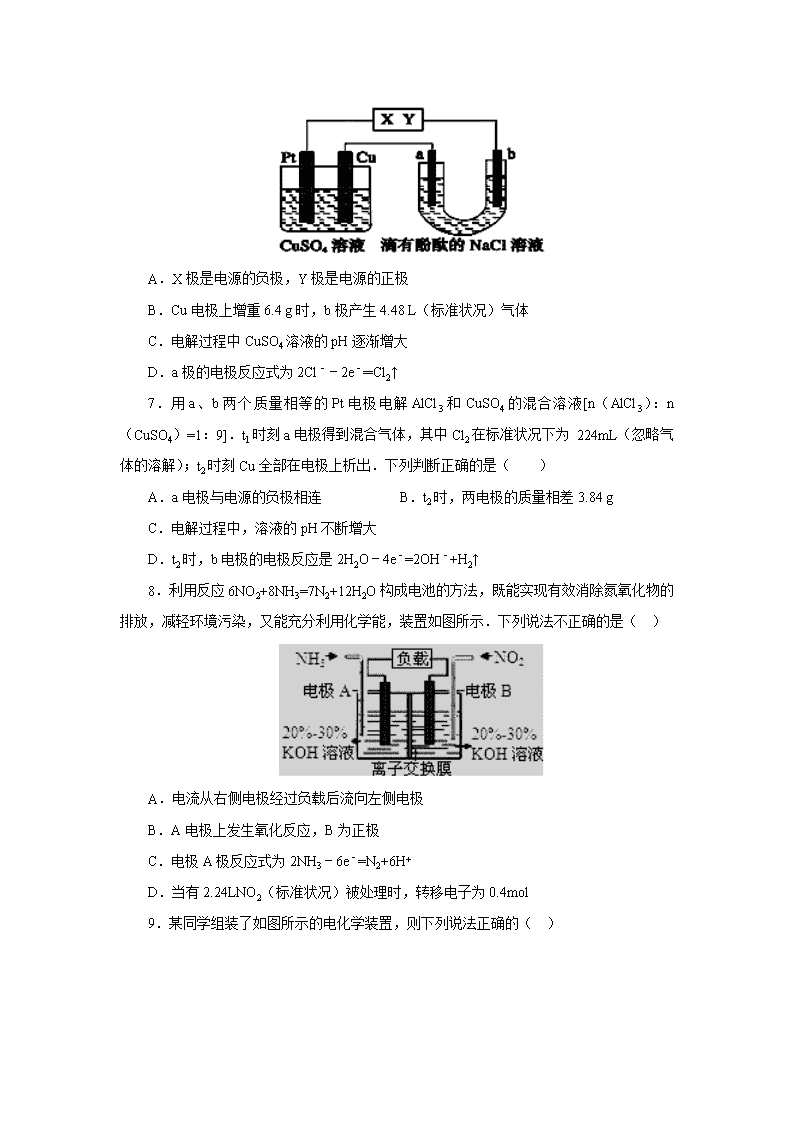
南阳一中2017年春期高二5月第二次考试 化学试题 可能用到的相对原子质量: H:1 C:12 Cu:64 Ag:108 一、单选题(本题共12小题,每小题4分,共48分) 1.下列热化学方程式或叙述正确的是( ) A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642kJ的热量: N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=+642 kJ•mol﹣1 B.12 g石墨转化为CO时,放出110.5 kJ的热量: 2C(石墨,s)+O2(g)═2CO(g)△H=﹣110.5 kJ•mol﹣1 C.已知:H2(g)+ O2(g)═H2O(l)△H=﹣286 kJ•mol﹣1 , 则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJ•mol﹣1 D.已知N2(g)+3H2(g)2NH3(g)△H=﹣92.4 kJ•mol﹣1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量 2.一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知: ①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ•mol﹣1 ②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJ•mol﹣1 下列选项正确的是( ) A.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJ•mol﹣1 B.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)的反应热为△H3则△H3>△H1 C.若用0.2molCH4还原NO2至N2,则反应中放出的热量一定为173.4kJ D.若用标准状况下2.24LCH4还原NO2至N2,整个过程中转移的电子为1.6mol 3.下列有关反应热的叙述中正确的是( ) ①下表数据可以计算出 (g)+3H2(g)→ (g)的反应热; 共价键 C﹣C C═C C﹣H H﹣H 键能/(kJ•mol﹣1) 348 610 413 436 ②已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ•mol﹣1, 则氢气的燃烧热为 △H=﹣241.8kJ•mol﹣1 ③由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 ④X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大 ⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等; ⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热. A.①②③④ B.③④⑤ C.④⑤ D.⑥ 4.金属镍有广泛的用途.粗镍中含有少量Fe、Cu、Pt等杂质,可用电解法制备高纯度的镍(用 NiSO4作电解质溶液).已知:氧化性Fe2+<Ni2+<Cu 2+,下列叙述正确的是( ) A.阴极发生还原反应,其电极反应式:Ni2++2e﹣═Ni B.电解后,溶液中 Ni2+浓度不变 C.电解后,溶液中存在的金属阳离子只有Fe2+ D.电解过程中,阳极质量的减少与阴极质量的增加相等 5.利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2 .下列说法正确的是( ) A.a为直流电源的负极 B.阴极的电极反应式为:2HSO3﹣+2H++e﹣═S2O42﹣+2H2O C.阳极的电极反应式为:SO2+2H2O﹣2e﹣═SO42﹣+4H+ D.电解时,H+由阴极室通过阳离子交换膜到阳极室 6.如图所示,a、b是石墨电极,通电一段时间后,b极附近溶液显红色.下列说法正确的是( ) A.X极是电源的负极,Y极是电源的正极 B.Cu电极上增重6.4 g时,b极产生4.48 L(标准状况)气体 C.电解过程中CuSO4溶液的pH逐渐增大 D.a极的电极反应式为2Cl﹣﹣2e﹣═Cl2↑ 7.用a、b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3):n(CuSO4)=1:9].t1时刻a电极得到混合气体,其中Cl2在标准状况下为 224mL(忽略气体的溶解);t2时刻Cu全部在电极上析出.下列判断正确的是( ) A.a电极与电源的负极相连 B.t2时,两电极的质量相差3.84 g C.电解过程中,溶液的pH不断增大 D.t2时,b电极的电极反应是2H2O﹣4e﹣=2OH﹣+H2↑ 8.利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法不正确的是( ) A.电流从右侧电极经过负载后流向左侧电极 B.A电极上发生氧化反应,B为正极 C.电极A极反应式为2NH3﹣6e﹣=N2+6H+ D.当有2.24LNO2(标准状况)被处理时,转移电子为0.4mol 9.某同学组装了如图所示的电化学装置,则下列说法正确的( ) A.图中甲池为原电池装置,Cu电极发生还原反应 B.实验过程中,甲池左侧烧杯中NO3﹣的浓度不变 C.若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液 D.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小 10.下列四种元素中,其非金属性最强的是( ) A.原子最外层电子排布为2s22p6的元素 B.原子最外层电子排布为3s23p5的元素 C.原子含有未成对电子最多的第二周期元素 D.位于周期表中第三周期ⅢA族的元素 11.X、Y、Z和W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在元素周期表中,Z与Y、W均相邻;Y、Z和W三种元素的原子最外层电子数之和为17。则下列有关叙述正确的是 ( ) A.Y、Z和W三种元素可能位于同一周期 B.B、上述元素形成的氢化物中, W的氢化物相对分子质量最大,熔、沸点最高 C.C、Y和W所形成的含氧酸均为强酸 D.D、X、Y、Z和W可以组成原子的物质的量之比为5∶1∶4∶1的离子化合物 12.下列分子中的中心原子杂化轨道的类型相同的是( ) A.CH4与C2H4 B.BF3与NH3 C.BeCl2与SCl2 D.H2O与H2S 二、非选择题。 13.(11分)请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题: 化学键 P—P P—O O===O P===O 键能/kJ·mol-1 a b c x (1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。请写出NO2和CO反应的热化学方程式: 。 (2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1 ②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1 又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为 。 (3)如表所示是部分化学键的键能参数: 已知白磷的燃烧热为ΔH=-d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x= kJ·mol-1(用含a、b、c、d的代表数式表示)。 14.(9分) 下图所示的四个容器中分别盛有不同的溶液,除a、b外,其余电极均为石墨电极。甲为铅蓄电池,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同。据此回答: (1)a电极的电极材料是 (填“PbO2”或“Pb”)。 (2)丙装置中发生电解的总反应方程式为 。 (3)电解20min时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量是 。 (4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,发现电流计指针偏转,则此时c电极为 极,d电极上发生反应的电极反应式为 。 15.(19分) (一)金属冶炼和处理常涉及氧化还原反应。 (1)由下列物质冶炼相应金属时采用电解法的是 。 a.Fe2O3 b.NaCl c.Cu2S d.Al2O3 (2)右图为电解精炼银的示意图, (填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为 。 (3)为处理银器表面的黑斑(Ag2S),可将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,该过程依据的是电化学中的 原理(填“原电池”或“电解池”),食盐水的作用为 。 (二)FeCl3具有净水作用,但腐蚀设备,所以工业上常选用电浮选凝聚法处理污水.其原理是保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.某课外小组用电浮选凝聚法处理污水,设计如图所示装置示意图。 (1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的______。 A.BaSO4 B.CH3CH2OH C.Na2SO4 D.NaOH (2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ ,Ⅱ 。 (3)电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是 。 (4)该燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极,负极电极反应式为 。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(如图),A物质的化学式是______。 16.(13分) 聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 PPG的一种合成路线如下: 已知: ①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢; ②化合物B为单氯代烃:化合物C的分子式为C5H8; ③E、F为相对分子质量差14的同系物,F是福尔马林的溶质; ④。 回答下列问题: (1)A的名称为 。 (2)由B生成C的化学方程式为 。 (3)由E和F生成G的反应类型为 ,G中官能团的名称为 。 (4)由D和H生成PPG的化学方程式为 。 (5)1molD的同分异构体能与饱和NaHCO3溶液反应产生2mol气体,满足这样条件的共有 种(D除外,不含立体异构),其中核磁共振氢谱显示为2组峰,且峰面积比为3:1的是 (写结构简式)。D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。 a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪 南阳一中2017年春期高二5月第二次考试 化学试题参考答案 1-5 CADAC 6-10 DBCCB 11-12 DD 13.(1)减小(2分) 不变 (2分) NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1(2分) (2)CH3OH(g)+O2(g)===CO2(g)+2H2O(l) ΔH=-764.7 kJ·mol-1(3分) (3)(d+6a+5c-12b)(2分) 14. 15.(一)(1)bd(2分) (2)a (1分) 2H++NO3-+e-===NO2+H2O(2分) (3)原电池 (1分) 作电解质溶液(或导电)(1分) (二)(1)C(2分) (2)Fe-2e-=Fe2+ (2分) 2H2O-4e-=4H++O2↑(2分) (3)4Fe2++10H2O+O2=4Fe(OH)3↓+8H+(2分) (4)CH4 -8e-+4CO32-=5CO2+2H2O (2分) CO2(2分) 16.(1)环戊烷 (1分) (2)(2分) (3)加成反应 (1分) 羟基、醛基 (2分) (4)(2分) (5)3 (2分) (2分) c(1分)查看更多