- 2021-08-06 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届云南省楚雄州民族中学高二12月月考(2016
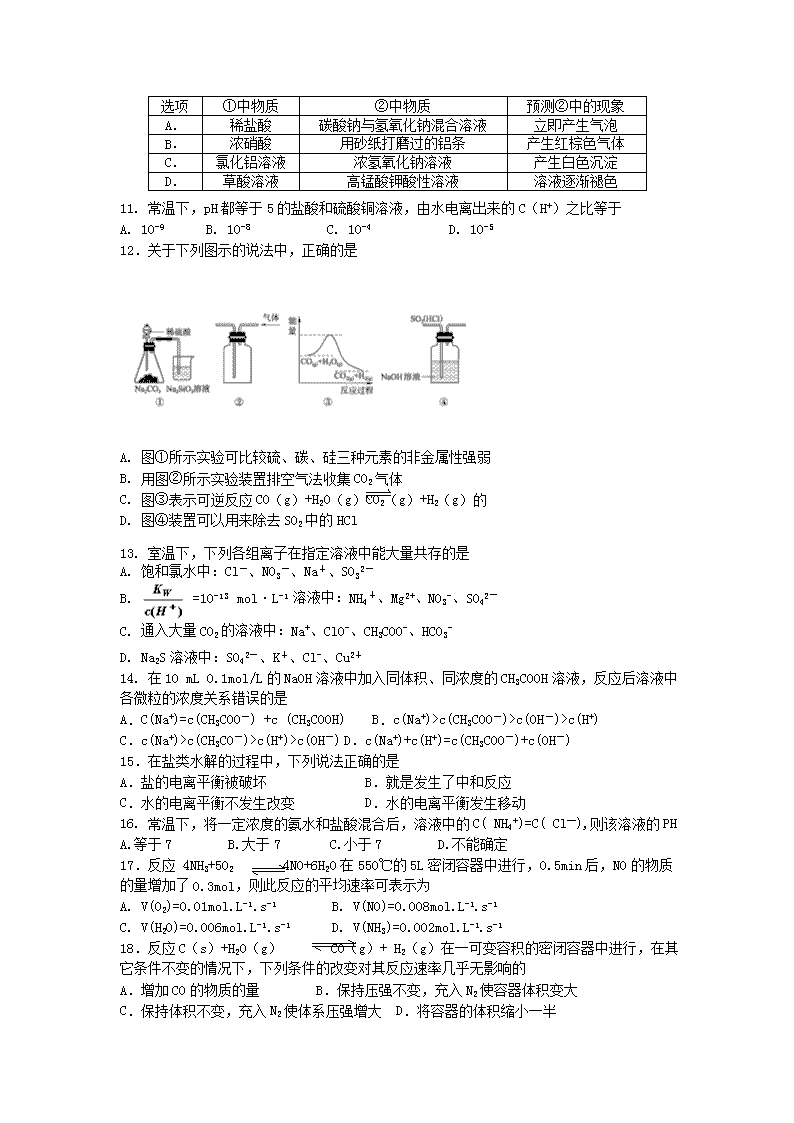
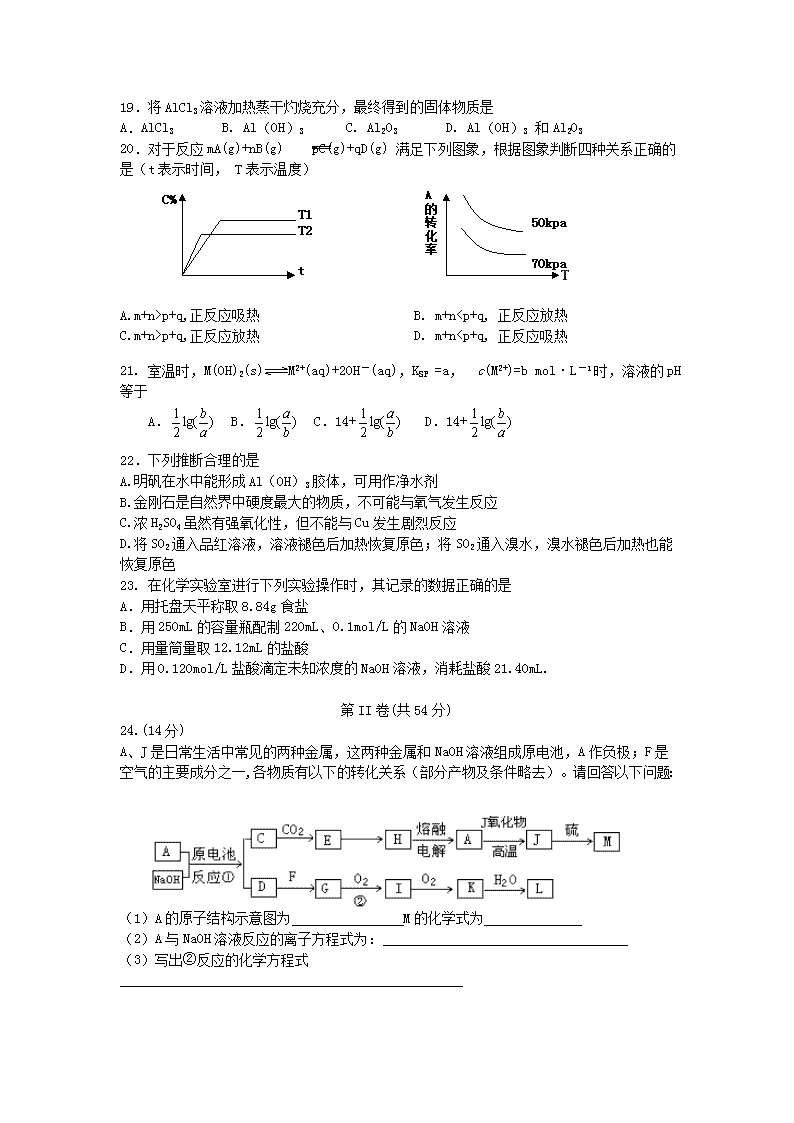
楚雄民族中学2016-2017学年高二年级上学期12月考试 化学试卷 可能所需的原子式量:H- 1 O -16 S- 32 Na- 23 Cl- 35.5 Cu- 64 Mn -55 Al-27 Zn-65 Fe-56 第I卷 选择题(共46分) 出题教师:杨彬 审题教师:陈桂华 选择题(本题共21题,每小题只有一个选项符合题意,每小题2分,共50分) 1. 食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是 A.硅胶可用作食品干燥剂 B.P2O5不可用作食品干燥剂 C.六水合氯化钙可用作食品干燥剂 D.加工后具有吸水性的植物纤维可用作食品干燥剂 2. 下列反应中,反应后固体物质增重的是 A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末 C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液 3. 下列离子方程式正确的是 A.氢氧化钡溶液和硫酸溶液混合Ba2++OH-+SO42-+H+ =BaSO4+ H2O B.碳酸钠溶解在水中 CO32- +2H2O H2CO3+2OH- C.铁和稀硝酸反应 2Fe +6 H+===2Fe3+ +3 H2↑ D.FeBr2溶液中加过量的氯水 2Fe2+ + 4Br— +3 Cl2 ===2 Fe3+ + 2Br2 + 6Cl- 4. NA代表阿伏加德罗常数的值。下列叙述正确的是 A.60g丙醇中存在的共价键总数为10NA B.1L 0.1mol·L-1的NaHCO3-溶液中HCO3-和CO32-离子数之和为0.1NA C.钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA D.10L 0.1 mol/L碳酸钠溶液中N(CO32-)+ N(HCO3-)=1NA 5.短周期元素X、Y。X元素的阳离子和Y元素的阴离子具有相同的核外电子结构,下列叙述正确的是 A.原子序数X<Y B.原子半径X<Y C.离子半径X>Y D.原子最外层电子数X<Y 6.在25℃时,0.1mol/L的弱碱MOH的PH =9的电离平衡常数为 A.10-9 B.10-6 C.10-5 D. 10-10 7.在足量二氧化锰与浓盐酸反应中,为降低反应速率,而又不影响产生氯气量,可采取的措施为 A. 加少量浓盐酸 B.加入一定量的水 C.加少量二氧化锰 D. 适当降低反应温度 8.在25℃时,将PH =11的NaOH溶液a mL与pH= 1的H2SO4溶液b mL混合,当恰好完全中和时,a与b的比值为 A.1000 :1 B.100 :1 C.50 :1 D.10 :1 9. 物质的量浓度、体积均相等的某一元酸和某一元碱相互反应完全,溶液一定呈 A.酸性 B.碱性 C.中性 D.无法确定 10.进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 选项 ①中物质 ②中物质 预测②中的现象 A. 稀盐酸 碳酸钠与氢氧化钠混合溶液 立即产生气泡 B. 浓硝酸 用砂纸打磨过的铝条 产生红棕色气体 C. 氯化铝溶液 浓氢氧化钠溶液 产生白色沉淀 D. 草酸溶液 高锰酸钾酸性溶液 溶液逐渐褪色 11. 常温下,pH都等于5的盐酸和硫酸铜溶液,由水电离出来的C(H+)之比等于 A. 10-9 B. 10-8 C. 10-4 D. 10-5 12.关于下列图示的说法中,正确的是 A. 图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 B. 用图②所示实验装置排空气法收集CO2气体 C. 图③表示可逆反应CO(g)+H2O(g)CO2(g)+H2(g)的 D. 图④装置可以用来除去SO2中的HCl 13. 室温下,下列各组离子在指定溶液中能大量共存的是 A. 饱和氯水中:Cl-、NO3-、Na+、SO32- B. =10-13 mol·L-1 溶液中:NH4+、Mg2+、NO3-、SO42- C. 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- D. Na2S溶液中:SO42-、K+、Cl-、Cu2+ 14. 在10 mL 0.1mol/L的NaOH溶液中加入同体积、同浓度的CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是 A.C(Na+)=c(CH3COO-) +c (CH3COOH) B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) C.c(Na+)>c(CH3CO-)>c(H+)>c(OH-) D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-) 15.在盐类水解的过程中,下列说法正确的是 A.盐的电离平衡被破坏 B.就是发生了中和反应 C.水的电离平衡不发生改变 D.水的电离平衡发生移动 16. 常温下,将一定浓度的氨水和盐酸混合后,溶液中的C( NH4+)=C( Cl—),则该溶液的PH A.等于7 B.大于7 C.小于7 D.不能确定 17.反应 4NH3+5O2 4NO+6H2O在550℃的5L密闭容器中进行,0.5min后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为 A. V(O2)=0.01mol.L-1.s-1 B. V(NO)=0.008mol.L-1.s-1 C. V(H2O)=0.006mol.L-1.s-1 D. V(NH3)=0.002mol.L-1.s-1 18.反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的 A.增加CO的物质的量 B.保持压强不变,充入N2使容器体积变大 C.保持体积不变,充入N2使体系压强增大 D.将容器的体积缩小一半 19.将AlCl3溶液加热蒸干灼烧充分,最终得到的固体物质是 A.AlCl3 B. Al(OH)3 C. Al2O3 D. Al(OH)3 和Al2O3 20.对于反应mA(g)+nB(g) pC(g)+qD(g) 满足下列图象,根据图象判断四种关系正确的是(t表示时间, T表示温度) C% t T1 T2 A的转化率 50kpa 70kpa T A.m+n>p+q,正反应吸热 B. m+n查看更多