- 2021-08-06 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学理卷·2018届广东省仲元中学高二上学期期末考试(2017
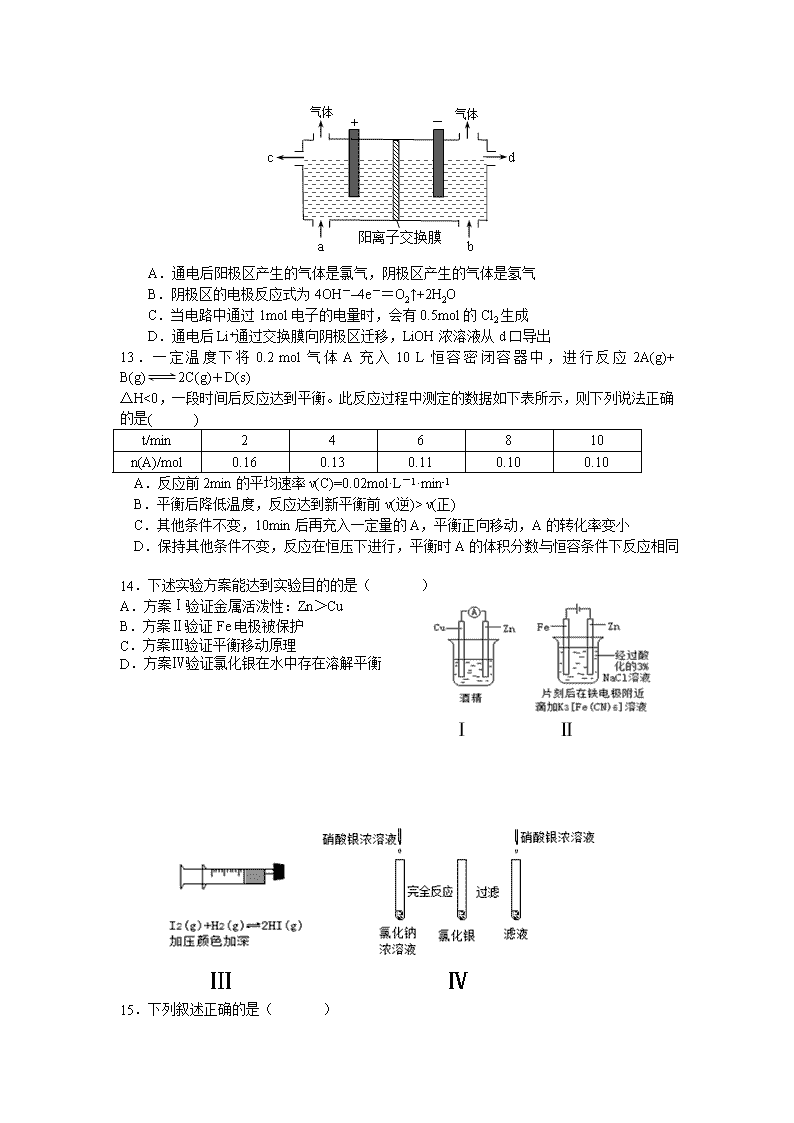
广东仲元中学2016学年第一学期期末考试 高二年级化学(理科)试卷 本试卷分第一部分(选择题)和第二部分(非选择题),满分100分,考试时间60分钟。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Zn 65 第一部分 选择题(共45分) 一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意) 1.化学反应A2(g) + B2(g)=2AB(g) 的能量变化如图所示,下列叙述中正确的是( ) A.每生成2mol AB(g) 共吸收b kJ热量 B.该反应热ΔH = +(a-b) kJ·mol-1 C.反应物的总能量大于生成物的总能量 D.断裂1 mol A—A键,放出a kJ能量 2.若溶液中由水电离产生的c (OH-)=1×10-13mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( ) A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3- C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3- 3.油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)已知燃烧1kg该化合物释放出热量3.8×104kJ。油酸甘油酯的燃烧热△H为( ) A.3.8×104kJ·mol-1 B.-3.8×104kJ·mol-1 C.3.4×104kJ·mol-1 D.-3.4×104kJ·mol-1 4.通过以下反应均可获取H2。下列有关说法正确的是( ) ①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6kJ·mol–1 ②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=+131.3kJ·mol–1 ③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1 A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用催化剂,ΔH3减小 D.反应CH4(g)=C(s)+2H2(g)的ΔH=+74.8kJ·mol–1 5.在恒温恒容的密闭容器中,对于某储氢反应:MHx(s)+yH2(g)MHx+2y(s) ΔH<0达到平衡状态的标志是( ) A.容器内气体压强保持不变 B.吸收y mol H2只需1 mol MHx C.若降温,该反应的平衡常数减小 D.若向容器内通入少量氢气,则v(放氢)>v(吸氢) 6.醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,下列叙述不正确的是( ) A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) B.0.10mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小 C.CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动 D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 7.常温下,下列溶液的离子浓度关系正确的是( ) A.pH=3的醋酸溶液稀释100倍后,溶液的pH=5 B.pH=2的盐酸与等体积0.01 mol·L-1醋酸钠混合溶液后,溶液中c(Cl-)=c(CH3COO-) C.氨水中通入过量CO2后,溶液中c(H+)+ c(NH4+)= c(OH-)+ c(HCO3-) D.0.1mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)>c(I-) 8.25℃时,用0.1000 mol·L-1NaOH溶液分别滴定20.00ml 0.1000 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( ) A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积不相等 C.V(NaOH) =10.00mL时,醋酸溶液中 c(Na+)>c(CH3COO-)>c(OH-) >c(H+) D.V(NaOH) =20.00mL时,两溶液中 c(CH3COO-)>c(Cl-) 9.已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( ) A.a=b B.混合溶液的pH=7 C.混合溶液中,c(H+)= D.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-) 10.工业上制备纯硅的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g)ΔH = +Q kJ·mol-1 (Q >0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( ) A.反应过程中,若增大压强能提高SiCl4的转化率 B.若反应开始时SiCl4为1 mol,则在平衡时,吸收热量为Q kJ C.将反应的温度由T1升高至T2,则对应温度下的平衡常数K1>K2 D.当反应吸收热量为0.25Q kJ时,生成的HCl恰好与1 mol NaOH反应 11.电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4): Cr2O72-(aq)+2Pb2+(aq)+H2O(l)2 PbCrO4(s)+2H+(aq) ΔH< 0 该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( ) 12.用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述不正确的是( ) A.通电后阳极区产生的气体是氯气,阴极区产生的气体是氢气 B.阴极区的电极反应式为4OH-–4e-=O2↑+2H2O C.当电路中通过1mol电子的电量时,会有0.5mol的Cl2生成 D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出 13.一定温度下将0.2 mol气体A充入10 L恒容密闭容器中,进行反应2A(g)+ B(g)2C(g)+D(s) △H<0,一段时间后反应达到平衡。此反应过程中测定的数据如下表所示,则下列说法正确的是( ) t/min 2 4 6 8 10 n(A)/mol 0.16 0.13 0.11 0.10 0.10 A.反应前2min的平均速率ν(C)=0.02mol·L-1·min-1 B.平衡后降低温度,反应达到新平衡前ν(逆)> ν(正) C.其他条件不变,10min后再充入一定量的A,平衡正向移动,A的转化率变小 D.保持其他条件不变,反应在恒压下进行,平衡时A的体积分数与恒容条件下反应相同 14.下述实验方案能达到实验目的的是( ) A.方案Ⅰ验证金属活泼性:Zn>Cu B.方案Ⅱ验证Fe电极被保护 C.方案Ⅲ验证平衡移动原理 D.方案Ⅳ验证氯化银在水中存在溶解平衡 15.下列叙述正确的是( ) A.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 B.在0.1 mol•L﹣1 CH3COONa溶液中:n(OH﹣)+0.1mol>n(CH3COOH)+n(H+)+n(Na+) C.在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)< Ksp(AgCl) D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)>c(C2O42-) 第二部分 非选择题(共55分) 16.(Ⅰ) 沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。难溶物在水中溶解达到饱和时,即建立沉淀溶解平衡,平衡常数称为溶度积(Ksp)。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。 (1)将浓度均为0.1mol/L的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)= mol/L。取100mL滤液与100mL2mol/LNa2SO4的溶液混合,混合液中c(Ba2+)= mol/L。 (2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。 ①CaSO4 转化为CaCO3的离子方程式为 ②请分析CaSO4 转化为CaCO3的原理 。 (Ⅱ)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题: (1)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为_____ ______。 (2)①2O2(g)+N2(g)=N2O4(l) △H1 ②N2(g)+2H2(g)=N2H4(l) △H2 ③O2(g)+2H2(g)=2H2O(g) △H3 ④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=-1048.9kJ/mol 上述反应热效应之间的关系式为△H4=________________,联氨和N2O4可作为火箭推进剂的主要原因为_________________________________________________。 (Ⅲ)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。 ⑴滴定 ①用 式滴定管盛装0.1000 mol/L盐酸标准液,锥形瓶中 装有25.00mL待测烧碱溶液。上图表示某次滴定时50 mL滴定管中 前后液面的位置。请将用去的标准盐酸的体积填入②表空格中。 ②有关数据记录如下: 滴定序号 待测液体积(mL) 所消耗盐酸标准液的体积(mL) 滴定前 滴定后 消耗的体积 1 25.00 0.50 25.95 25.45 2 25.00 3 25.00 6.00 31.55 25.55 (2)根据所给数据,计算出烧碱样品的物质的量浓度。 c = 。 (3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”) a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ; b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果 ; 17.随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。 完成下列填空: (1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为: CO2(g)+4H2(g)CH4(g)+2H2O(g) 已知H2的体积分数随温度的升高而增加。 若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”) v正 v逆 平衡常数K 转化率α (2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表: c(CO2)/mol·L-1 c(H2)/mol·L-1 c(CH4)/mol·L-1 c(H2O)/mol·L-1 平衡Ⅰ a b c d 平衡Ⅱ m n x y a、b、c、d与m、n、x、y之间的关系式为_________。 (3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11 草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5 0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”) 等浓度广东草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。 若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号) a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-) b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-) c.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-) d.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-) (4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3- H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。 ________________________________ 18.(15分)冬季是雾霾天气高发的季节,其中汽车尾气和燃煤尾气是造成雾霾的原因之一。 (1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)2CO2(g)+N2(g) ①在一定条件下,在一个容积固定为2L的密闭容器中充入0.8molNO和1.20molCO,开始反应至3min时测得CO的转化率为20%,则用N2表示的平均反应速率为V(N2)=_______ _____________。 ②对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=________________。 ③该反应在低温下能自发进行,该反应的△H_______0,(选填“>”、“=”或“<”) ④在某一绝热,恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如右图所示(已知t2—t1=t3—t2)。 则下列说法不正确的是__________。(填编号) A.反应在c点未达到平衡状态 B.反应速率a点小于b点 C.反应物浓度a点大于b点 D.NO的转化率t1—t2=t2—t3 (2)使用甲醇汽油可能减少汽车尾气对环境的污染,某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)⇌CH3OH(g),到达平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L,现往容器中继续通人3mol CO,此时v(正)____ v(逆)(选填‘‘>”、“<’’或“=”),判断的理由____________。 (3)二甲醚也是清洁能源,用合成气在催化剂存在下制备二甲醚的反应原理为: 2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) 已知一定条件下,该反应中CO的平衡转化率随温度、投料比的变化曲线如图: ①a、b、c按从大到小的顺序排序为___________。 ②某温度下,将2.0mol CO(g)和4.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如上图所示,关于温度和压强的关系判断正确的是___________; A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3 ③在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___________:【来源:全,品…中&高*考+网】 A.正反应速率先增大后减小 B.逆反应速率先增大后减小 C.化学平衡常数K值增大 D.反应物的体积百分含量增大 E.混合气体的密度减小 F.氢气的转化率减小 广东仲元中学2016学年第一学期期末考试 高二年级化学(理科)试卷 参 考 答 案 1 B 2 B 3 D 4 D 5 A 6 B 7 D 8 B 9 C 10 D 11 A 12 B 13 B 14 B 15 A 16.(Ⅰ)(23分) (1)1×10-5(1分) 1×10-10(2分) (2)①CaSO4(s)+CO32- (aq)=CaCO3(s)+SO42-(aq) (2分) ②CaSO4 存在沉淀溶解平衡,加入Na2CO3溶液后,CO32- 与Ca2+结合生成CaCO3沉淀Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动。(2分) (Ⅱ)(1)NaClO+2NH3=N2H4+NaCl+H2O (3分) (2)△H4=2△H3-2△H2-△H1 ;(3分)反应放热量大、产生大量气体(2分) (Ⅲ)(1)酸 0.30 24.90 24.00 (4分) (2)0.1000mol/L (2分) (3)无影响 偏低(2×2分) 17.(14分) (1)(4分) v正 v逆 平衡常数K 转化率α 增大 增大 减小 减小 (2) (2分) (3)大于;(2分) 草酸;(2分) ac (2分) (4)当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。(合理即给分)(2分) 18.(18分)(1)①0. 02mol·(L·min)-1 (2分) ② (2分) ③< (2分) ④ D (2分) (2)=(2分) QC=k,平衡不移动(2分) (3)①a>b>c (2分) ②B D (2分) ③B D(2分)查看更多