- 2021-08-06 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年安徽省定远重点中学高二上学期期末考试化学试题 Word版
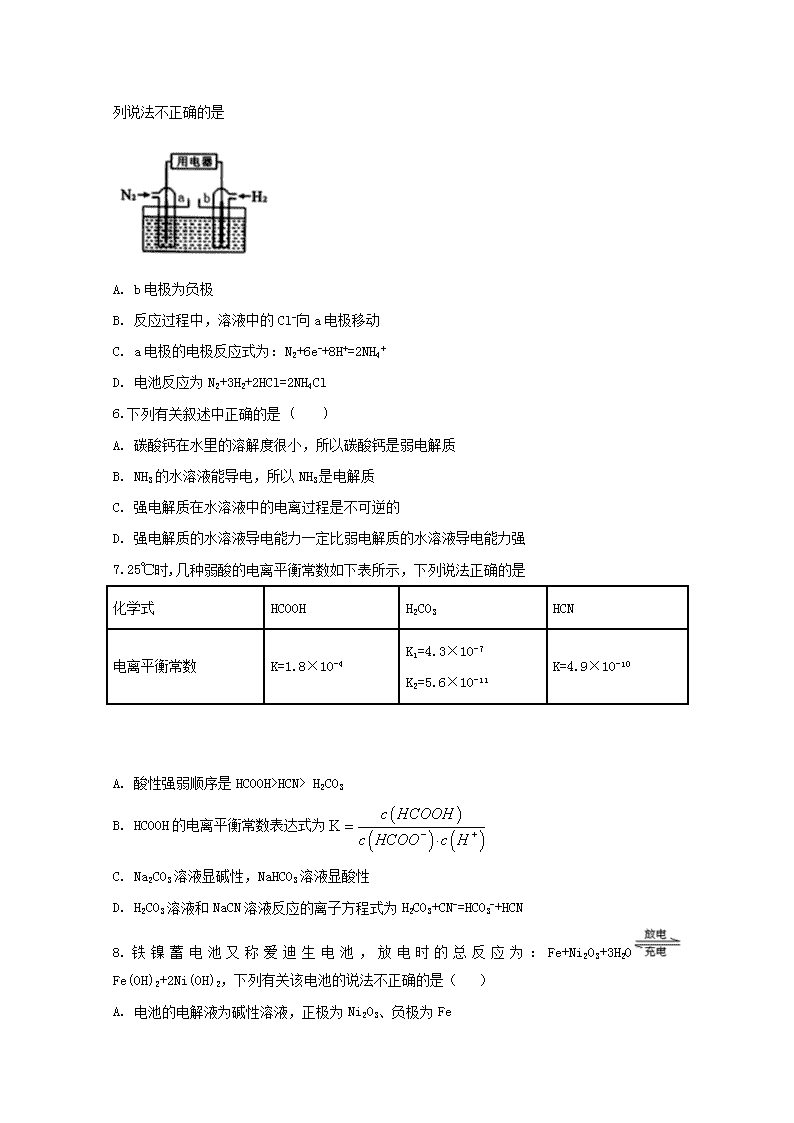
安徽省定远重点中学2018-2019学年度上学期期末考试 高二化学试题 本试卷满分100分,考试时间90分钟。请在答题卷上作答。 第I卷 选择题 (共48分) 一、选择题(本大题共16题,每题3分,满分48分,每小题只有一个正确答案) 1.下列关于钢铁腐蚀的叙述正确的是() A. 钢铁插入水中,水下部分比空气与水交界处更容易腐蚀 B. 钢铁在海水中比在河水中更易腐蚀,主要是由于海水中有大量电解质 C. 钢铁设备上连接铜块可以防止钢铁腐蚀 D. 钢铁设备与外加直流电源的正极相连可以防止钢铁腐蚀 2.下列关于热化学反应的描述中正确的是( ) A. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol B. 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5kJ/mol C. 在中和热的测定实验中,环形玻璃搅拌棒可以用铜质搅拌棒代替。 D. 需要加热才能发生的反应不一定是吸热反应 3.已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13。该温度下,下列说法错误的是 A. AgCl的悬浊液中通入少量HCl,c(Ag+)减小 B. AgCl和AgBr共存的悬浊液中,c(Cl-)/c(Br-)=360 C. AgBr悬浊液中加入足量NaCl可能有AgCl沉淀生成 D. 等浓度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgCl沉淀 4.500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)= 6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( ) A. 原混合溶液中c(K+)为2 mol·L-1 B. 上述电解过程中共转移2 mol电子 C. 电解得到的Cu的物质的量为0. 5 mol D. 电解后溶液中c(H+)为2 mol·L-1 5.以N2和H2为反应物,盐酸酸化的NH4Cl 溶液为电解质的原电池,工作原理如下图所示,下列说法不正确的是 A. b电极为负极 B. 反应过程中,溶液中的Cl-向a电极移动 C. a电极的电极反应式为:N2+6e-+8H+=2NH4+ D. 电池反应为N2+3H2+2HCl=2NH4Cl 6.下列有关叙述中正确的是 ( ) A. 碳酸钙在水里的溶解度很小,所以碳酸钙是弱电解质 B. NH3的水溶液能导电,所以NH3是电解质 C. 强电解质在水溶液中的电离过程是不可逆的 D. 强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 7.25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是 化学式 HCOOH H2CO3 HCN 电离平衡常数 K=1.8×10-4 K1=4.3×10-7 K2=5.6×10-11 K=4.9×10-10 A. 酸性强弱顺序是HCOOH>HCN> H2CO3 B. HCOOH的电离平衡常数表达式为 C. Na2CO3溶液显碱性,NaHCO3溶液显酸性 D. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-=HCO3-+HCN 8.铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( ) A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe B. 电池充电过程中,阴极附近溶液的酸性增强 C. 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O 9.金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,以硫酸镍 溶液为电解液进行粗镍 提纯,下列说法正确的是(已知:氧化性的强弱顺序为Fe2+<Ni2+<Cu2+) A. 阳极首先发生的电极反应是Ni2++2e-=Ni B. 电解过程中,阳极质量的减少与阴极质量的增加相等 C. 电解后,溶液中存在金属阳离子只有Fe2+和Zn2+ D. 电解后,Cu和Pt沉积在电解槽底部形成阳极泥 10.25 ℃时,水的电离达到平衡:H2O H++OH-;ΔH > 0,下列叙述正确的是( ) A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B. 向水中通入HCI气体,pH值减小,KW不变 C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)增大 D. 将水加热,KW增大,pH不变 11.25 ℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是 A. 实验进程中水的电离程度:a>c>b B. c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) C. 向a点所示溶液中通入SO2,溶液的pH减小,漂白性增强 D. 由a点到b点的过程中,溶液中逐渐增大 12.下列有关化学反应与能量的叙述正确的是 A. 化学反应的焓变直接决定了反应进行的方向 B. 放热反应的反应速率总是大于吸热反应的反应速率 C. 应用盖斯定律,可计算某些难以直接测量的反应焓变 D. 同温同压下,H2(g) +Cl2(g) =2HCl(g)在光照和点燃条件下的△H不同 13.在一个不导热的密闭反应器中,只发生两个反应:A(g)+B(g)2C(g) △H < 0 X(g)+3Y(g)2Z(g) △H > 0,进行相关操作且达到平衡,下列叙述正确的是 A. 等压时,通入惰性气体,C的物质的量增大 B. 等压时,通入X气体,反应器中温度不变 C. 等容时,通入惰性气体,各反应速率不变 D. 等容时,通入X气体,Y的物质的量浓度增大 14.已知: 2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g)△H=-226kJ/mol 根据以上热化学方程式判断,下列说法正确的是( ) A. CO 的燃烧热为566kJ/mol B. 上图可表示由CO生成CO2的反应过程和能量关系 C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H<-452 kJ/mol D. CO2(g)与Na2O2(s)反应放出452kJ 热量时,电子转移数为1.204×1024 (个) 15.一定温度下,在某密闭容器中发生反应:2HI(g)H2(g)+I2(s)ΔH >0,若0~15 s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是( ) A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol·L-1·s-1 B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间小于10 s C. 升高温度正反应速率加快,逆反应速率也加快 D. 减小反应体系的体积,正逆反应速率增大程度相等 16.在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表: t/min 0 2 4 6 8 10 V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9 下列叙述不正确的是(溶液体积变化忽略不计) A. 0~6 min的平均反应速率:v(H2O2)≈ 3.3×10﹣2 mol/(L•min) B. 6~10 min的平均反应速率:v(H2O2)< 3.3×10﹣2 mol/(L•min) C. 反应到6 min时,H2O2分解了50% D. 反应到6 min时,c(H2O2)=0.30 mol/L 第II卷 非选择题 (共52分) 二、非选择题(本大题共4小题,满分52分。) 17.将V1mL 1.0 mol.L-1 HC1溶液和V2 ml未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图甲所示(实验中始终保持Vl+V2=50)。回答下列问题: (1)该实验表明此反应__________(填“吸收”或“释放”)能量,即________能可以转化为__________能;做该实验时,环境温度__________(填“高于”、“低于”或“等于”)22℃。 (2)根据图甲计算该NaOH溶液的浓度约是__________mol.L-l。 (3)如图乙所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质: ①烧碱固体 ②浓硫酸 ③硝酸铵固体 ④NaCl固体 其中能使a端液面高于b端液面的是________(填序号)。 18.H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题: (1)定性分析:图甲可通过观察________________定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_______________________。 (2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_______,检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看__________,实验中需要测量的数据是__________。 (3)加入MnO2粉末于H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。 由D到A过程中,随着反应的进行反应速率逐渐_________。(填 “加快”或“减慢”),其变化的原因是_____________。(选填字母编号) A.改变了反应的活化能 B.改变活化分子百分比 C.改变了反应途径 D.改变单位体积内的分子总数 (4)另一小组同学为了研究浓度对反应速率的影响,设计了如下实验设计方案,请帮助完成(所有空均需填满)。 实验编号 T/K 催化剂 浓度 实验1 298 3滴FeCl3溶液 10ml 2%H2O2 实验2 298 ① 在实验2中依次填_______________、________________。 ② 可得到的结论是浓度越大,H2O2 分解速率__________。 19.某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下: ①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上; ②固定好滴定管并使滴定管尖嘴充满液体; ③调节液面至“ 0”或“0”刻度线稍下,并记下读数; ④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液; ⑤用标准液滴定至终点,记下滴定管液面读数; ⑥重复以上滴定操作2-3次; 请回答下列问题: (1)以上步骤有错误的是(填编号)_____________,该错误操作会导致测定结果_________ (填“偏大”、“偏小”或“无影响”)。 (2)步骤④中,量取20.00mL待测液应使用________________ (填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“大”、“偏小”或“无影响”)。 (3)步骤⑤滴定时眼睛应注视_______________________;判断到达滴定终点的依据是_______。 (4)以下是实验数据记录表 滴定次数 盐酸体积(mL) NaOH溶液体积读数(mL) 滴定前 滴定后 1 20.00 0.00 18.10 2 20.00 0.00 16.30 3 20.00 0.00 16.22 从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是(______) A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 B.锥形瓶用待测液润洗 C.NaOH标准液保存时间过长,有部分变质 D.滴定结束时,俯视读数 (5)根据上表记录数据,通过计算可得,该盐酸浓度为____________mol·L-1 (6)室温下,用0.100mol/L NaOH溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是(______) A.Ⅱ表示的是滴定醋酸的曲线 B.pH=7时,滴定醋酸消耗V(NaOH)小于20mL C.V(NaOH) =20mL时,c( Cl- )=c(CH3COO- ) D.V(NaOH) =10mL时,醋酸溶液中:c( Na+ )> c(CH3COO-)> c ( H+ )> c(OH-) 20.某课外小组分别用图中所示装置对原电池和电解原理进行实验探究。 请回答: Ⅰ.用甲图装置进行第一组实验。 (1)在保证电极反应不变的情况下,不能替代Cu作电极的是________(填序号)。 A.铝 B.石墨 C.银 D.铂 (2)N极为_______(填 “正” “负” “阴” “阳”)电极,发生反应的电极反应式为__________。 (3)实验过程中,SO42-________(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有_____。 Ⅱ.用乙图装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料得知,高铁酸根离子(FeO)在溶液中呈紫红色,且需碱性环境才可产生。 (4)电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。 (5)电解过程中,Y极发生的电极反应为_______________和____________________。 (6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。 (7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2。该电池正极发生的反应的电极反应式为__________________________________。 答案 1.B 2.D 3.D 4.A 5.B 6.C 7.D 8.B 9.D 10.B 11.B 12.C 13.C 14.D 15.C 16.D 17.(1)释放;化学;热;低于;(2)1.5;(3)③。 18. 产生气泡的快慢 将FeCl3溶液改为Fe2(SO4)3后与CuSO4对比只有阳离子不同,从而排出Cl-可能带来的干扰 分液漏斗 活塞能否复位 生成40ml气体所需的时间 减慢 D 3滴FeCl3 溶液 10ml 5%H2O2 越大 19. ① 偏大 酸式滴定管 无影响 锥形瓶中溶液颜色的变化 锥形瓶中溶液由无色变为浅红色且半分钟内不变色 AB 0.1626 B 20. A 阴 2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-) 从右向左 滤纸上有红褐色斑点产生(答出“红褐色斑点”或“红褐色沉淀”即可) 增大 Fe-6e-+8OH-=FeO42-+4H2O 4OH--4e-=2H2O+O2↑ 0.28 2FeO42-+6e-+5H2O=Fe2O3+10OH-查看更多