- 2021-08-06 发布 |
- 37.5 KB |
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
吉林省辽源市田家炳高级中学2019-2020学年高二上学期期中考试化学试题
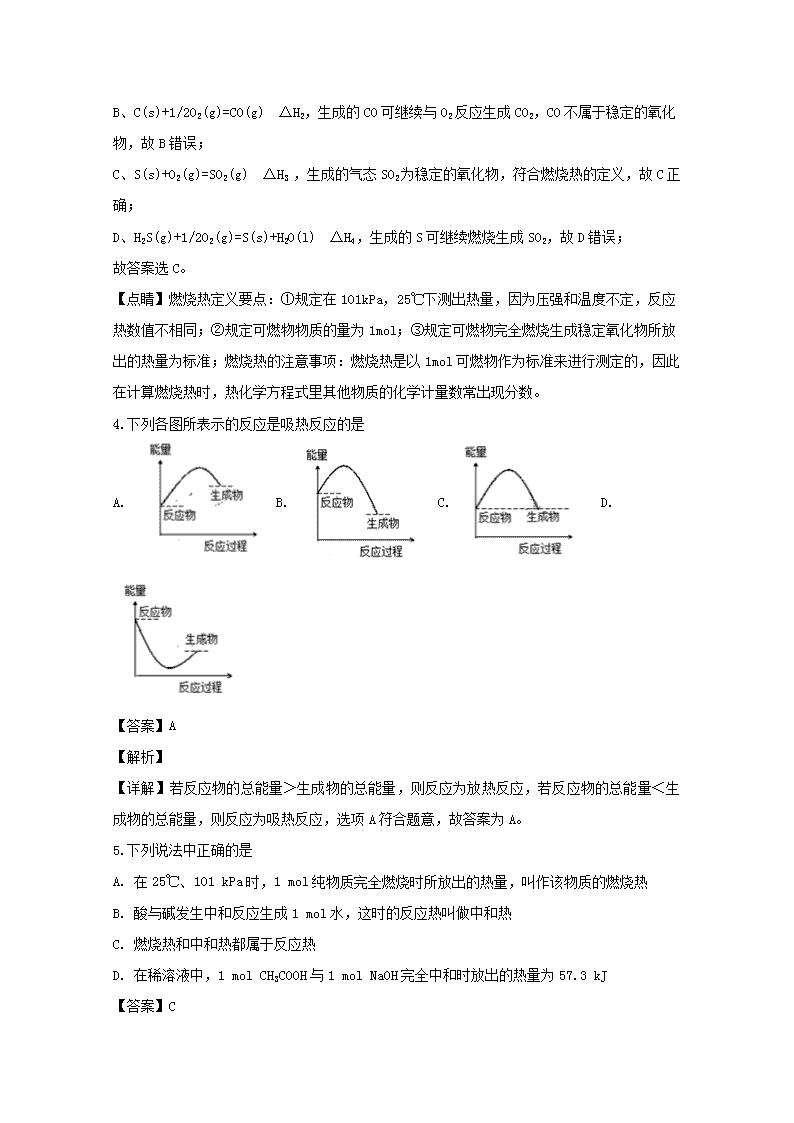
田家炳高中 2019-2020 学年度上学期期中考试高二化学试卷 一、选择题(每小题只有一个选项正确,每题 2 分,共 30 分) 1.下列过程中化学反应速率的增大对人类有益的是( ) A. 金属的腐蚀 B. 食物的腐败 C. 塑料的老化 D. 合成氨 【答案】D 【解析】 【详解】A.金属的腐蚀会造成资源消耗和建筑损毁,则应降低反应速率,故 A 错误;B.食物 腐败使食品的保质缩短,则应降低反应速率,故 B 错误;C.塑料老化会缩短塑料制品的使用 寿命,则应降低反应速率,故 C 错误;D.氨气是人类需要的重要化工原料,则工业合成氨需 要增大反应速率,故 D 正确;答案选 D。 【点睛】本题让学生体会了化学反应速率与日常生活和工业生产等之间的关系。 2.决定化学反应速率的内因是( ) ①温度 ②压强 ③催化剂 ④浓度 ⑤反应物本身的性质 A. ①②③④⑤ B. ⑤ C. ①④ D. ①②③④ 【答案】B 【解析】 【详解】内因是决定化学反应速率的根本原因,即反应物本身的性质是主要因素,而浓度、 温度、压强、催化剂是外界影响因素,⑤正确,故选 B。 【点睛】本题主要考查了影响化学反应速率的内因,注意与外因(浓度、温度、压强、催化 剂)的区别是解答关键。 3.下列燃烧反应的反应热是燃烧热的是: A. H2(g)+1/2 O2(g)=H2O(g) △H1 B. C(s)+1/2 O2(g)=CO(g) △H2 C. S(s)+O2(g)=SO2(g) △H3 D. H2S(g)+1/2O2=S(s)+H2O(l) △H4 【答案】C 【解析】 【分析】 燃烧热的定义:在 25℃,101kPa 时,1mol 可燃性物质完全燃烧生成稳定的化合物时所放出的 热量,叫做该物质的燃烧热;据此进行分析。 【详解】A、H2(g)+1/2O2(g)=H2O(g) △H1,生成的水为气态,不是 25℃,101kPa 下的稳定产 物,故 A 错误; B、C(s)+1/2O2(g)=CO(g) △H2,生成的 CO 可继续与 O2 反应生成 CO2,CO 不属于稳定的氧化物, 故 B 错误; C、S(s)+O2(g)=SO2(g) △H3 ,生成的气态 SO2 为稳定的氧化物,符合燃烧热的定义,故 C 正 确; D、H2S(g)+1/2O2(g)=S(s)+H2O(l) △H4,生成的 S 可继续燃烧生成 SO2,故 D 错误; 故答案选 C。 【点睛】燃烧热定义要点:①规定在 101kPa,25℃下测出热量,因为压强和温度不定,反应 热数值不相同;②规定可燃物物质的量为 1mol;③规定可燃物完全燃烧生成稳定氧化物所放 出的热量为标准;燃烧热的注意事项:燃烧热是以 1mol 可燃物作为标准来进行测定的,因此 在计算燃烧热时,热化学方程式里其他物质的化学计量数常出现分数。 4.下列各图所表示的反应是吸热反应的是 A. B. C. D. 【答案】A 【解析】 【详解】若反应物的总能量>生成物的总能量,则反应为放热反应,若反应物的总能量<生 成物的总能量,则反应为吸热反应,选项 A 符合题意,故答案为 A。 5.下列说法中正确的是 A. 在 25℃、101 kPa 时,1 mol 纯物质完全燃烧时所放出的热量,叫作该物质的燃烧热 B. 酸与碱发生中和反应生成 1 mol 水,这时的反应热叫做中和热 C. 燃烧热和中和热都属于反应热 D. 在稀溶液中,1 mol CH3COOH 与 1 mol NaOH 完全中和时放出的热量为 57.3 kJ 【答案】C 【解析】 【详解】A.在 25℃、101 kPa 时,1 mol 纯物质完全燃烧生成稳定氧化物放出的热量为燃烧 热,产物不一定为稳定氧化物时放出的热量不是燃烧热,A 错误; B.稀溶液中酸与碱反应生成 1 mol 水放出的热量为中和热,若酸为浓硫酸,中和反应生成 1 mol 水,放出的热量多于中和热的数值,B 错误; C.燃烧热、中和热均属于反应热,是反应热的种类之一,C 正确; D.乙酸为弱酸,存在电离平衡,电离吸热,则在稀溶液中,1 mol 乙酸和 1 mol 氢氧化钠完 全中和时放出的热量为小于 57.3 kJ,D 错误; 答案选 C。 【点睛】本题考查反应热与焓变,为高频考点,把握燃烧热、中和热的概念及判断为解答的 关键,侧重分析与应用能力的考查,中和热判断为解答的难点,题目难度不大。 6.一定条件下氨的分解反应 2NH3 N2+3H2 在容积为 2L 的密闭容器内进行,已知起始时氨 气的物质的量为 4mol,5s 末为 2.4mol,则用氨气表示该反应的速率为 A. 0.32 mol·L-1·s-1 B. 0.16 mol·L-1·s-1 C. 1.6 mol·L-1·s-1 D. 0.8 mol·L-1·s-1 【答案】B 【解析】 【分析】 根据 v=△c/△t=△cV△t 计算氨气的平均化学反应速率。 【详解】反应速率通常用单位时间内浓度的变化量来表示。反应进行到 5s 时,消耗氨气的物 质的量是(4mol-2.4mol)=1.6mol,所以用氨气表示的反应速率是(1.6mol/2L)/5s=0.16 mol·L-1·s-1,故选 B。 【点睛】本题考查了化学反应速率的定量表示方法,根据化学反应速率公式计算是解答关键。 7.在一定条件下,在密闭容器中,发生可逆反应 2NO2(g) 2NO(g) +O2(g),达到平衡状 态的标志是: A. 单位时间生成 n mol O2,同时生成 2n mol NO B. 用 NO2、NO、O2 表示反应速率之比为 2:2:1 的状态 C. NO2、NO、O2 的物质的量之比为 2:2:1 的状态 D. 混合气体的颜色不再改变的状态 【答案】D 【解析】 【详解】A.单位时间内生成 n mol O2 的同时生成 2n mol NO,都体现正反应方向,不能判 定反应是否达到平衡状态的标,故 A 错误; B. 只要反应发生就符合 NO2、NO、O2 表示的反应速率数值之比为 2:2:1 的状态,不能确定反 应是否达到平衡状态,故 B 错误; C. 如果按照反应系数比投料,无论反应进行到什么程度,NO2、NO、O2 的物质的量之比都为 2: 2:1,不能确定反应是否达到平衡状态,故 C 错误; D. 混合气体的颜色不再改变的状态,说明二氧化氮的浓度不变,反应达平衡状态,故 D 正确; 故答案选 D。 【点睛】根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物 质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;解题时要注意,选择判断 的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡 状态。 8.下列反应既属于氧化还原反应,又是吸热反应的是: A. 铝片与稀盐酸反应 B. Ba(OH)2·8H2O 与 NH4Cl 反应 C. 灼热的碳与 CO 反应 D. 甲烷在氧气中燃烧 【答案】C 【解析】 【详解】A 项,铝片与稀盐酸属于置换反应,是氧化还原反应,但该反应是放热反应,故不选 A 项; B 项,Ba(OH)2·8H2O 与 NH4Cl 反应是吸热反应,但该反应不是氧化还原反应,故不选 B 项; C 项,C+CO2=2CO,碳的化合价发生变化,是氧化还原反应,同时该反应是吸热反应,故选 C 项; D 项,甲烷在氧气中的燃烧反应是氧化还原反应,但该反应是放热反应,故不选 D 项; 故答案选 C。 9.对于反应 2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是( ) A. 通入大量 O2 B. 增大容器容积 C. 移去部分 SO3 D. 降低体系温度 【答案】A 【解析】 【详解】A. 通入大量 O2,增大了反应物的浓度,化学反应速率增大; B. 增大容器的容积,各组分的浓度减小,化学反应速率减小; C. 移去部分 SO3,减小了生成物的浓度,化学反应速率减小; D. 降低体系温度,化学反应速率减小。 综上所述,能增大正反应速率的措施是 A。 10.对于在一定条件下进行的化学反应 2SO2(g)+O2(g) 2SO3(g),改变下列条件,能提高 反应物中活化分子百分数的是: A. 增大压强 B. 升高温度 C. 降低温度 D. 增大反应 物浓度 【答案】B 【解析】 【详解】A.增大压强,使得单位体积内的活化分子增多,但是没有增加活化分子的百分数, 故 A 错误; B.升高温度,可以使反应物的能量升高,这样会有更多的分子具有的能量超过活化能而成为 活化分子,活化分子百分数增加,故 B 正确; C.降低温度,可以使反应物的能量降低,更多的分子能量低于活化能,活化分子数减小,百 分数也减小,故 C 错误; D.增大反应物浓度,活化分子数增多,但是活化分子百分数不变,故 D 错误; 故答案为 B。 【点睛】在其它条件下不变的情况下,增大浓度、加压缩小体积,都能够增加活化分子数, 但是活化分子的百分数不变;升高温度,使用催化剂,既能增加活化分子数,又能增加活化 分子百分数。 11.可逆反应 m A(s)+ n B(g) x C(g)+y D(g),达到平衡后,下列条件的改变能够改变 反应速率,同时一定能使平衡发生移动的是: A. 温度 B. 催化剂 C. 压强 D. 浓度 【答案】A 【解析】 【详解】如 n=x+y,增大或减小压强,此时平衡不移动;如果容器的体积和温度不变,如 n=x+y, 在原平衡的基础上,同比例增大 C、D 的浓度,等效于加压过程,但是平衡不移动;加入催化 剂,同等程度改变正逆反应速率,平衡不移动;升高温度,反应速率增大,平衡向吸热方向 移动,降低温度,反应速率减小,平衡向放热方向移动;故 A 正确; 故答案选 A。 【点睛】针对 X(g)+Y(g) 2Z(g) △H<0,反应,如果反应达到平衡后,在等温等容条件 下,再充入 2molZ,等效于给该反应加压过程,由于反应前后气体的体积不变,所以平衡不移 动;如果反应达到平衡后,在等温等压条件下,再充入 2molZ,等效于等压过程,与原平衡等 效。 12.“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的并已加工好的真空包装 食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线使这两种物质反应, 放出的热量便可对食物进行加热,这两包化学物质最合适的选择是: A. 浓硫酸和水 B. 生石灰和水 C. 熟石灰和水 D. 烧碱和水 【答案】B 【解析】 【详解】A 项,浓硫酸与水混合时会放出大量的热,但浓硫酸具有极强的腐蚀性,且是液态物 质,使用不便,故 A 项错误; B 项,生石灰与水反应时会放出大量的热,能达到加热的效果,故 B 项正确; C 项,熟石灰溶于水时会放热,但其溶解度很小,所以放出的热量有限,不能达到加热的效果, 故 C 项错误; D 项,烧碱溶于水,会放出大量的热,但是氢氧化钠具有强烈的腐蚀性,不能使用,故 D 项错 误; 故答案为 B。 13.对于在一个密闭容器中进行的反应 C(s)+H2O(g) CO(g)+H2(g),下列条件的改变对反 应速率几乎没有影响的是 ①增加 C 的量; ②增加 CO 的量; ③将容器的体积缩小一半; ④保持体积不变,充入 He 以增大压强; ⑤升高反应体系的温度; ⑥保持压强不变,充入 He 以增大体积。 A. ②③ B. ①④ C. ①⑥ D. ④⑥ 【答案】B 【解析】 【分析】 该反应是一个有固体参与的气体体积增大的反应,改变温度、压强、反应物或生成物浓度, 化学反应速率改变,固体量的增减、反应体系中的各物质的浓度不变,反应速率不变。 【详解】①C 为纯固体,固体量的增减不影响反应速率,所以增加 C(s)的量,反应速率不 变,故①正确; ②增加 CO 的量,CO 浓度增大,反应速率加快,故②错误; ③将容器的体积缩小一半,反应体系中物质的浓度增大,容器中压强增大,反应速率加快, 平衡向气体体积减小的方向进行,故③错误; ④保持体积不变,充入氮气,氮气不参与反应,反应体系中的各物质的浓度不变,则反应速 率不变,故④正确; ⑤升高反应体系的温度,反应速率加快,反应向吸热反应方向进行,故⑤错误; ⑥保持压强不变,充入氮气,使容器的体积变大,反应体系中各物质的浓度减小,则反应速 率减小,故⑥; 符合题意得为①④,故选 B。 【点睛】本题考查了化学平衡影响因素,利用化学反应速率影响因素分析解答是关键。 14.下列热化学方程式书写正确的是: A. 2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1 B. H2(g)+ 1 2 O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1 C. 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ D. C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1 【答案】B 【解析】 【详解】A 项,没有标明物质的状态,故 A 项错误; B 项,表示氢气燃烧热的热化学方程式为 H2(g)+ 1/2O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1,故 B 项正确; C 项,反应热的单位是 kJ·mol-1,故 C 项错误; D 项,燃烧均为放热反应,该反应为放热反应,ΔH<0,故 D 项错误; 故答案为 B。 15.一定温度下,对可逆反应 A(g)+2B(g) 3C(g)的下列叙述中,能说明反应已达到平衡的 是( ) A. C 生成的速率与 C 分解的速率相等 B. 单位时间内消耗 amolA,同时生成 3amolC C. 容器内的压强不再变化 D. 混合气体的物质的量不再变化 【答案】A 【解析】 A. C 生成的速率与 C 分解的速率相等,说明正逆反应速率相等达到平衡状态,故 A 不选; B. 单位时间内消耗 a mol A,同时生成 3a mol C,都体现正反应方向,未体现正与逆的关系, 故 B 选; C. 方程式两端化学计量数不相等,则容器内的压强将随平衡的移动而变化,压强不再变化, 说明反应达到平衡状态,故 C 不选; D. 方程式两端化学计量数不相等,则容器内气体的物质的量将随平衡的移动而变化,混合气 体的物质的量不再变化,说明正逆反应速率相等,达平衡状态,故 D 不选; 故答案选 B。 【名师点睛】本题考查了化学平衡状态的判断。注意反应达到平衡状态时,正逆反应速率相 等,必须是同一物质的正逆反应速率相等;反应达到平衡状态时,平衡时各种物质的物质的 量、浓度等不再发生变化,此类试题中容易发生错误的情况往往有:平衡时浓度不变 ,不是 表示浓度之间有特定的大小关系;正逆反应速率相等,不表示是数值大小相等;对于密度、 相对分子质量等是否不变,要具体情况具体分析等。 二、选择题(每小题只有一个选项正确,每题 3 分,共 30 分) 16.一定条件下,可逆反应 2A B+3C,在下列四种状态中,处于平衡状态的是( ) 选项 正反应速率 逆反应速率 A vA=2 mol·L-1·min-1 vB=2 mol·L-1·min-1 B vA=2 mol·L-1·min-1 vC=2 mol·L-1·min-1 C vA=1 mol·L-1·min-1 vB=2 mol·L-1·min-1 D vA=1 mol·L-1·min-1 vC=1.5 mol·L-1·min-1 A. A B. B C. C D. D 【答案】D 【解析】 【分析】 化学反应到达平衡时,同一物质的正逆反应速率相等,据此分析解答。 【详解】A.A 物质的正反应速率υA=2mol/(l·min),逆反应速率υB=2mol/(l·min),则 逆反应速率υA=4mol/(l·min),A 的正逆反应速率不相等,所以该反应未达到平衡状态,故 A 错误; B.同一反应中,各物质的反应速率之比等于计量数之比,A 物质的正反应速率是 2mol/ (L·min),C 的逆反应速率为 2mol/(L·min),A 的逆反应速率为 3 4 mol/(L·min),所以 A 的正逆反应速率不等,故 B 错误; C.同一反应中,各物质的反应速率之比等于计量数之比,A 物质的正反应速率是 1 mol/ (L·min),B 的逆反应速率为 2mol/(L·min),A 的逆反应速率为 4mol/(L·min),所以 A 的正逆反应速率不等,故 C 错误; D.同一反应中,各物质的反应速率之比等于计量数之比,A 物质的正反应速率是 1 mol/ (L·min),C 的逆反应速率为 1.5mol/(L·min),A 的逆反应速率为 1mol/(L·min),所以 A 的正逆反应速率相等,故 D 正确; 答案选 D。 17.在 2A(g)+B(g) 3C(g)+4D(g)中,表示该反应速率最快的是: A. V(A)=0.5mol·L-1·s-1 B. V(B)=0.3mol·L-1·s-1 C. V(C)=0.8mol·L-1·s-1 D. V(D)=1mol·L-1·s-1 【答案】B 【解析】 【分析】 根据化学反应速率之比等于化学计量数之比,把用不同物质表示的反应速率换算成用同一物 质表示的化学反应速率,然后比较大小。 【详解】在 2A(g)+B(g) 3C(g)+4D(g)反应中都换成 B 的速率进行比较; A、V(A):V(B)=2:1,V(B)=0.5mol·L-1·s-1/2=0.25 mol·L-1·s-1; B、V(B)=0.3mol·L-1·s-1; C、V(B):V(C)=1:3,V(B)=0.8mol·L-1·s-1/3=0.27mol·L-1·s-1; D、V(B):V(D)=1:4,V(B)=1mol·L-1·s-1/4=0.25 mol·L-1·s-1; 比较可以知道,B 表示的反应速率最块,故 B 正确;故答案选 B。 18.设 C+CO2 2CO △H>0,反应速率为 V1,N2+3H2 2NH3 △H<0,反应速率为 V2, 当温度升高时,速率变化情况为: A. V1 增大,V2 减小 B. V1、V2 都增大 C. V1 减小,V2 增大 D. V1、V2 都减小 【答案】B 【解析】 【详解】升高温度,使分子获得更高的能量,活化分子百分数提高,另外含有较高能量的分 子间的碰撞率也随之提高,所以不论是吸热反应还是放热反应,化学反应速率均增大,故 B 项正确。 故答案选 B。 19.在恒温恒容容器中发生 N2O4(g)⇌ 2NO2(g),若反应物的浓度由 0.1mol•L﹣1 降到 0.06mol•L ﹣1 需 20s,那么由 0.06mol•L﹣1 降到 0.036mol•L﹣1,所需反应时间为( ) A. 10 s B. 12 s C. 大于 12 s D. 小于 12 s 【答案】C 【解析】 【详解】反应物的浓度由 0.1mol•L-1 降到 0.06mol•L-1 需 20s,即反应物的浓度变化为 0.1-0.06=0.04mol•L-1,反应物的浓度由 0.06mol•L-1 降到 0.036mol•L-,即反应物的浓度变化 为 0.06-0.036=0.024mol•L-1,若反应速率不变,则所需时间为 0.024 0.04 =12s,但随着浓度的减 小,反应速率逐渐减小,故所需时间大于 12s,故选 C。 20.已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1 H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 下列说法正确的是: A. H2 的燃烧热为 571.6kJ·mol-1 B. H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)ΔH=-57.3kJ·mol-1 C. 同质量的 H2(g)和 CH3OH(l)完全燃烧,H2(g)放出的热量多 D. 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9kJ·mol-1 【答案】C 【解析】 【详解】A.根据 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 可以知道 1mol 氢气燃烧生 成 1mol 液态水放出热量为 285.8 kJ·mol-1,则氢气燃烧热为 285.8 kJ ∙mol-1,故 A 错误; B.反应中有 BaSO4 生成,而生成 BaSO4 也是放热的,所以放出的热量比 57.3 kJ 多,即该反应 的ΔH<-57.3kJ·mol-1;故 B 错误; C.令 H2(g)和 CH3OH(l)的质量都为 4g,则 4g 氢气燃烧放热为 571.6 kJ;4g CH3OH(l)燃烧放热 为 4/32×1/2×1452 kJ=90.75 kJ;所以 H2(g)放出的热量多,故 C 正确; D.①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1;②2CH3OH(l)+3O2(g)=2CO2(g)+ 4H2O(l) ΔH=-1452 kJ·mol-1;按盖斯定律计算①×3-②得到:6H2(g)+2CO2(g)=2CH3OH(l) +2H2O(l) ΔH=-262.8kJ·mol-1;则正确的热化学方程式是 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=-131.4kJ·mol-1,故 D 错误; 故答案选 C。 21.下列方法对 2SO2(g)+O2(g) 2SO3(g)的反应速率没有影响的是 A. 加入 SO3 B. 容积不变,充入 N2 C. 压强不变,充入 N2 D. 降低温度 【答案】B 【解析】 【详解】A 选项,加入 SO3,生成物浓度增大,反应速率增大,故 A 错误;B 选项,容积不变, 充入 N2,反应体系中各物质浓度不变,则反应速率不变,故 B 正确;C 选项,压强不变,充入 N2,反应体系的体积增大,相当于压强减小,则反应速率减小,故 C 错误;D 选项,降低温度, 反应速率减小,故 D 错误;故选 B。 【点睛】本题考查影响化学反应速率的因素,把握常见的影响速率的因素为解答的关键。本 题的易错点为 C,要注意压强不变时充入与平衡无关的气体会造成容器的体积增大,反应物的 浓度减小。 22.X(g)+3Y(g) 2Z(g) ΔH=-a kJ·molˉ1 ,一定条件下,将 1 mol X 和 3 mol Y 通 入 2L 的恒容密闭容器中,反应 10min,测得 Y 的物质的量为 2.4 mol。下列说法正确的是( ) A. 10min 内,消耗 0.2 mol X,生成 0.4 mol Z B. 第 10min 时,X 的反应速率为 0.01 mol·Lˉ1·minˉ1 C. 10min 内,Y 的平均反应速率为 0.03 mol·Lˉ1·sˉ1 D. 10min 内,X 和 Y 反应放出的热量为 a kJ 【答案】A 【解析】 【分析】 用“三行式”解题,注意平均速率与瞬时速率的差别,正确理解可逆反应热化学方程式的含 义。 【详解】 X(g)+3Y(g) 2Z(g) ΔH=-a kJ·molˉ1 起始/mol: 1 3 0 转化/mol: 0.2 0.6 0.4 10min/mol: 0.8 2.4 0.4 A. 上述数据说明,10min 内消耗 0.2 mol X、生成 0.4 mol Z,A 项正确; B. 10min 内,X 的平均反应速率为 0.2mol/(2L×10min)=0.01 mol·Lˉ1·minˉ1,不是第 10min 时的瞬时反应速率,B 项错误; C. 10min 内,Y 的平均反应速率 v(Y)=3v(X)=0.03 mol·Lˉ1·minˉ1=0.0005mol·Lˉ1·sˉ1,C 项错误; D. 题中热化学方程式表明,1molX 与 3molY 完全反应生成 2molZ 时放热 akJ。10min 内,有 0.2molX 和 0.6molY 发生反应,故放热 0.2a kJ,D 项错误。 本题选 A。 【点睛】可逆反应的热化学方程式中,ΔH 是反应完全的数值,而不是化平衡时的数据。 23.氧气(O2)和臭氧(O3)是氧元素的两种同素异形体,已知热化学方程式:则△H1、△H2、 △H3 的关系正确的是 4Al(s)+3O2(g)═2Al2O3(s)△H1① 4Al(s)+2O3(g)═2Al2O3(s)△H2② 3O2(g)═2O3(g)△H3③ A. △H1﹣△H2=△H3 B. △H1+△H2=△H3 C. △H2﹣△H1=△H3 D. △H1+△H2+△H3=0 【答案】A 【解析】 【详解】4Al(s)+3O2(g)═2Al2O3(s)△H1①,4Al(s)+2O3(g)═2Al2O3(s)△H2②; 根据盖斯定律可以知道,反应①-②,可得 3O2(g)═2O3(g)△H3③,所以△H1﹣△H2=△H3 , A 正确; 综上所述,本题选 A。 24.下列依据热化学方程式得出的结论正确的是 A. 已知 2SO2(g)+O2(g) 2SO3(g)为放热反应,则 SO2 的能量一定高于 SO3 的能量 B. 若 C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定 C. 已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则 20.0 g NaOH 固 体与稀盐酸完全中和,放出 28.7 kJ 的热量 D. 已知 2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 【答案】B 【解析】 【详解】A.已知 2SO2(g)+O2(g) 2SO3(g)为放热反应,则 2molSO2(g)和 1molO2(g)的能量一 定高于 2molSO3(g)的能量,但 SO2 的能量不一定高于 SO3 的能量,A 错误; B.若 C(石墨,s)=C(金刚石,s) ΔH>0,则石墨含有的能量比等质量的金刚石的能量低,物 质含有的能量越低,物质的稳定性就越强,所以石墨比金刚石稳定,B 正确; C.已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,20.0 g NaOH 的物质 的量是 0.5mol,由于 NaOH 固体溶于水反应放出热量,所以 20.0 g NaOH 固体与稀盐酸完全中 和,放出的热量大于 28.7 kJ,C 错误; D.等质量的 C 完全燃烧放出的热量大于不完全燃烧放出的热量,物质反应放出的热量越多, 则反应热就越小,所以ΔH1<ΔH2,D 错误; 故合理选项是 B。 25.N2H4 是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出 133.5 kJ 热量。则下列热化学方程式中正确的是( ) A. 1/2N2H4(g)+1/2O2(g)===1/2N2(g)+H2O(g) ΔH=+267 kJ·mol-1 B. N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 C. N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1 D. N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1 【答案】B 【解析】 【分析】 根据热化学方程式的意义以及热化学方程式的书写方法可以知道,书写热化学方程式时应标 注物质的聚集状态,放热反应的反应热为负值,化学计量数要和反应热成比例,据此解答。 【详解】A、0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出热量 133.5 kJ,则 0.5 mol N2H4(g)完全燃烧生成氮气和气态水时,放出热量 267 kJ;放热反应其焓变是负值,故 A 错误; B、0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出热量 133.5 kJ,则 0.5 mol N2H4(g) 完全燃烧生成氮气和气态水时,放出热量 267 kJ;则 1mol N2H4(g)完全燃烧生成氮气和气态 水时,放出 267 kJ×2=534 kJ 的热量,此时水应为气体,故 B 正确; C、N2H4(g)完全燃烧生成氮气和气态水时,放出热量,其焓变是负值,故 C 错误; D、选项中生成液态水,所以放出热量数值大于 534 kJ,即ΔH<-534 kJ·mol-1;故 D 错误; 故答案选 B。 三、填空题 26. 已知下列热化学方程式: ①H2(g)+ 1 2 O2(g)=H2O(l)ΔH=-285.8 kJ/mol ②H2(g)+ 1 2 O2(g)=H2O(g) ΔH=-241.8 kJ/mol ③C(s)+ 1 2 O2(g)=CO(g)ΔH=-110.5 kJ/mol ④C(s)+O2(g)=CO2(g)ΔH=-393.5 kJ/mol 回答下列问题: (1)上述反应中属于放热反应的是 。 (2)H2 的燃烧热为 ,C 的燃烧热为 。 (3)燃烧 10 g H2 生成液态水,放出的热量为 。 (4)CO 的燃烧热为 ,其热化学方程式为 。 【答案】(1)①②③④ (2)285.8 kJ/mol 393.5 kJ/mol (3)1 429.0 kJ (4)283.0 kJ/mol CO(g)+ 1 2 O2(g)=CO2(g) ΔH=-283.0 kJ/mol 【解析】 (1)所有燃烧均为放热反应,故①②③④均为放热反应。 (2)燃烧热为 1 mol 纯物质完全燃烧生成稳定氧化物时放出的热量,H2 的燃烧热为 285.8 kJ/mol,C 的燃烧热为 393.5 kJ/mol。 (3)Q 放= 10 2 / g g mol ×285.8 kJ/mol=1 429.0 kJ。 (4)由④-③可得,CO(g)+ 1 2 O2(g)=CO2(g)ΔH=-393.5+110.5=-283.0(kJ/mol), 故 CO 的燃烧热为 283.0 kJ/mol。 27.在一定条件下,x A + y B z C 的反应达到平衡。 (1)已知 A、B、C 都是气体,在减压后平衡向逆反应方向移动,则 x、y、z 之间的关系是_______。 (2)加热后 C 的质量分数减少,正反应是___________________反应。(填“吸热”或“放热”) 【答案】 (1). x+y>z (2). 放热 【解析】 【分析】 (1)减压后平衡向着气体系数和增大的方向移动; (2) 若升高温度 C 的质量分数减少,平衡向吸热方向即逆反应方向移动。 【详解】(1)减压后平衡向逆反应方向移动,平衡向气体体积增大的方向移动,若 A、B、C 都 是气体,应存在 x+y>z; 答案是: x+y>z; (2)若升高温度 C 的质量分数减少,说明平衡向逆反应方向移动,则正反应为放热反应; 答案是:放热。 28.一定温度下,反应 3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),在一密闭容器中进行达 平衡后,试回答: (1)增加 Fe 的物质的量,其正反应速率___________。 (A.变快 B.不变 C 变慢,填字母代号)。 (2)将容器的体积缩小一半,其正反应速率___________ ,逆反应速率___________。 (3)若保持体积不变,充入 Ar,其逆反应速率___________。 (4)保持压强不变,充入 Ar,其正反应速率 ___________。 【答案】 (1). B (2). A (3). A (4). B (5). C 【解析】 【分析】 根据影响化学反应的速率的外界因素进行分析。 【详解】(1)往反应中加入固体物质,不会影响化学反应的速率,因铁是固体,增加铁的量, 没有增加铁的浓度,所以不能改变反应速率,正反应速率不变,故 B 正确; (2)容器的体积缩小,等价于将整个反应体系的压强增大了一倍,容器内各物质的浓度都增 大,浓度越大,化学反应速率越快,正逆反应速率均加快,故 A 正确; (3)保持体积不变,充入 Ar 使体系总压强增大,但 Ar 不参加反应,容器内各物质的浓度没 有改变,所以反应速率不变,故 B 正确; (4)保持压强不变,充入 Ar 使容器体积增大,压强虽然不变,但各物质的浓度减小,所以 化学反应速率会减小,故 C 正确; 故答案选 (1)B;(2)A,A;(3)B;(4)C。 【点睛】针对有气体参与的可逆反应,如果反应达到平衡后,在等温等容条件下,再充入和 反应无关的气体,各物质浓度不变,速率不变;在等温等压条件下,充入和反应无关的气体, 等效于减压过程,各物质浓度减小,速率减慢。 29.反应 A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。 (1)该反应是___________反应(填“吸热”“放热”)。 (2)当反应达到平衡时,升高温度,A 的转化率______(填“增大”、“减小”或“不变”), 原因_____。 (3)反应体系中加入催化剂对反应热是否有影响?_________ 【答案】 (1). 放热 (2). 减小 (3). 因为正反应放热,升温平衡逆向移动,所以 A 的转化率减小 (4). 无 【解析】 【详解】(1)由反应过程中的能量变化图可以知道,反应物的总能量高于生成物的总能量,故 反应为放热反应; (2)该反应正反应是放热反应,升高温度平衡向逆反应移动,A 的转化率减小; (3)加入催化剂改变了反应的途径,降低反应所需的活化能,但催化剂不改变反应物总能量与 生成物总能量之差即反应热不变,所以对该反应的反应热无影响。 30.t℃时,将 3mol A 和 2mol B 气体通入体积为 2L 的密闭容器中(容积不变),发生反应: 3A(g) + xB(g) C(g),4min 时反应达到平衡状态(温度不变),剩余 0.4 mol B,并测得 C 的浓度为 0.4mol/L。请填写下列空白: (1)x=_________。 (2)用 A 表示该反应的速率为____________________mol/(L·min)。 (3)若继续向平衡混合物的容器中通入少量氦气(氦气和 A、B、C 都不反应)后,下列说法 中正确的是______________________(填写下列选项字母符号)。 A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动 C.化学平衡不会发生移动 D.正、逆反应的化学反应速率将发生同等程度的改变 【答案】 (1). 2 (2). 0.3 (3). C 【解析】 【分析】 据三段式解题法,求出反应混合物各组分的物质的量的变化量、平衡时组分的物质的量;平 衡时,C 的物质的量为 0.4mol/L×2L=0.8mol; 3A(g) + xB(g) C(g) 开始 3 2 0 变化 2.4 0.8x 0.8 平衡 0.6 0.4 0.8 据以上分析解答问题。 【详解】据三段式解题法,求出反应混合物各组分的物质的量的变化量、平衡时组分的物质 的量;平衡时,C 的物质的量为 0.4mol/L×2L=0.8mol; 3A(g) + xB(g) C(g) 开始 3 2 0 变化 2.4 0.8x 0.8 平衡 0.6 0.4 0.8 (1)根据以上分析可知,2-0.8x=0.4,x=2; (2)用 A 表示该反应的速率为[2.4mol/2L]÷4min=0.3 mol/(L·min); (3)恒容容器中,向容器中通入少量氦气,总压增大,分压不变,不影响反应混合物各组分的 浓度,正逆反应速率不变,平衡不移动,故选 C。查看更多