化学卷·2019届四川省南充高级中学高二上学期期中考试(2017
四川省南充高级中学2017-2018学年高二上学期期中考试
化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷44分,第Ⅱ卷56分,共100分,考试时间为120分钟。
第Ⅰ卷(选择题44分)
一、选择题(每题2分,共44分)
1. 可逆反应在一定条件下达到化学平衡状态的标志是
A.反应停止了
B.正反应速率与逆反应速率均为零
C.反应物和生成物浓度相等
D.正反应速率与逆反应速率相等
2.据报道,某国一集团拟在太空建造巨大的激光装置,把太阳光变成激光用于分解海水制氢:
2H2O2H2↑+O2↑下列说法正确的是
①水的分解反应是放热反应 ②氢气是一级能源 ③使用氢气作燃料有助于控制温室效应
④若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可以改善生存环境
A.①② B.②③ C.①③ D.③④
3.已知反应4NH3+5O24NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(H2O)、v(NO) [mol/ (L·min)]来表示,则下列关系正确的是
A.v(NH3) =v(O2) B.v (O2) =v(H2O)
C.v(NH3)=v(H2O) D.v(O2) =v(NO)
4.下列说法正确的是
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl是非电解质
B.NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2均是电解质
C.蔗糖、酒精在液态或水溶液里均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
5.已知:2H2(g)+O2(g)=2H2O(g) △H=-270kJ·mol-1,下列说法错误的是
A.2mol水蒸气分解成2mol氢气与lmol氧气吸收270kJ热量
B.2mol氢气与lmol氧气反应生成2mol液态水放出热量大于270kJ
C.在相同条件下,2mol氢气与lmol氧气的能量总和大于2mol水蒸气的能量
D.2个氢气分子与1个氧气分子反应生成2个水蒸气分子放出270kJ热量
6.下列事实一定能证明HNO2是弱电解质的是
A.用HNO2溶液做导电实验,灯泡很暗; B.0.1mol/LHNO2溶液的pH=2.1
C.HNO2不是离子化物,而是共价化合物 D.HNO2和NaCl不能发生反应
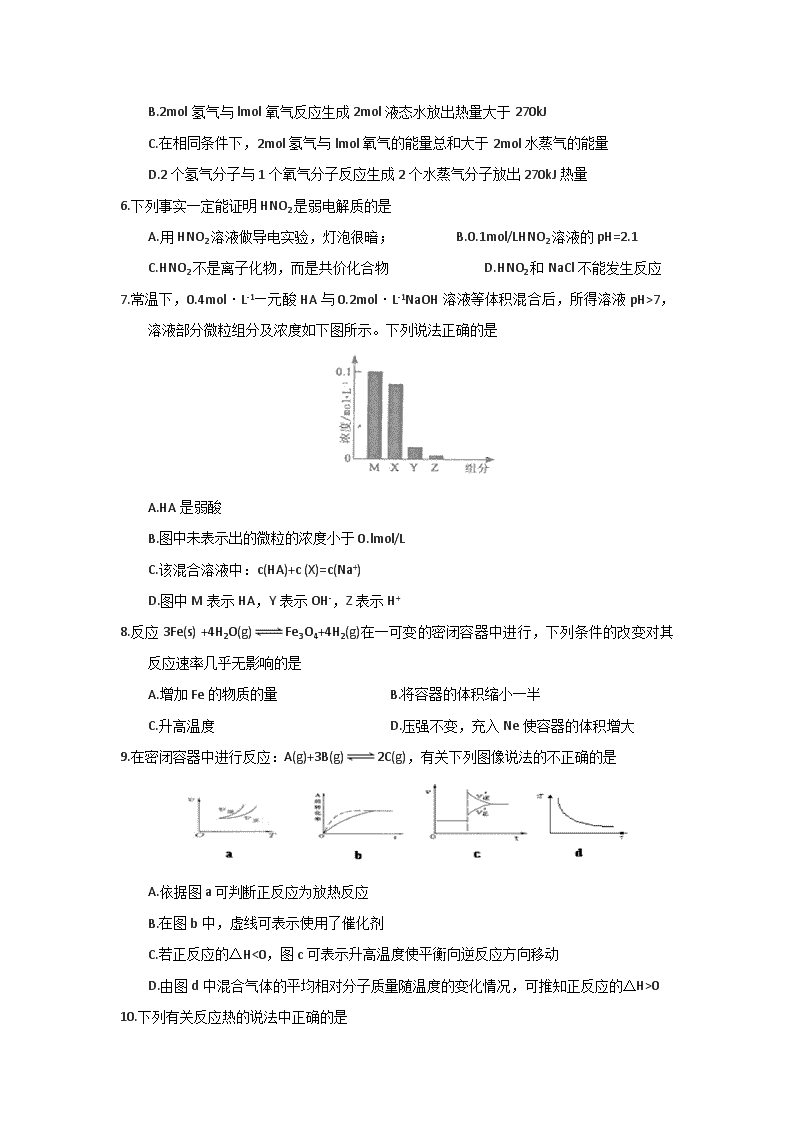
7.常温下,0.4mol·L-1—元酸HA与0.2mol·L-1NaOH溶液等体积混合后,所得溶液pH>7,溶液部分微粒组分及浓度如下图所示。下列说法正确的是
A.HA是弱酸
B.图中未表示出的微粒的浓度小于0.lmol/L
C.该混合溶液中:c(HA)+c (X)=c(Na+)
D.图中M表示HA,Y表示OH-,Z表示H+
8.反应3Fe(s) +4H2O(g)Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.增加Fe的物质的量 B.将容器的体积缩小一半
C.升高温度 D.压强不变,充入Ne使容器的体积增大
9.在密闭容器中进行反应:A(g)+3B(g)2C(g),有关下列图像说法的不正确的是
A.依据图a可判断正反应为放热反应
B.在图b中,虚线可表示使用了催化剂
C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0
10.下列有关反应热的说法中正确的是
A.—个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系
B.中和热△H=-57.3 kJ·mol-1,所以 1.00 L 1.00 mol·L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3 kJ的热量
C.用等体积的0.50 mol·L-1盐酸、0.55 mol·L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大
D.在101 kPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热
11.下列四种溶液中:①pH值为0的盐酸;②0.lmol/L的盐酸;③0.01mol/L的氢氧化钠溶液;④pH值为11的氢氧化钠溶液。由水电离生成的c(H+)之比依次为
A.0:1: 12:11 B.14:13:12:11
C.14:13:2:3 D.1:10:100:1000
12.己知c(NH4Cl)≤0.1mol/L时,溶液pH>5.1。现用0.1 mol/L盐酸滴定10mL0.05 mol/L氨水,用甲基橙作指示剂,达到滴定终点,所用盐酸的体积为
A.10mL B.5mL C.大于5 mL D.小于5 mL
13.心脏起搏器电源一锂碘电池的电池反应为:2Li(s)+I2(s)=2LiI(s) △H
己知:4Li(s)+O2(g)=2Li2O(s) △H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
则下列说法正确的是
A.△H=△H1-△H2 B.△H=△H1+△H2
C.△H=△H1-△H2 D.△H=△H1-△H2
14. 准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.l000mol·L-1NaOH溶液滴定,下列说法正确的是
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
15.反应CO2(g)+2NH3(g)CO(NH2)2(s)+H2O(g) △H<0,达到平衡时,下列说法正确的是
A.加入催化剂,平衡常数不变
B.减小容器体积,正、逆反应速率均减小
C.保持容积不变,增大CO2的量,NH3的转化率减小
D.降低温度,平衡向逆反应方向移动
16.在一个固定容积的密闭容器中充入3 mol NO2,—定温度下建立如下平衡:2NO2N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
A.x>y B.x
10Vb B.Vb=10Va C.Vb<10Va D.Vb>10Va
20.提纯含有少量Ba(NO3)2杂质的KNO3溶液,可以使用的方法为
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
21.—定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示
则下列说法错误的是
A.醋酸的电离程度:a2P乙
B.SO3的质量m:m甲=m丙>2m乙
C.c(SO2)与c(O2)之比 k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
第Ⅱ卷(非选择题共56分)
二、实验题
23. (6分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol·L-1盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
实验用品
溶液温度
中和热△H
t1
t2
①
50mL0.55mol·L-1NaOH
50mL.0.5mol·L-1HCl
20℃
23.3℃
②
50mL0.55mol·L-1NaOH
50mL.0.5mol·L-1HCl
20℃
23.5℃
(2)他们记录的实验数据如下:
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18kJ·℃-1,各物质的密度均为
lg·cm-3。
计算完成上表。△H=
(3)某研究小组将V1mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2 =50mL)。此反应所用NaOH溶液的浓度应为 mol/L。
24.(6分)用中和滴定法测定某盐酸的物质的量浓度。
(1)标准溶液应盛于 (填“A”或“B”)滴定管中。
(2)若选用酚酞作指示剂,以0.1250 mol·L-1的标准氢氧化钠溶液滴定,如何判断滴定终点 。
(3)实验数据记录如下表,请分析数据并计算,盐酸的物质的量浓度= mol·L-1。
滴定次数
待测溶液体积/mL
标准碱液
滴定前读数/mL
滴定后读数/mL
1
20.00
0.00
16.02
2
20.00
0.00
15.98
3
20.00
0.00
16.00
三、填空题
25. (10分)SO2的催化氧化是工业制取硫酸的关键步骤之一,该反应的化学方程式为:2SO2+O2
2SO3,
△H<0。
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 (填字母)。
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的
是 (填字母)。
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.降低温度
(3)将0.050 mol SO2 (g)和0.030 mol O2 (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(SO3) =0.040mol/L。计算该条件下反应的平衡常数K和SO2的转化率(不必写出计算过程)。
①平衡常数K= ;
②平衡时,SO2的转化率α (SO2) = 。
(4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3。己知NaHSO3溶液同时存在以下两种平衡:①HSO3-SO32-+H+ ②HSO3-+H2OH2SO3+OH-、常温下,0.1 mol/LNaHSO3溶液的 pH<7,则该溶液中 c (H2SO3) c (SO32-)(填“>”或“=”或“<”下同)。
26. (4分)反应A (g)+B (s)C(g); ΔH<0,在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”、“ 减慢”或“不变”)。
(1)升温 ;
(2)加正催化剂 ;
(3)增大容器容积 ;
(4)加入C 。
27.(10分)氯化硫酰(SO2C12)主要用作氯化剂。它是一种无色液体,熔点-54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+C12(g)SO2C12 (l) △H=-97.3kJ/mol
(1)试写出常温常压下化学平衡常数K的表达式:K= ;
若在此条件下,将化学平衡常数K增大,化学反应速率V正也增大,可采取的措施是 (选填编号)。
a.降低温度 b.移走SO2C12
c.增加反应物浓度 d.以上都不对
(2)为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (选选填编号)。
a.缩小容器体积 b.使用催化剂
c.增加SO2浓度 d.升高温度
(3)在100℃时,往上述平衡体系中加入37C12,—段时间后,则平衡体系中含有37C1的物质有 (选选填编号)。
a.只有37C12 b.只有 SO237Cl2 c. 37C12和SO237Cl2 d.无法判断
(4)下列描述中能说明上述反应己达平衡的是 (选填编号)。
a.v (Cl2) =v (SO2)
b.容器中气体压强不随时间而变化
c.c (Cl2) : c (SO2) =1 : 1
d.容器中气体颜色不随时间而变化
28. (8分)(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“ 中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“>”或“=”或“<”下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c (Na+) c (CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
29. (4分)二氧化锰是化学工业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+ O22MnO2+2CO2。经研究发现该反应过程为①MnCO3MnO+ CO2;
②2MnO +O22MnO2。
回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,
用平衡分压代替平衡浓度,碳酸锰热分解反应的平衡常数K= (分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2的关系为 。
(2)反应②在低温下能自发进行,则其△H 0 (填“>”、“<”或“=”)。
30. (8分)开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g)+ H2O(g)CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+2H2O(g)CO2(g)+4H2(g) △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)CO(g) + 3H2(g) △H>0,100°C时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应己经达到平衡状态的
是 。
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
(3)25°C时,在20mL0.lmol/L 氢氟酸中加入VmL0.lmol/LNaOH 溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 。
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9. 9×10-7mol/L
C.②点时,溶液中的c(F- )=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0. lmol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,该反应的化学方程式为 。
1-5DDDCD 6-10 BAADA 11-15DCCBA 16-20.ACCDC 21-22CB
23. (1)量筒、温度计。 (2) -56.8KJ/mol (3)低于,1.5
24.(1) A (2)当加入最后一滴标准液时,溶液恰好出现红色且半分钟内红色不褪去 (3) 0.1000
25.(1) bc (2) bd (3)①1.6×103 ②80% (4) <
26.(1)加快 (2)加快 (3)减慢 (4)加快
27.(1) c (SO2)-1·c (Cl2) -1d (2) ac (3) c (4) bd
28.(1)碱性;> (2)酸性:<
(3)中性;> (4)<; >
29. (1) K = K12K2 (2) <
30.(1) CO(g) + H2OCO2(g)+ H2(g) △H=-41.2 kJ·mol-1 (2分)
(2) cd (2分)
(3) BC (2分)
(4)H2O+HFO=HF+H2O2 (2分)