2018-2019学年山西省长治二中高二上学期期末考试化学试题 Word版
2018—2019学年第一学期高二期末考试化学试题
命题人:张垠宏 审题人:栗慧丽
【本试卷分为选择题和非选择题两部分,共100分。考试时间90分钟】
可能用到的相对原子质量:H 1 C 12 N 14 O 16 K 39 I 127 S 32 Cr 52 Na 23
第Ⅰ卷 (选择题 共48分)
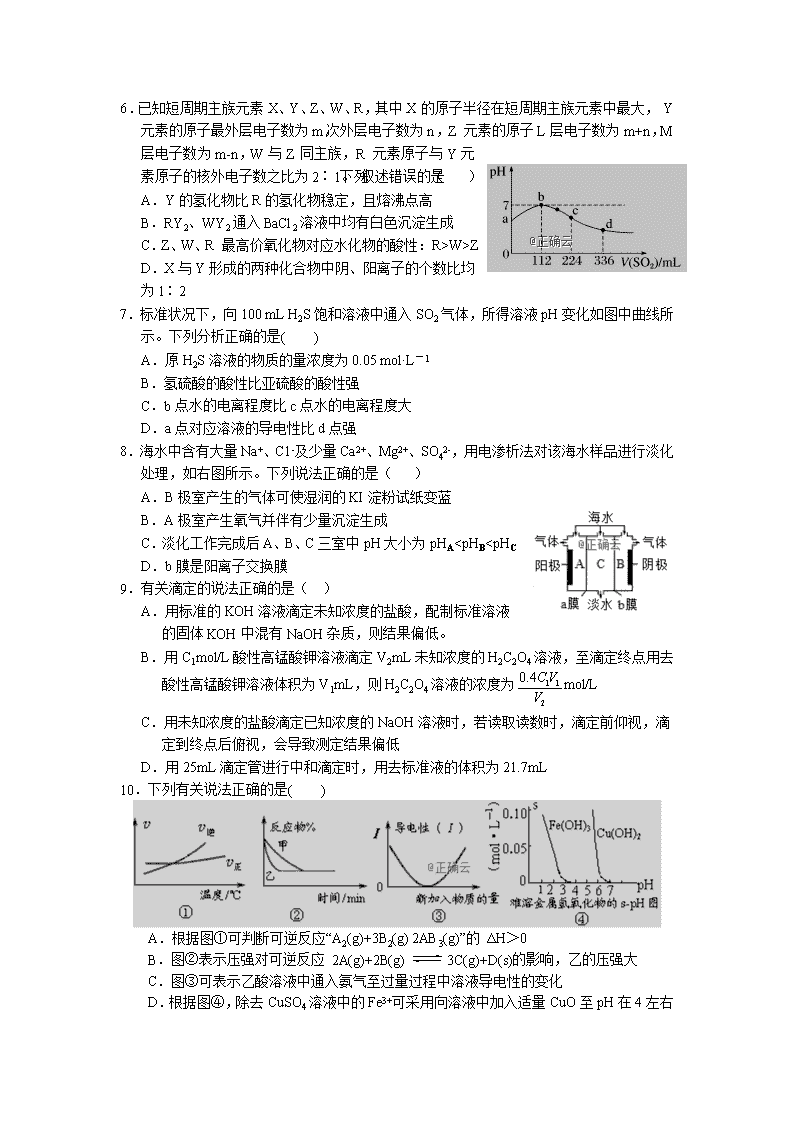
一、单项选择题(每小题3分,共48分)
1.化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质
实际应用
A
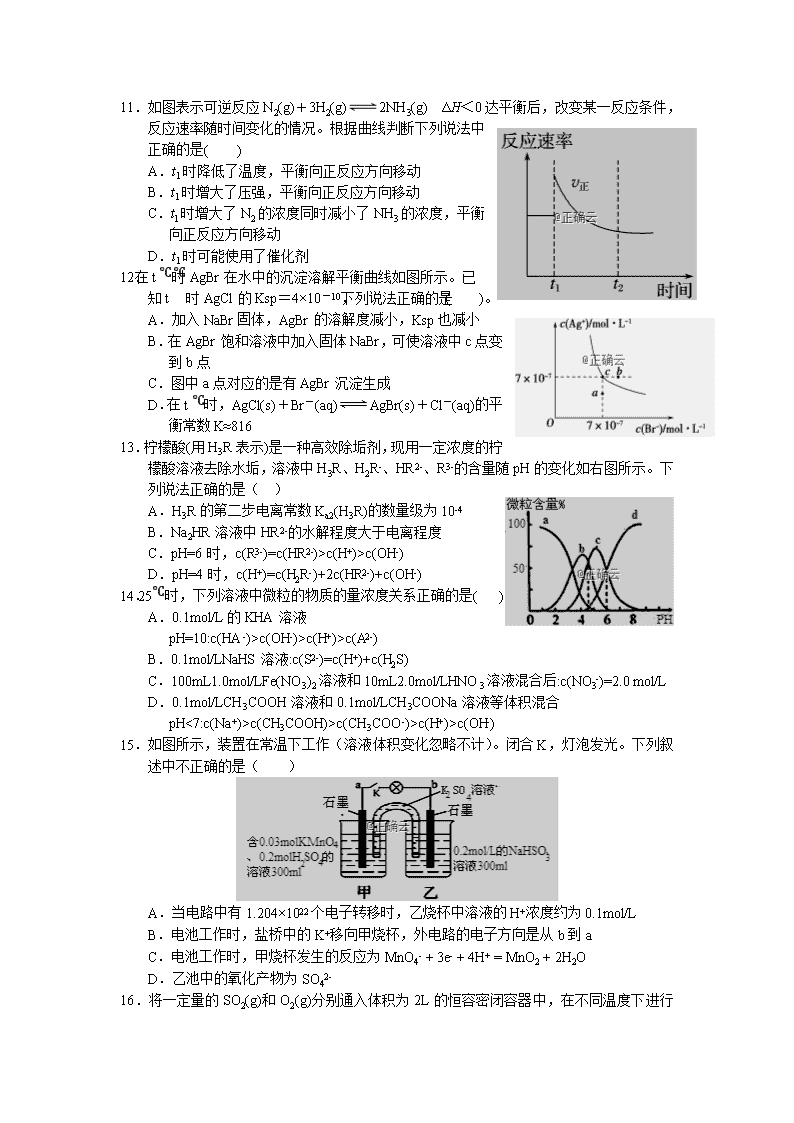
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C
次氯酸盐具有氧化性
漂白粉漂白织物
D
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
2.下列表达式错误的是( )。
A.甲烷的电子式:
B.碳原子的L层电子轨道表示式:
C.硫离子的核外电子排布式:1s22s22p63s23p6
D.碳-12原子:
3.能正确解释下列反应原理,并且书写正确的离子方程式是( )
A.用明矾作净水剂:Al3++3H2O===Al(OH)3↓+3H+
B.用小苏打治疗胃酸过多:CO+2H+===CO2↑+H2O
C.电解MgCl2饱和溶液制取Mg:MgCl2Mg+Cl2↑
D.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO===CaCO3+SO
4.下列说法正确的是( )
A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
B.常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应
C.对于反应①C+CO22CO(△H>0)和反应②N2+3H22NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢
D.NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+
5.反应mA(s)+nB(g)pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率
③x点比y点时的反应速率慢 ④n>p
A.①② B.②④ C.②③ D.①③
6.已知短周期主族元素X、Y、Z、W、R,其中X的原子半径在短周期主族元素中最大, Y元素的原子最外层电子数为m,次外层电子数为n,Z 元素的原子L层电子数为m+n,M层电子数为m-n,W与Z同主族,R 元素原子与Y元素原子的核外电子数之比为2∶1。下列叙述错误的是( )
A.Y的氢化物比R的氢化物稳定,且熔沸点高
B.RY2、WY2通入BaCl2溶液中均有白色沉淀生成
C.Z、W、R 最高价氧化物对应水化物的酸性:R>W>Z
D.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
7.标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是( )
A.原H2S溶液的物质的量浓度为0.05 mol·L-1
B.氢硫酸的酸性比亚硫酸的酸性强
C.b点水的电离程度比c点水的电离程度大
D.a点对应溶液的导电性比d点强
8.海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是( )
A.B极室产生的气体可使湿润的KI淀粉试纸变蓝
B.A极室产生氧气并伴有少量沉淀生成
C.淡化工作完成后A、B、C三室中pH大小为pHA
c(H+)>c(OH-)
D.pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
14.25℃时,下列溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol/L的KHA溶液pH=10:c(HA-)>c(OH-)>c(H+)>c(A2-)
B.0.1mol/LNaHS溶液:c(S2-)=c(H+)+c(H2S)
C.100mL1.0mol/LFe(NO3)2溶液和10mL2.0mol/LHNO3溶液混合后:c(NO3-)=2.0 mol/L
D.0.1mol/LCH3COOH溶液和0.1mol/LCH3COONa溶液等体积混合pH<7:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
15.如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是( )
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.电池工作时,甲烧杯发生的反应为MnO4- + 3e- + 4H+ = MnO2 + 2H2O
D.乙池中的氧化产物为SO42-
16.将一定量的SO2(g)和O2
(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) 2SO3(g) △H<0
实验
编号
温度/℃
平衡常数
起始量/mol
平衡量/mol
达到平衡所需时间/min
SO2
O2
SO2
O2
1
T1
K1
4
2
x
0.8
6
2
T2
K2
4
2
0.4
y
t
下列说法中不正确的是( )
A.x=2.4
B.T1、T2的关系:T1>T2
C.K1、K2的关系:K2>K1
D.实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
第Ⅱ卷 (非选择题 共52分)
17.(12分) (1)某元素原子的价电子构型为4s24p1,该元素的符号为________。
(2)某元素+3价离子的3d轨道半充满,该元素的符号为________。
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A的离子结构示意图为________,B的元素名称为________。
(4)如右图,第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为________<Al<________;(填元素符号)
②图中第一电离能最小的元素在周期表中的位置是第________周期________族。
18.(12分)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为_________________、______________。
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是__________,电解氯化钠溶液的总反应方程式为_____________________________________。
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为______(法拉第常数F=9.65×104 C · mol-1,列式计算),最多能产生的氯气体积为________L(标准状况)。
19.(12分)一氯胺(NH2Cl,Cl呈+1价)可用于制备液体火箭燃料偏二甲肼。
实验一:制备NH2Cl实验室制备一氯胺可用氨气与次氯酸钠反应,反应方程式为NH3+NaClO═NH2Cl+NaOH。某实验小组设计如下装置制备NH2Cl。
(1)B装置的作用为_________________
(2)C中盛装的是饱和食盐水,则惰性电极b应与电源___极相连。
(3)先电解一段时间后,接下来的实验操作是___。
实验二:检测自来水中的一氯胺的含量.一氯胺是重要的水消毒剂,利用碘量法可以检测自来水中一氯胺的含量.其主要方法为:取已加入一氯胺的自来水20.00mL.加入过量的碘化钾溶液,充分反应后,用0.100 mol•L-1的Na2S2O3溶液进行滴定,达到终点时,消耗Na2S2O3溶液5.00 mL.
已知:NH2Cl+3I-+2H2O═NH3•H2O+OH-+Cl-+I3-
I3-I2+I- I2+2S2O32-═2I-+S4O62-
(4)滴定时用___作指示剂,判定达到滴定终点的现象是___.
(5)该自来水中一氯胺的浓度为___mol•L-1.
20.(16分)利用钛白粉厂的废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:
已知:i.部分离子完全生成氢氧化物沉淀的pH:
金属离子
TiO2+
Fe3+
Fe2+
Al3+
开始沉淀的PH
1.2
1.9
7.0
3.2
沉淀完全的pH
2.8
3.1
9.4
4.7
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是 (填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有 。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式: 2[Fe(NH3)2]2+ + +4H2O +H2O2 = + 4NH3·H2O 。
(5)电解制备过二硫酸铵的装置如下图所示。
①S2O82-中S元素的化合价为+6,1mol S2O82-过氧键的数目为 。
②电解时,铁电极连接电源的 极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。
在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为 ,阳极的电极反应式为 。
2018—2019学年第一学期高二期末化学试题答案
1
2
3
4
5
6
7
8
B
B
D
B
C
B
C
D
9
10
11
12
13
14
15
16
A
D
C
D
C
A
C
A
17.(12分)
(1)Ga (2)Fe (3) 钙 (4) ①Na Mg;(2分) ②五 IA(2分)
18.(12分)(每空2分)
答案:(1)O2+2H2O+4e-===4OH- CH4+10OH--8e-=== CO32-+7H2O
(2)H2 2NaCl+2H2O2NaOH+H2↑+Cl2↑(3)×8×9.65×104 C·mol-1=3.45×104 C 4
19.(12分)(每空2分)
答案:(1)安全瓶;(2)正;(3)先打开止水夹,再打开分液漏斗的活塞;
(4)淀粉;溶液由蓝色变为无色,且半分钟颜色不再变化;(5)0.0125.
20.(16分)(每空2分)
(1)铁粉 (2分)
(2)Fe2O3 (2分)
(3)Fe(OH)3 (2分)(4)4OH- 2Fe(OH)3↓ (2分)
(5)① 1NA 或6.02×1023(2分) ; ② 负 (2分) ; ③ 0≤pH≤2 (2分) ; 2HSO4- - 2e- = S2O82- + 2H+ (2分)