江苏省姜堰二中2018-2019学年高二上学期第二次月考化学试卷
姜堰二中2018~2019学年度第二学期月检测二
高二化学试题(选修)2018.12.20
命题人:钱春圣
考试时间:100分钟 满分:120分
可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 S-32 Zn-65 Cu-64 Ag-108
第I卷 选择题(共40分)
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
1.某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的氢氧化钠溶液中,由水电离出的c(H+)=10-11mol·L-1。在相同温度下,0.1mol·L-1氢氧化钠溶液的pH应为( )
A. 13 B. 12 C. 11 D. 10
2.元素原子的最外层电子排布式为4s1的元素种类有
A. 3种 B.9种 C. 1种 D. 2种
3.下列生活中常见物质的用途与其还原性或氧化性有关的是
A. N2充入食品袋中用作防腐剂 B. 铁粉用于“暧宝宝”的发热剂
C. 氢氧化铝、小苏打用于治疗胃酸过多 D. SO2用于漂白草帽、竹编物品
4.如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵
溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
A. 生铁块中的碳是原电池的正极
B. 两试管中相同的电极反应式是 Fe-2e-=Fe2+
C. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
D. 红墨水柱两边的液面变为左低右高
5.在由水电离出的c(H+)=1×10-12mol·L-1的溶液中,一定能大量共存的离子组是( )
A. NH4+、Ba2+、NO3-、Cl- B.Na+、K+、ClO-、I-
C. SO42-、NO3-、Fe2+、Mg2+ D.Cl-、NO3-、Na+、K+
6.对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. KAl(SO4)2溶液加热 B. NH4NO3溶液中加入少量NaNO3固体
C. 氨水中加入少量NH4Cl固体 D. Na2CO3溶液加热
7.体积10 mL浓度为1 mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是
A. CH3COONa B. KOH溶液 C.几滴 CuSO4溶液 D. NaNO3溶液
8.铅蓄电池是典型的可充型电池,电池总反应式为:
Pb+PbO2+4H++2SO42-2PbSO4+2H2O,下列说法正确的是
A. 放电时,负极的电极反应式是 : PbO2+2e-+4H++SO42-=PbSO4+2H2O
B. 放电时,电解液中H2SO4的浓度将不变
C. 充电时,当外电路通过1mol电子时,原负极板的质量理论上减少48g
D. 充电时,阳极电极反应式为:PbSO4+2e-=Pb+SO42-
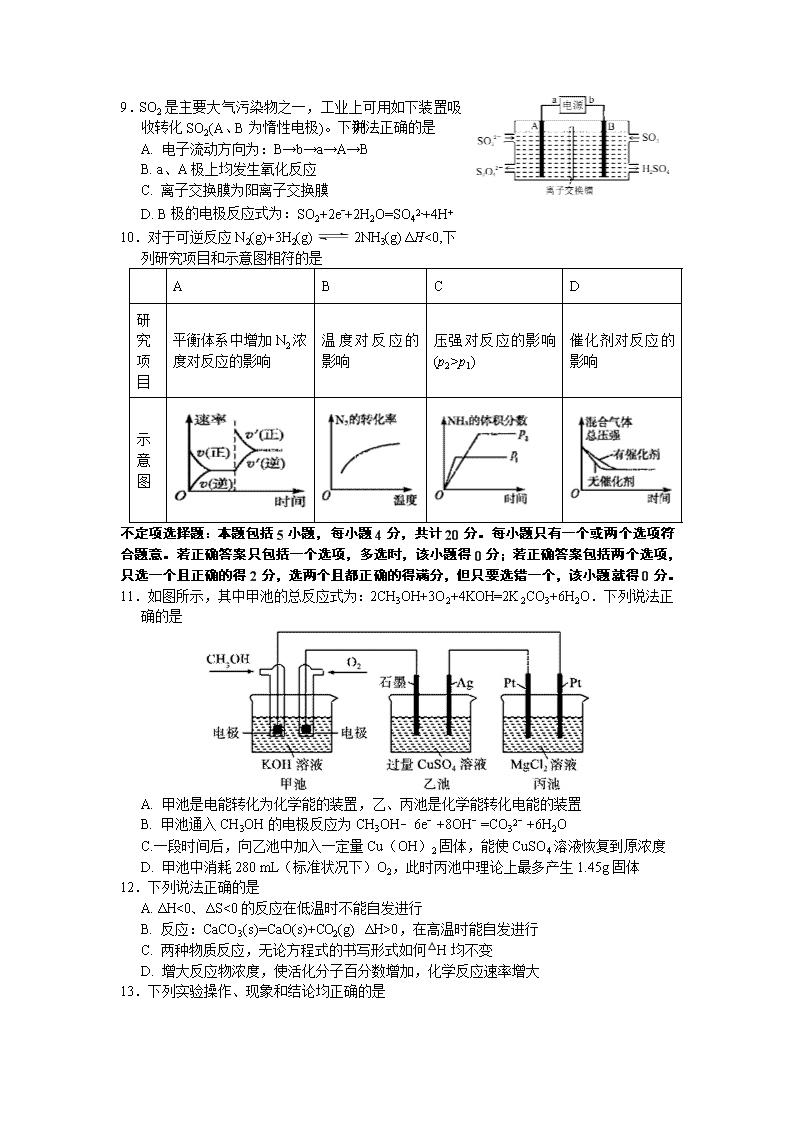
9.SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是
A. 电子流动方向为:B→b→a→A→B
B. a、A极上均发生氧化反应
C. 离子交换膜为阳离子交换膜
D. B极的电极反应式为:SO2+2eˉ+2H2O=SO42-+4H+
10.对于可逆反应N2(g)+3H2(g)2NH3(g) ΔH<0,下
列研究项目和示意图相符的是
A
B
C
D
研
究
项
目
平衡体系中增加N2浓度对反应的影响
温度对反应的影响
压强对反应的影响(p2>p1)
催化剂对反应的影响
示意图
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.下列说法正确的是
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应为CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O
C.一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
12.下列说法正确的是
A. ΔH<0、ΔS<0的反应在低温时不能自发进行
B. 反应:CaCO3(s)=CaO(s)+CO2(g) ΔH>0,在高温时能自发进行
C. 两种物质反应,无论方程式的书写形式如何△H均不变
D. 增大反应物浓度,使活化分子百分数增加,化学反应速率增大
13.下列实验操作、现象和结论均正确的是
实验操作
现象
结论
A
将少量的饱和硼酸溶液滴加到碳酸钠溶液中
无气泡
酸性:碳酸>硼酸
B
室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH
蘸取NaClO溶液的试纸蓝色更深
HClO的酸性比CH3COOH弱
C
用石墨电极电解等浓度Mg(NO3)2、Cu(NO3)2混合溶液
电极上产生紫红色物质
铜的金属活动性比镁弱
D
向1mL2mol/L的NaOH溶液中,滴加1~2滴1mol/ L MgCl2溶液,再滴加2滴1mol/ L FeCl3溶液
先有白色沉淀,后有红褐色沉淀
Ksp:
Mg(OH)2>Fe(OH)3
14. 25 ℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关叙述不正确的是
A. pH=5.5溶液中:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 由图可知该温度下醋酸的电离常数为1×10-4.75
C. pH=3.5溶液中:
c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D. 向1 LW点所表示溶液中通入0.05 mol HCl气体(溶液体积
变化可忽略):
2c(OH-)+c(CH3COOH)=c(CH3COO-)+2c(H+)+2c(Cl-)
15.对利用甲烷消除NO2污染进行研究,CH4+2NO2 N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。有关说法正确的是
组别
温度
时间/min
n/mol
0
10
20
40
50
①
T1
n(CH4)
0.50
0.35
0.25
0.10
0.10
②
T2
n(CH4)
0.50
0.30
0.18
…
0.15
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T1
②
第II卷 非选择题(共80分)
16.(12分) 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程图如下:
(1)将菱锌矿研磨成粉的目的是____________。
(2)写出Fe3+水解的离子方程式_____________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
沉淀化学式
Mg(OH)2
Zn (OH)2
MgCO3
CaCO3
开始沉淀的pH
10.4
6.4
—
—
沉淀完全的pH
12.4
8.0
—
—
开始溶解的pH
—
10.5
—
—
Ksp
5.6×10-12
—
6.8×10-6
2.8×10-9
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是_______选填序号。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.氨水
(5)“滤液4”之后的操作依次为_______、_______、过滤,洗涤,干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于_______。(用代数式表示)
17.(15分) 氯气在生产生活中有广泛的用途,制取氯气的途径有多种。完成下列填空:
(1)工业上用惰性电极电解饱和食盐水制取氯气,氯气在电解池的______极产生,电解的总反应的离子方程式为 ;
向次氯酸钠溶液中加入少量稀盐酸,可以增强消毒漂白效果,这是因为增大了溶液中次氯酸的浓度,次氯酸的电子式为 。
(2)实验室常用排饱和食盐水的方法收集氯气,请用平衡移动原理解释用饱和食盐水而不用水的原因:_______________________________________________________。
(3)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:
2NO(g)+Cl2(g)2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol 的NO和Cl2以不同的氮氯比[n(NO)/ n(Cl2)]进行反应,平衡时某反应物的转化率与氮
氯比及不同温度的关系如图所示:
①图中T1、T2的关系为:T1______T2 (填“>”、“<”或“=”);
②图中纵坐标为物质__________的转化率;
③图中A、B、C三点对应的NOCl体积分数最大的是________(填“A”、“B”、或“C”);
④若容器容积为2L,则B点的平衡常数的值为____________。
18.(12分) 如图所示的装置中,三个烧杯中的溶液体积均为200mL,A中KCl足量。若通入直流电5 min时,铜电极质量增加2.16 g,B中共收集224 mL气体(标准状况),溶液体积的变化忽略不计。回答下列问题:
(1)电源电极X的名称为________;
(2)pH变化:A_______,B_______,C_______;(填“增大”“减小”或“不变”)
(3)求通电前B中CuSO4溶液的物质的量浓度;(写出计算过程)
(4)通电后A中溶液的pH。(写出计算过程)
19.(10分) CH3COOH、H2CO3、H2SO3的电离常数如下表所示。
酸
电离常数
CH3COOH
K = 1.8×10 -5
H2CO3
K1= 4.3×10 -7,K2= 5.6×10 -11
H2SO3
K1=1.54×10-2 , K2=1.02×10-7
请回答下列问题:
(1)NaHSO3溶液中共存在7种微粒,它们是Na+、HSO3-、H+、SO32-、H2O、________、
_________(填微粒符号)。
(2)常温下,物质的量浓度相同的下列溶液 :
①NH4Cl ② NH4HCO3 ③(NH4)2SO4 ④ NH4HSO4
溶液中c(NH4+)最大的是:_________,最小的是:______(填序号)
(3)常温下,物质的量浓度均为0.1mol/L的六种溶液①NaOH、②NaCl、③Na2CO3、
④H2SO3、⑤CH3COONa、⑥H2SO4,pH从大到小排列顺序为___________(填序号)
(4)常温时,AlCl3的水溶液呈酸性,原因是(用离子方程式表示):_____________
将AlCl3溶液蒸干,灼烧,最后得到的固体产物主要是________(填化学式)
20.(14分) 工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g) + 2O2(g)= 2NO2(g) △H= +133 kJ/mol
H2O(g) =H2O(l) △H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为_________。
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g)CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是__________________。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(2)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应
CO(g) + 2H2(g) CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与
n(H2)/n(CO)的关系如图所示。
①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率V(H2)=___________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________点(选填“D”、“E”或“F”)
Ⅲ.脱硫:
如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_____________,阴极的电极反应式是________________________。
21.(17分) 硫氰化钾(KSCN)是重要的化学试剂和药品。它易溶于水,水溶液呈中性。
完成下列填空:
(1)钾原子的电子排布式为____________。碳原子的结构示意图为______;C、N、O
三种原子的第一电离能的大小顺序为_______________。
(2)KSCN水溶液呈中性,则硫氰酸(HSCN)的电离方程式为__________________;
硫氰化铵(NH4SCN)溶液中各种离子浓度由大到小的顺序是______________。
(3)铁元素在溶液中通常有Fe2+和Fe3+两种存在形态,Fe2+的电子排布式为____________,
它的稳定性比Fe3+_________(填“强”或“弱”)。若用KSCN溶液检验氯化亚铁溶液是
否变质,实验方法是_________________。
高二化学期中考试参考答案
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A
B
B
D
D
D
A
C
C
A
BD
B
C
AD
BC
16. (1)增大反应物接触面积或增大反应速率或使反应更充分
(2)Fe3++3H2OFe(OH)3+3H+
(3)8.0≤pH<10.4或8.0~10.4
(4)bd
(5)蒸发浓缩(1分) 冷却结晶(1分)
(6)125m2/99m1 (除标注分值的其余每空2分)
17. (1)阳(1分) 2Cl-+2H2O = H2 +Cl2+2OH-
(2)氯气溶于水生成盐酸和次氯酸的反应是可逆反应(Cl2+H2OHCl+HClO),饱和食盐水中有大量的氯离子,会使上述平衡向左移动,抑制了氯气与水的反应,从而减少了氯气在水中溶解的量
(3)①< ②Cl2 ③A ④160 (除标注分值的其余每空2分)
18. (1)负极 (2)增大 减小 不变(每空1分) (3)0.025 mol·L-1(4分) (4)13(4分)
19. (1)OH- H2SO3 (2)③ ②(每空1分)
(3)①>③>⑤>②>④>⑥
(4)Al3++3H2OAl(OH)3+3H+ Al2O3(每空2分)
20. Ⅰ.4H2(g)+2NO2(g)=N2(g)+4H2O(g) △H= -1100.2kJ/mol
Ⅱ.(1)DE (2)①0.08mol·L-1· min-1 减小 ②F
Ⅲ. H2SO4 NO+6H++5e-=NH4++H2O(每空2分)
21. (1)1s22s22p63s23p64s1 N>O>C
(2)HSCN = H++SCN- c(SCN-)>c(NH4+)>c(H+)>c(OH-)
(3)1s22s22p63s23p63d6 弱(每空2分) 取样,向其中滴加KSCN溶液,若变血红色,证明FeCl2溶液已经变质,若不变红,则未变质(3分)