- 2021-08-06 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2016-2017学年高二化学人教版选修4 (第2
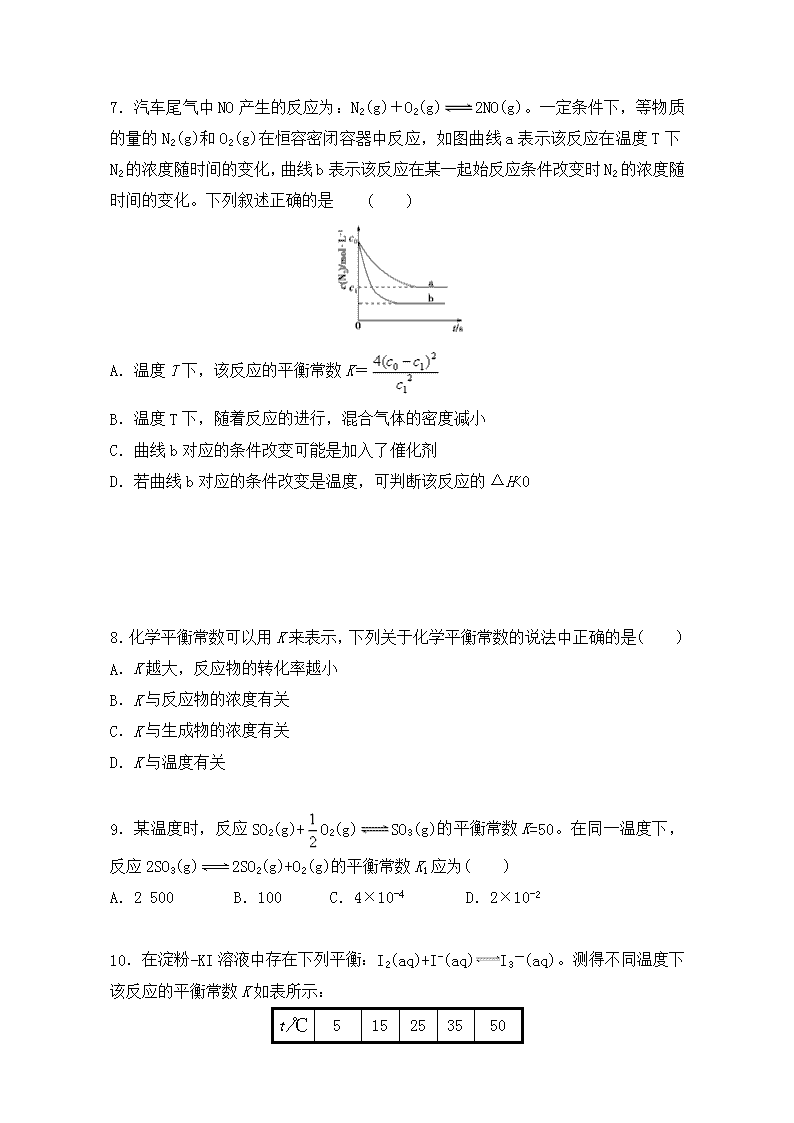
绝密★启用前 人教版《选修四》第二章第三节 化学平衡常数 一、选择题 1.下列对化学平衡常数K的描述中,正确的是( ) A.K越大,正反应进行的程度越大 B.温度升高,K值增大 C.反应物的转化率增大时,K值一定增大 D.平衡向逆反应方向移动时,K值减小 2.在密闭容器中发生如下反应mA(g)+nB(g)pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( ) A.m+n>p B.平衡向逆反应方向移动 C.A的转化率提高 D.C的体积分数增加 3.一定温度下,在容积为2 L的密闭容器中发生反应CO(g)+H2O(g)CO2(g)+H2(g),部分数据见下表(表中t2>t1)。 反应时间/min 0 t1 t2 n(CO)/mol 1.20 0.80 n(H2O)/mol 0.60 0.20 n(CO2)/mol 0 n(H2)mol 0 下列说法正确的是( ) A.反应在t1 min内的平均速率为v(H2)= mol·L-1·min-1 B.平衡时CO的转化率为66.67% C.该温度下反应的平衡常数为1 D.其他条件不变,若起始时n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20 mol 4.等物质的量的X(g)与Y(g)在密闭容器中进行反应:X(g)+2Y(g)3Z(g)+Q(s) △H>0,下列叙述正确的是( ) A.当容器中X与Y的物质的量之比满足1∶2时反应达到平衡 B.达到平衡时X的转化率为25%,则平衡常数K为9/4 C.达到平衡后,反应速率2v正(Y)=3v逆(Z) D.达到平衡后,加入Q,平衡逆向移动 5.一定温度下,在容积为1 L的密闭容器中,存在如下关系:xH2O(g)(H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是( ) A.x=3 B.该温度下,反应的平衡常数为0.125 L2/mol2 C.平衡时混合气体的平均摩尔质量是33.3 g/mol D.t1时刻,保持温度不变,再充入1 mol H2O(g),重新达到平衡时,将增大 6.已知在25℃时,下列反应的平衡常数如下: ①N2(g)+O2(g)2NO(g) K1=1×10-30 ②2H2(g)+O2(g)2H2O(g) K2=2×1081 ③2CO2(g)2CO(g)+O2(g) K=4×10-92 下列说法正确的是( ) A.NO分解反应NO(g)N2(g)+O2(g)的平衡常数为1×10-30 B.根据K2的值可以判断常温下H2和O2很容易反应生成H2O C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2 D.温度升高,上述三个反应的平衡常数均增大 7.汽车尾气中NO产生的反应为:N2(g)+O2(g)2NO(g)。一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是 ( ) A.温度T下,该反应的平衡常数K= B.温度T下,随着反应的进行,混合气体的密度减小 C.曲线b对应的条件改变可能是加入了催化剂 D.若曲线b对应的条件改变是温度,可判断该反应的ΔH<0 8.化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( ) A.K越大,反应物的转化率越小 B.K与反应物的浓度有关 C.K与生成物的浓度有关 D.K与温度有关 9.某温度时,反应SO2(g)+O2(g)SO3(g)的平衡常数K=50。在同一温度下,反应2SO3(g)2SO2(g)+O2(g)的平衡常数K1应为( ) A.2 500 B.100 C.4×10-4 D.2×10-2 10.在淀粉-KI溶液中存在下列平衡:I2(aq)+I-(aq)I3-(aq)。测得不同温度下该反应的平衡常数K如表所示: t/℃ 5 15 25 35 50 K 1 100 841 689 533 409 下列说法正确的是( ) A.反应I2(aq)+I-(aq)I3-(aq)的ΔH>0 B.其他条件不变,升高温度,溶液中c(I3-)减小 C.该反应的平衡常数表达式为K= D.25 ℃时,向溶液中加入少量KI固体,平衡常数K大于689 11.某温度下,向容积为1 L的密闭反应器中充入0.10 mol SO3,当反应器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g)2SO3(g)的平衡常数为( ) A.8.0×102 B.1.6×103C.3.2×103 D.4.0×102 12.在一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2发生如下反应:2SO2(g)+O2(g)2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不发生改变的是( ) A.保持温度和容器体积不变,充入1 mol SO3(g) B.保持温度和容器压强不变,充入1 mol SO3(g) C.保持温度和容器压强不变,充入1 mol O2(g) D.保持温度和容器压强不变,充入1 mol Ar(g) 二、非选择题 13.氨是重要的氮肥,合成原理为:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。回答下列问题: (1)写出平衡常数K的表达式_________________________________________, 如果降低温度,该反应K值____________,化学反应速率______,N2的转化率______。(填“增大”、“减小”或“不变”) (2)在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的物质的量随时间的变化如图所示,回答下列问题: ①10 min内以NH3表示的平均反应速率为_________________________________。 ②在10~20 min内,NH3浓度变化的原因可能是( ) A.使用了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量 ③第1次平衡的时间为:____________,第2次平衡的时间为:____________, 第1次平衡:平衡常数K1= _____________________________________________________ (带数据的表达式),第2次平衡时NH3的体积分数__________; ④在反应进行至25 min时,曲线发生变化的原因: _______________________________,达第二次平衡时,新平衡的平衡常数 K2______K1(填“大于”、“小于”或“等于”)。 14.煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。已知:CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数随温度的变化如表所示: 温度/℃ 400 500 800 平衡常数K 9.94 9 1 试回答下列问题: (1)上述反应的化学平衡常数表达式为________________________。 (2)在800 ℃发生上述反应,以下表中物质的物质的量投入恒容反应器中,其中向正反应方向移动的有________(填“A”、“B”、“C”、“D”或“E”)。 n(CO) n(H2O) n(H2) n(CO2) A 1 5 2 3 B 2 2 1 1 C 3 3 0 0 D 0.5 2 1 1 E 3 1 2 1 (3)已知在一定温度下,C(s)+CO2(g)2CO(g)的平衡常数为K;C(s)+H2O(g)CO(g)+H2(g)的平衡常数为K1;CO(g)+H2O(g)H2(g)+CO2(g)的平衡常数为K2;则K、K1、K2之间的关系是____________。 (4)向V L密闭容器中通入10 mol CO和10 mol水蒸气,在T℃时达到平衡,然后快速通过碱石灰,将所得的混合气体燃烧,测得放出的热量为2842 kJ(已知CO的燃烧热为283 kJ·mol-1,H2的燃烧热为286 kJ·mol-1),则T℃时的化学平衡常数K=________。 15.在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题: (1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。 (2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。 ①T________100 ℃(填“大于”或“小于”),判断理由是_____________________。 ②列式计算温度T时反应的平衡常数K2________________________。 (3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是________________________。 16.实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题: (1)已知某温度下某反应的化学平衡常数表达式为:K=,它所对应的化学反应为:________________________。 (2)已知在一定温度下, ①C(s)+CO2(g)2CO(g) ΔH1=a kJ/mol 平衡常数K1; ②CO(g)+H2O(g)H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2; ③C(s)+H2O(g)CO(g)+H2(g) ΔH3 平衡常数K3。 则K1、K2、K3之间的关系是________,ΔH3=____________________(用含a、b的代数式表示)。 (3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示: 温度/℃ 400 500 800 平衡常数K 9.94 9 1 该反应的正反应方向是________反应(填“吸热”或“放热”),若在500 ℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为________。 人教版《选修四》第二章第三节 化学平衡常数 参考答案与解析 一、选择题 【答案】 1.A 【解析】温度升高时,对于放热反应,K将减小,对于吸热反应,K才增大,B项错误;因为K只与温度有关,而平衡移动的方向还与其他多种因素有关,也就是说当平衡右移时,K值不一定增大,C、D项错误。 【题型】选择题 【难度】容易 【答案】 2.B 【解析】气体体积缩小到原来的,相当于加压,若平衡不移动,各物质的浓度应为原来的2倍。现在C的浓度为原来的1.9倍,说明平衡向逆反应方向移动,A的转化率减小,C的体积分数减小。根据勒夏特列原理,m+n查看更多